2016年7月1日
理化学研究所
がん免疫の課題を克服する治療モデルを構築
-自然免疫と獲得免疫両方を活性化させる画期的ながん免疫療法の可能性-
要旨
理化学研究所(理研)統合生命医科学研究センター免疫細胞治療研究チームの藤井眞一郎チームリーダーらの研究チーム※は、マウスを用いて、現在開発しているがん治療製剤「人工アジュバントベクター細胞(aAVC)[1]」に特徴的な抗がん作用機構を解明しました。
生体防御を担う免疫系には、先天的に備わった「自然免疫」と生後獲得していく「獲得免疫」があります。がん細胞は、その種類により自然免疫と獲得免疫に対する感受性が異なっています。そのため、がんを完全に排除するには自然免疫と獲得免疫の両者の活性化が必要となります。藤井眞一郎チームリーダーらは、2009年この2つの免疫系を活性化させるaAVCを開発し、その有効性を解明する研究を進めてきました。
今回研究チームは、aAVCによる治療効果についてマウスの腫瘍組織内の微小環境に注目して解析を行いました。腫瘍が十分大きくなった時期にaAVCを静脈内投与すると、腫瘍が壊死を起こし、縮小することが分かりました。このメカニズムを解明するために腫瘍組織を解析した結果、aAVC治療群のマウスでは腫瘍血管が接着分子を強発現し、その周囲に存在する樹状細胞[2]がT細胞走化性CXCL10というケモカイン[3]を発現することで、活性化キラーT細胞[4]を集めることを明らかにしました。つまりaAVC療法によって、通常は腫瘍内に入り込むことができないキラーT細胞が腫瘍内にアクセスできるようになることを突き止めたということです。
さらに、研究チームはaAVCをマウスに投与し1年後に解析したところ、全身性に抗原特異的なメモリーキラーT細胞[4]が維持され、再度同じ抗原に遭遇すると、このメモリーキラーT細胞が増幅して免疫を活性化させることが分かりました。このことはがんに対する記憶免疫[5]が誘導でき、腫瘍局所のみならず転移および再発予防のために有効であることを示したことになります。
これらの発見は、本がん治療製剤が従来のがんワクチン療法での2つの問題点を克服できたことになり、がん治療に向けて新しい効果を期待できることを意味します。
研究チームは、治験に向け、新たな細胞製剤開発の研究を進めています。本研究は、東京大学橋渡し拠点、AMED(橋渡し研究加速ネットワークプログラム)の支援により行われました。成果は、米国のがん学会科学雑誌『Cancer Research』(7月1日付け)に掲載されます。
※研究チーム
理化学研究所 統合生命医科学研究センター 免疫細胞治療研究チーム
チームリーダー 藤井 眞一郎(ふじい しんいちろう)
上級研究員 清水 佳奈子(しみず かなこ)
研究員 山崎 哲(やまさき さとる)
特別研究員 佐藤 悠輔(さとう ゆうすけ)
背景
生体防御を担う免疫系には、先天的な免疫システムでさまざまな種類の抗原を対象に初期防衛を担う「自然免疫」と、抗体や多様な細胞性免疫応答によって特定の異物を認識し排除する「獲得免疫」があり、両者が協調して働いています。
自然免疫には、異常な細胞を殺傷するナチュラルキラー細胞(NK細胞)[6]とナチュラルキラーT細胞(NKT細胞)[6]、病原体や死んだ細胞を貧食するマクロファージと好中球、樹状細胞などが関わっています。獲得免疫には、T細胞と抗体を産生するB細胞といったリンパ球が関与しています。T細胞には、細胞傷害活性の高いキラーT細胞と、B細胞やキラーT細胞の分化・増殖・機能を補助するヘルパーT細胞があります。獲得免疫の一部の細胞は「記憶免疫」という機能を持ち、再び同じ異物が侵入したら、すばやく攻撃を開始できるようになっています。また、樹状細胞は、自然免疫と獲得免疫の両方を連結させる“司令塔”としての役割を担っています。
がん細胞は、その種類により自然免疫と獲得免疫に対する感受性が異なっています。そのため、がんを完全に排除するには、自然免疫と獲得免疫の両者の活性化が必要となります。
研究チームは、NKT細胞だけを活性化するリガンドの1つ糖脂質のα-GalCer(アルファ-ガラクトシルセラミド[7])を用いて、自然免疫と獲得免疫の活性化の連鎖について研究してきました。NKT細胞はα-GalCerの刺激を受けて活性化されると、生体内に存在する樹状細胞を活性化させます。この現象を利用して、2つの免疫システムを同時に誘導できるように、がん抗原とα-GalCerを同時に発現させた「人工アジュバントベクター細胞(aAVC)」を考案しました。アジュバントは“免疫反応を増幅させる”こと、ベクターは“運び屋”を意味します。
従来のがん免疫療法では、腫瘍周囲の微小環境が改善出来ずにキラーT細胞ががん部位に辿り着けないことや抗がん効果が長続きしない問題点が指摘されてきました。今回、研究チームはマウスを用いて、このような点を克服できるがん免疫治療薬の抗がん効果とそのメカニズムの解明を試みました。
研究手法と成果
最初に、研究チームがこれまでに確立したaAVCの作製方法を説明します。将来のaAVCの製剤化を見据えて、ベクター細胞には自分自身の細胞(自家細胞)ではなく、他者由来の細胞(他家細胞、マウス用NIH3T3細胞、ヒト用HEK293細胞)を使用します。ベクター細胞に、NKT細胞のリガンドであるα-GalCerを添加し、CD1d[8]という分子のmRNAと標的とするがん細胞の抗原タンパク質のmRNAを遺伝子導入することにより、細胞表面上にCD1d分子を、細胞質内に標的がん抗原タンパク質を効率よく合成させることができます。それぞれの細胞にα-GalCerを添加培養させ、CD1d上にα-GalCerを発現させたCD1d/α-GalCer複合体が発現し、aAVCが完成します。(図1)。
次に、卵白アルブミン(OVA)抗原を発現するがん細胞の「マウス悪性黒色腫細胞」を用いて、体内にがんを持つマウス(担がんマウス)のがん治療効果を調べました。腫瘍が十分大きくなった時期に、OVA抗原を発現したaAVCを静脈内投与すると、腫瘍は壊死を起こし、縮小することが分かりました(図2A)。
また、腫瘍組織内の変化を詳しく調べたところ、樹状細胞(CD11c)とキラーT細胞(CD8)が多数集まっていることが分かりました(図2B、2C)。T細胞などのリンパ球が血管から組織へ移動するためには、血管内皮細胞にICAM-1やVCAM-1[9]などの接着分子の発現が必要ですが、腫瘍血管は正常な血管とは異なり、このような接着分子は発現しません。ところが、aAVC治療群のマウスでは腫瘍血管が接着分子を強発現し、その周囲に存在する樹状細胞がCXCL10というケモカインを発現することで、活性化キラーT細胞を集めることができることが分かりました。
さらに研究チームは、aAVCの長期効果持続性を検討しました。マウスにaAVCを1回投与し、そのマウスを1年後に解析したところ、リンパ組織(リンパ節、脾臓・骨髄)だけではなく、非リンパ組織(肺・肝臓)にもメモリーキラーT細胞が維持されていました。そして、再度同じ抗原に遭遇すると、このメモリーキラーT細胞は増幅することが分かりました(図3)。つまり、免疫機能がさらに高まっていたのです。
樹状細胞の機能を知るために、aAVCを投与した後、脾臓の樹状細胞を経時的に調べました。すると、キラーT細胞を活性化する樹状細胞の共刺激分子(CD80、CD86)に加え、メモリーキラーT細胞を誘導するのに重要な分子(CD70、41BBL、IL15Ra)も強発現することが分かりました。このような樹状細胞の成熟化がメモリーキラーT細胞の誘導に深く関わっていることを突き止めました(図4)。
長期メモリーキラーT細胞が誘導されることは、再度がんが発生した場合に短時間で消失させることができることを意味します。がんの再発や転移を抑えるためには、一過性の免疫応答だけでなく、記憶免疫によってがんの免疫監視機構を確立する必要があります。本研究結果は、そのような可能性のある薬を開発できたことを示唆します。
研究チームは現在、今回得られた新しい抗がん効果とそのメカニズムをもとに、理研創薬プログラムのプロジェクトとして臨床治験に向けて、WT1[10]抗原を発現したaAVC(aAVC-WT1)細胞製剤開発の研究を進めています。薬理薬効試験としてマウスモデルで、WT1抗原発現骨髄腫を接種した担がんマウスをaAVC-WT1で治療する実験を行いました。未治療群は1カ月以内に死亡するのに対し、治療群は約75%が生存し、3カ月以上生存したマウスに再度腫瘍を接種しても腫瘍を拒絶することが分かりました。これは前述したように、実際の腫瘍に対してもメモリーキラーT細胞が機能することを証明したことになります。
今後の期待
従来の細胞療法は、患者本人の自己血液由来の細胞を採取するオーダーメード療法だったため、医薬品としての開発が困難でした。その点、他家細胞を利用するaAVCは品質の安定化を図ることができ、医薬製剤化が期待できるプラットフォームです。
今回の発表内容であるaAVCにより樹状細胞の成熟化が起こることによって、がん局所での免疫環境を好転させることと記憶免疫を全身性に誘導できることは、がん治療に対する新しい作用機序です。これらの発見は、本がん治療製剤が医療に向けて新しい効果を期待できることを意味します。
原論文情報
- Kanako Shimizu, Satoru Yamasaki, Jun Shinga, Yusuke Sato, Takashi Watanabe, Osamu Ohara, Kiyotaka Kuzushima, Hideo Yagita, Yoshiko Komuro, Miki Asakura, and Shin-ichiro Fujii, "Systemic DC activation modulates the tumor microenvironment and shapes the long-lived tumor-specific memory mediated by CD8+ T cells", Cancer Research, doi: 10.1158/0008-5472.CAN-15-3219
発表者
理化学研究所
統合生命医科学研究センター 免疫細胞治療研究チーム
チームリーダー 藤井 眞一郎(ふじい しんいちろう)
 藤井 眞一郎
藤井 眞一郎
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.人工アジュバントベクター細胞(aAVC)
がんの免疫療法で研究が進められている人工細胞。他家細胞(マウス用にはNIH3T3細胞を、ヒト用にはHEK293細胞)に、CD1d分子のmRNAと標的がん抗原分子のmRNAを遺伝子導入させ、CD1d上にアルファガラクシトシルセラミド(α-GalCer)を発現させた細胞。アシュバントとは免疫反応を増幅させること、ベクターは運び屋をいう意味。aAVCは、artificial adjuvant vector cellsの略。 - 2.樹状細胞
樹状突起を持つ白血球。微生物の排除やT細胞に異物の情報を伝える細胞(抗原提示細胞)として働き、免疫反応の本質的な司令塔としての役割を担っている。 - 3.ケモカイン
リンパ球などの走化性、活性化に関わるタンパク質。 - 4.キラーT細胞、メモリーキラーT細胞
獲得免疫をつかさどるT細胞には、標的異物(ウイルスやがん細胞)に対して、攻撃、殺傷能を持つキラーT細胞とB細胞やキラーT細胞の分化・増殖・機能を補助するヘルパーT細胞がある。メモリーキラーT細胞は、その機能を記憶できているT細胞のことで、再度抗原に遭遇すると、短時間で強力に標的異物を攻撃できる。 - 5.記憶免疫
免疫反応で、特定の抗原に対する抗体の構造が保持されており、2回目の抗原の進入に対して強い免疫応答を起こすことができる。 - 6.ナチュラルキラー細胞(NK細胞)、ナチュラルキラーT細胞(NKT細胞)
NK細胞は、ウイルスによる感染やがん細胞に対する初期防御機構としての働きを担っているリンパ球の1種。NKT細胞は、アレルギー疾患、がん転移、自己免疫疾患を制御する機能を持つ中核的な免疫制御細胞。 - 7.α-GalCer(アルファガラクトシルセラミド)
NKT細胞だけを活性化する糖脂質リガンドの1つであり、CD1d分子上に提示される。沖縄に生息する海綿の一種( Agelas mauritianus)から得られた。 - 8.CD1d
糖脂質抗原の情報を伝えるのに必要な分子。β2-ミクログロブリンと非共有結合した膜タンパク質で抗原提示細胞上に発現しており、糖脂質を提示しNKT細胞を活性化する。HLA(ヒト白血球抗原)のような多型性はなく、ヒト、マウス間でも相動性が高いため、同一糖脂質抗原をヒト、マウス無関係にNKT細胞を活性化できる。 - 9.ICAM-1、VCAM-1
細胞と細胞の結合を媒介する接着分子の1種で、血管内皮細胞に発現するICAM-1, VCAM-1はリンパ球の細胞表面のインテグリン(細胞が何かに接着するために使うタンパク質)のリガンドであり、リンパ球が血管内から血管外へ遊走するのに関わる。 - 10.WT1
WT1遺伝子は、小児の腎悪性腫瘍の1つであるWilms’腫瘍の発生と関連している遺伝子であり、それによりコードされているタンパク質はさまざまな増殖関連遺伝子の転写を調節している。急性骨髄性白血病をはじめ、多くの腫瘍に発現が認められる。
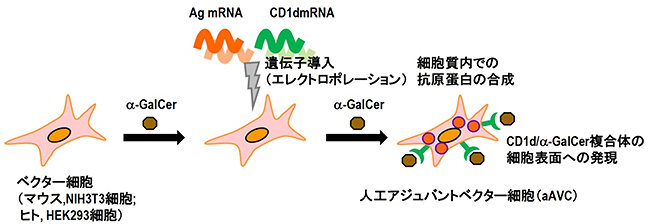
図1 マウスとヒトにおける人工アジュバントベクター細胞(aAVC)の作製方法
NKT細胞のリガンドであるα-GalCerを添加した他家細胞(マウス用NIH3T3細胞、ヒト用HEK293細胞)のベクター細胞に、標的とするがん細胞の抗原タンパク質のmRNAとCD1d分子のmRNAを遺伝子導入する。すると、細胞質内でがん抗原タンパク質(ピンク色の丸)が合成され、細胞表面にはCD1d/α-GalCer複合体が発現し、aAVCが完成する。
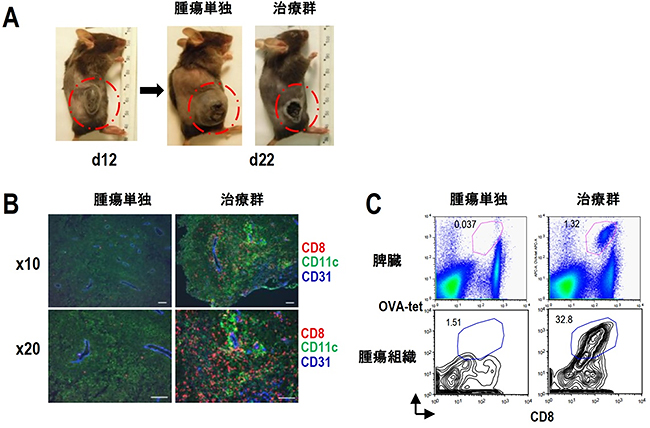
図2 マウスのaAVCによる抗腫瘍効果とそのメカニズム
A:マウスに、卵白アルブミン(OVA)抗原を発現した悪性黒色腫細胞(MO4)を接種し、腫瘍が十分大きくなった状態(12日目)で、OVA抗原を発現したaAVCを静脈内投与で治療すると、腫瘍が壊死を起こし縮小した(22日目)。
B:腫瘍組織を免疫染色で調べた結果。腫瘍血管CD31(青)の周囲にCD11c陽性樹状細胞(緑)、CD8 T細胞(赤)が集積し、クラスターを形成していることが分かった。スケールバーは、上段、下段とも100マイクロメートル(μm、1μmは100万分の1メートル)。
C:リンパ組織の1つである脾臓(上段)と腫瘍組織(下段)におけるOVA抗原特異的CD8T細胞(OVA-tet陽性)の分布。治療群では、OVA抗原特異的CD8T細胞が脾臓や腫瘍内により多く集まっていることが分かった。
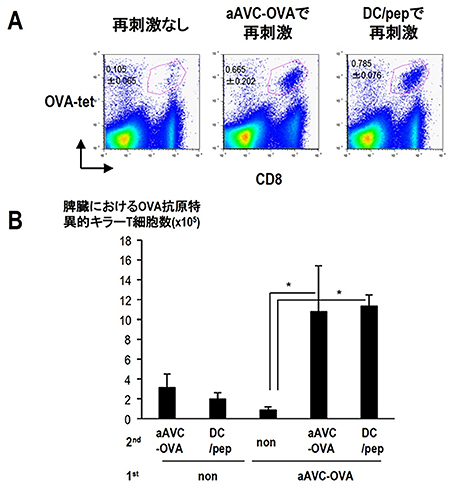
図3 メモリーキラーT細胞の誘導と増幅効果
マウスにOVA抗原を発現した人工アジュバントベクター細胞(aAVC-OVA)を投与し、6カ月後の脾臓における抗OVA特異的CD8T細胞を調べると、メモリーキラーT細胞が維持されていた。
6ヵ月後にaAVC-OVAを投与し再刺激すると、1回目の反応に比べ明らかな増幅効果が誘導された。またOVAペプチドを添加した樹状細胞(DC/pep)で再免疫した場合でも同様に増幅効果を得ることができた。
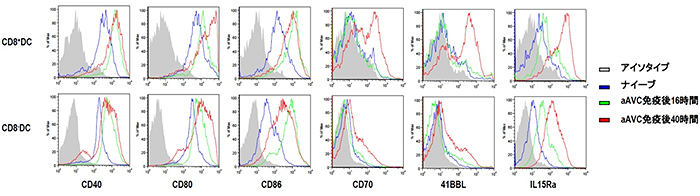
図4 成熟樹状細胞上に発現するメモリーT細胞関連分子
aAVCで免疫反応を起こさせた後、経時的に脾臓中の樹状細胞(DC)を調べると、成熟化マーカー(CD40、CD80、CD86)以外に、メモリーT細胞(CD8)を誘導するのに重要な分子(CD70、41BBL、IL15Ra)が強発現していることが分かった。(樹状細胞には、サブセットがCD8+DCとCD8-DCの2種類存在する)
