要旨
理化学研究所(理研)光量子工学研究領域生細胞超解像イメージング研究チームの岩井優和客員研究員、中野明彦チームリーダーらの共同研究チーム※は、生細胞超解像・高速イメージングによって、生きた植物細胞内に存在する葉緑体内での「光エネルギー伝達」の変動の様子を可視化することに成功しました。
光合成反応は、自然環境の維持と物質生産の根幹を担う重要な役割を果たしています。光合成の基盤となる光化学系[1](タンパク質)は、葉緑体のチラコイド膜[2]に存在し、集光アンテナタンパク質[3]から運ばれる光エネルギーを消費し、電子伝達系を駆動しています。光エネルギー伝達機構の制御には、集光アンテナタンパク質が大きく関与しており、その制御機構の全容は複雑で、さまざまな分子が連動することで、光合成反応全般の効率を維持していると考えられています。
しかし、植物細胞内に存在する10マイクロメートル(μm、1μmは1,000分の1ミリメートル)以下の大きさの葉緑体内でのタンパク質の働きを観察すること、高速に伝達する光エネルギーを直接捕えることは極めて難しく、これまで光エネルギー伝達を生きた細胞で観察することはできませんでした。
共同研究チームは今回、多色・超解像・高速の「共焦点顕微鏡システム(SCLIM)[4]」を用いて、三次元(縦・横・高さ)方向に高速スキャンし超解像レベルで植物の生細胞を観察しました。その結果、光エネルギー伝達の変動を示すクロロフィル蛍光[5]のダイナミクスを可視化することに成功しました。
本成果は、光合成反応の初期に起こる光エネルギー伝達機構の速い変化を追跡することを可能とし、今後の超解像・高速のライブセルイメージング[6]解析の基盤となるものです。
本研究は、JST戦略的創造研究推進事業 個別型研究(さきがけ)研究領域「二酸化炭素資源化を目指した植物の物質生産力強化と生産物活用のための基盤技術の創出」研究課題名「ライブセルイメージングによる光環境適応機構の実態解明」(代表:岩井 優和)の支援を受けて行われました。
成果は、英国の科学雑誌『Scientific Reports』のオンライン版(7月15日付け)に掲載されます。
※共同研究チーム
理化学研究所 光量子工学研究領域 生細胞超解像イメージング研究チーム
客員研究員 岩井 優和(いわい まさかず)
チームリーダー 中野 明彦(なかの あきひこ)
専任研究員 黒川 量雄(くろかわ かずお)
嘱託職員 市原 昭(いちはら あきら)
北海道大学 低温科学研究所
研究員 横野 牧生(よこの まきお)
背景
植物細胞内には10マイクロメートル(μm、1μmは1,000分の1ミリメートル)以下の球体をした葉緑体が多く存在し、太陽からの光エネルギーを利用して光合成反応を行っています。光合成反応は、クロロフィル(光エネルギーを吸収する色素)と結合している集光アンテナタンパク質が、吸収した光エネルギーを光化学系(タンパク質)へと運ぶことで始まります。光化学系は、集光アンテナタンパク質から運ばれた光エネルギーを消費して電子伝達系を駆動させ、エネルギー生産を行います。光エネルギーが集光アンテナタンパク質から光化学系まで運ばれる伝達機構は複雑で、さまざまな分子が連動し、光合成反応の効率を制御していると考えられています(図1)。
これまで、電子顕微鏡を用いた葉緑体内の観察は多く行われていますが、電子顕微鏡では細胞を化学固定する必要があるため、光エネルギー伝達の動態追跡は不可能です。また、光レーザーを用いた汎用共焦点顕微鏡での生細胞観察は、空間分解能が足りないため、あまりに小さい葉緑体内部の観察は困難でした。
そこで、共同研究チームは2014年に葉緑体の内部を観察するため、コケ植物のヒメツリガネゴケ[7]の原糸体細胞[8]に抗生物質を投与し葉緑体を巨大化させました。巨大化した葉緑体をコンピュータ画像解析し、葉緑体内部に存在するチラコイド膜構造の可視化に成功しました注1)。しかし、巨大化することで生じる影響を無視することはできず、また1コマの動画撮影に約7秒間の間隔があったため、動態追跡の鮮明さに欠けていました。
注1)2014年1月20日プレスリリース「葉緑体内部のダイナミックな構造変化を生きたまま観察」
研究手法と成果
共同研究チームは今回、一度に複数の色を三次元的に高速で観察でき、さらに理論の限界を超えた空間分解能で観察ができる「共焦点顕微鏡システム(SCLIM)」を開発しました。SCLIMを用いることで、ヒメツリガネゴケの葉緑体を巨大化させることなく、内部の観察を生きたまま行うことに成功しました(図2)。
葉緑体内のクロロフィルが吸収した光エネルギーは光合成に利用されますが、利用しきれなかったエネルギーは、ある一定の割合で再び蛍光としてクロロフィルから放出されます。
この様子を観察するため、まず同時に複数色を観察できるSCLIMの特色を生かし、クロロフィルから発せられる蛍光を二つの波長に分けて観察しました。その結果、長波長と短波長の二つの特徴を示す画像を得ることができました。さらに葉緑体の精製と分光解析によって、クロロフィル蛍光の長波長側は光化学系の影響を多く含む蛍光(F-PSII)、短波長側は集光アンテナタンパク質の影響を多く含む蛍光(F-APM)であることが分かりました。
次に、コンピュータ画像解析によって葉緑体の三次元構造を構築したところ、F-PSIIとF-APMは異なる構造を持つことが分かりました。F-PSIIは縦に連なる構造が多く観察され、これは電子顕微鏡で観察されたグラナ[2]と酷似していました。一方、F-APMは、ところどころで横方向に延びる構造が多く観察されました。F-PSIIとF-APMを重ね合わせてみたところ、グラナをつなぐストロマラメラ[2]に似ていることが分かりました。このことから、波長の異なるクロロフィル蛍光を同時に観察することで、異なるエネルギー状態を示すチラコイド膜構造が存在し、その形状も異なっていることが明らかになりました。
続いて、SCLIMの三次元空間を高速にスキャンする特色を生かし、二色同時タイムラプスイメージング[9]を行いました。2014年の研究では、約7秒間かけて5枚の平面画像を縦軸方向約200ナノメートル(nm、1nmは10億分の1メートル)間隔で取得し、28秒間で5枚の三次元画像を構築しました。今回のSCLIMによる観察では、約1.5秒で10枚の平面画像を縦軸方向約50nm間隔で取得し、約30秒間で20枚の三次元画像を構築することに成功しました。すなわち、より速く、より微細に、より多くの空間情報を取得することで、正確な構造変化を追跡することが可能となりました。
その結果、F-PSIIは比較的動きの変動が少ないこと、F-APMは1.5秒では追跡できないほど速い動きを示すことが分かりました(図3)。前述の通りF-APMは、集光アンテナタンパク質の影響を多く示す蛍光特性であることから、この1.5秒で追跡できない速い変動は、光化学系へと伝達する光エネルギー量の変動を間接的に示していると考えられます。
顕微鏡で観察された現象と実際のタンパク質の働きを関連させるには、緑色蛍光タンパク質(GFP)[10]などを遺伝子操作で目的のタンパク質に付与して解析する必要があります。しかし、生きた植物細胞内の葉緑体のチラコイド膜に存在する光合成タンパク質にGFPを付与した成功例はまだなく、F-APMが示す速い動きが何なのか直接証明することは困難です。
しかし、これまでの知見から、この速い動きの変動は、①光化学系の後に起きる光合成電子伝達系の流れの変化、②局所的に起こる光化学系と集光アンテナタンパク質との相互作用の変化、もしくは、③集光アンテナタンパク質同士の相互作用の変化と仮説付けることができます。
今後の期待
太陽からの光エネルギーを利用し、物質生産を担う光合成反応機構の全容解明は、将来、人工的に光エネルギーを利用する手がかりとなります。本研究で用いたイメージング技術は、葉緑体内部に存在するチラコイド膜とその膜に存在するタンパク質がいかに光エネルギーを効率よく消費しているかを生きた状態で解析する手法です。SCLIMを用いることで、より速い動態変化を追跡することが可能となります。
今後は光エネルギーが、どのような経路でどれくらいの速度で伝達・制御されているかを明らかにする必要があります。今回のSCLIMによる解析は、その第一歩であり、今後もさらにライブセルイメージング技術の発展が必要不可欠です。
原論文情報
- Iwai, M., Yokono, M., Kurokawa, K., Ichihara, A., Nakano, A., "Live-cell visualization of excitation energy dynamics in chloroplast thylakoid structures", Scientific Reports, doi: 10.1038/srep29940
発表者
理化学研究所
光量子工学研究領域 エクストリームフォトニクス研究グループ 生細胞超解像イメージング研究チーム
客員研究員 岩井 優和(いわい まさかず)
チームリーダー 中野 明彦(なかの あきひこ)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.光化学系
光エネルギーを使って化学反応を引き起こす酵素。光合成反応において最も重要なタンパク質。 - 2.チラコイド膜、グラナ、ストロマラメラ
チラコイド膜は葉緑体内部にある脂質二重膜で、光合成が起きる反応の場。グラナはチラコイド膜同士が縦方向に重なった円柱状の層構造。どのようにして膜が重なるのかは、まだ分かっていない。ストロマラメラは、膜が重ならず、単層で存在している部分。複数のグラナを橋渡しするような状態で存在することが多い。グラナとストロマラメラに存在する光化学系は異なる分布を示すと考えられている。 - 3.集光アンテナタンパク質
クロロフィルを含む色素が結合したタンパク質複合体。光を吸収するアンテナとして働き、吸収した光エネルギーを光化学系タンパク質に伝達する。 - 4.共焦点顕微鏡システム(SCLIM)
共同研究チームが独自開発した蛍光顕微鏡システム。ニポウディスク方式共焦点スキャナー、高性能のダイクロイックミラー、フィルターシステムによる分光器、冷却イメージインテンシファイアー(電子増倍管)と複数の高感度CCDカメラシステムから構成される。複数蛍光の同時取得と高S/N比の蛍光画像取得が可能。SCLIMは、Super-resolution Confocal Live Imaging Microscopyの略。 - 5.クロロフィル蛍光
クロロフィルは葉緑体に含まれる色素で、光合成に重要な役割を果たす。この色素が赤および青紫の光を吸収し、緑の光は吸収しないために植物は緑色をしている。クロロフィルが吸収した光エネルギーは光合成に利用されるが、利用しきれなかったエネルギーは、ある一定の割合で再び蛍光としてクロロフィルから放出される。これをクロロフィル蛍光という。 - 6.ライブセルイメージング
生きた細胞のさまざまな活動を継時観察すること。特にGFPなどの蛍光マーカーを用いて特定の細胞や組織を標識し、蛍光顕微鏡でその動きや変化を詳細に観察できる。 - 7.ヒメツリガネゴケ
進化的に陸上植物と緑藻の間に位置するコケ植物の一つ。コケ植物のモデル生物として初めてゲノムが解読され、2008年にゲノム情報が公開された。 - 8.原糸体細胞
コケ植物、シダ植物の胞子が発芽して形成する糸状の植物体。やがて原糸体に芽が生じ、それが大きく発達して配偶体ができ上がる。 - 9.タイムラプスイメージング
顕微鏡下の生きた細胞や組織を経時的に観察する手法。コンピュータから顕微鏡とCCDカメラを制御し、時間を追って画像を取得・保存する。それらの画像をつなぎ合わせて動画を作成すると、生きた細胞や組織の動態を“観る”ことができる。 - 10.緑色蛍光タンパク質(GFP)
オワンクラゲから最初に精製された光るタンパク質。遺伝子改変することで、目的のタンパク質にGFPを繋げ、生きた細胞内でのタンパク質の働きや動態変化を見ることが可能になった。同様の仕組みを持つ蛍光タンパク質が、オワンクラゲ以外の動物(主に刺胞動物)から数多く発見されている。現在では、緑色以外にもさまざまな色を発する蛍光タンパク質が開発されている。
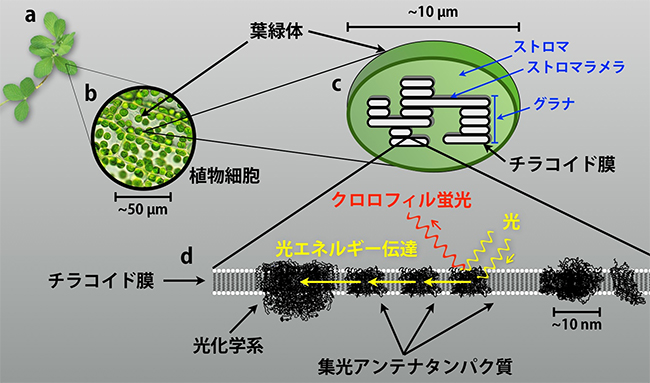
図1 植物の葉に存在する葉緑体と光エネルギー伝達のイメージ図
a:一般的な植物と葉。
b:葉に含まれる植物細胞の顕微鏡画像。緑色の粒が葉緑体。
c:葉緑体の模式図。内部にはチラコイドと呼ばれる袋状の構造が存在し、チラコイド以外の部分はストロマと呼ばれる。チラコイドはチラコイド膜と呼ばれる脂質二重膜で覆われている。単層で存在するチラコイド膜領域をストロマラメラと呼ぶ。膜が縦方向に重なった領域をグラナと呼ぶ。
d:チラコイド膜の1枚を拡大した模式図。膜の中にクロロフィルを含むタンパク質が多く存在している。その一つが集光アンテナタンパク質で、光を吸収し、特殊なクロロフィルを含む光化学系へと光エネルギーを伝達する。光エネルギー伝達として利用しきれなかったエネルギーは、再び蛍光としてクロロフィルから放出される。
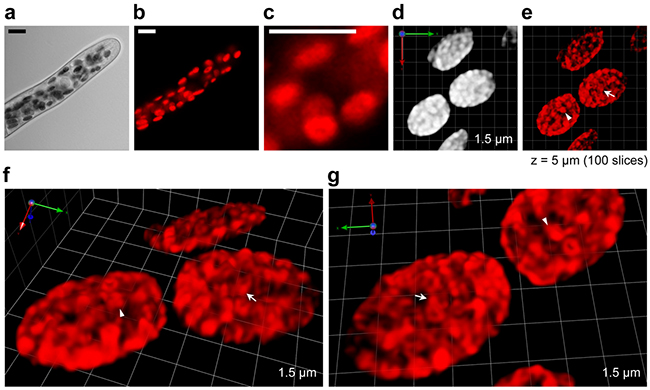
図2 SCLIMによるヒメツリガネゴケの葉緑体内部の観察
a:ヒメツリガネゴケの原糸体の明視野顕微鏡画像。
b:aのクロロフィルの蛍光顕微鏡画像。赤色の扁平な球体一つ一つが葉緑体である。
c:bの一部分を拡大し、葉緑体を示した画像。a~cは、汎用の共焦点顕微鏡で観察した葉緑体。
d~g:SCLIMで三次元的に観察した葉緑体(100枚の平面画像の重ね合わせで縦軸(z)の長さは5µm)。
d:SCLIMで観察した葉緑体で、cと同じ縮尺である。
e:コンピュータ画像解析でdの画像に含まれる非焦点ボケを除き、解像度を向上させた画像。
fとg:eの葉緑体内部を拡大し、異なる角度から示した画像。
スケールバーは、a~cが10μm、d~gは一つのマスが1.5μm x 1.5μm。e~gの画像内にある矢印と矢じりは同じチラコイド膜構造を示している。

図3 SCLIMを用いた葉緑体の二色同時・三次元高速タイムラプスイメージング
各画像は三次元構築した葉緑体内に存在する一つのグラナ構造を示す。
上段:中段の青色の擬似カラーで示した蛍光(F-APM)と下段の光化学系を示す赤色で示した蛍光(F-PSII)の二色重ね合わせ。それぞれ20コマ、約1.5秒間隔の変化を表しており、右下の数字は経過時間を示す。矢印はF-PSII、矢じりはF-APMのそれぞれの位置を示す。スケールバーは0.5μm。
中段:F-APMの時間経過。F-APMの構造は1コマごとに大きく変化している。
下段:F-PSIIの時間経過。F-PSIIの構造変化は比較的少ない。
