要旨
理化学研究所(理研)脳科学総合研究センター分子精神科学研究チームの豊島学研究員、吉川武男チームリーダーらの国際共同研究グループは、iPS細胞を用いて、統合失調症患者の神経幹細胞と神経前駆細胞の細胞塊(神経幹/前駆細胞)では、神経細胞やグリア細胞[1]への分化に異常がみられ、この異常には特定のマイクロRNA(miRNA)[2]が関わっていること発見しました。
統合失調症は生涯罹患率が人口の約1%と高く、国内の総患者数は71万3,000人と推定されています。病気の予防と治療には、病気の原因(病因)の解明が必要です。しかし、統合失調症はこれだけ患者数の多い病気であるにも関わらず、その病因は十分には解明されていません。統合失調症の発症しやすさの要因の一つとして、胎生期から生後早期にかけての脳の微細な発達障害が考えられています(神経発達障害仮説[3])。しかし、これまでは神経発達初期の異常やその後の分化過程の異常を、ヒトの脳を直接使って調べることは不可能であったため、神経発達障害の具体像は分かっていませんでした。
今回、国際共同研究グループは、分化誘導によってiPS細胞から神経幹/前駆細胞や神経細胞、グリア細胞を作製できることに着目しました。統合失調症患者の中でも、発症率を大きく上昇させる、22番染色体の長腕11.2領域の微細欠失を持つ22q11.2欠失症候群[4]の患者からiPS細胞を作製し、神経幹/前駆細胞から神経細胞、グリア細胞への分化について解析しました。その結果、統合失調症患者由来の神経幹/前駆細胞では、健常者の場合と比べて神経細胞への分化効率が低く、アストロサイト[1](グリア細胞の一種)への分化効率が高いことが分かりました。また、分化した神経細胞では神経突起が短い、移動能が低いといった異常がみられました。これらの原因には特定のmiRNAの発現低下が関わっていることが分かりました。さらに、統合失調症の死後脳を用いた解析でも、健常者の死後脳と比べて神経細胞とアストロサイトの量比に異常がみられることが分かりました。
本研究により、神経幹/前駆細胞から神経細胞やグリア細胞への分化効率が、統合失調症の病因に関わっている可能性が示されました。今後、miRNAが標的とする遺伝子を詳細に解析することで、新たな創薬ターゲットの発見に役立つと期待できます。
本研究は、英国の科学雑誌『Translational Psychiatry』に掲載されるのに先立ち、オンライン版(11月1日付け:日本時間11月2日)に掲載されます。
背景
統合失調症は幻覚や妄想、意欲の低下、感情の平板化などを主要な症状とする精神疾患です。生涯罹患率が人口の約1%と高く、国内の総患者数は71万3,000人と推定されています注1)。症状が重篤で、発症後には社会的機能も低下するといわれており、病態の理解と予防法の開発が急務となっています。病気の予防や治療には、病気の原因(病因)の解明が必要ですが、統合失調症はこれだけ患者数の多い病気であるにも関わらず、その病因は十分には解明されていません。統合失調症の発症しやすさの要因の一つとして、胎生期から生後早期にかけての脳の微細な発達障害が考えられています(神経発達障害仮説)。しかし、これまでは神経発達初期の異常やその後の分化過程の異常を、ヒトの脳を直接使って調べることは不可能であったため、神経発達障害の具体像は分かっていませんでした。
今回、国際共同研究グループは、分化誘導によってiPS細胞から神経幹細胞と神経前駆細胞の細胞塊(神経幹/前駆細胞)、神経細胞、グリア細胞が作製できることに着目しました。統合失調症患者由来のiPS細胞を用いれば、実際の患者に起きた神経発達初期の異常やその後の分化過程の異常を観察でき、神経発達障害の具体的な発症メカニズムを調べることができると考えました。また、統合失調症患者の中でも、発症率を大きく上昇させる、22番染色体の長腕11.2領域の微細欠失を持つ22q11.2欠失症候群の患者のiPS細胞を用いることで異質性を絞り、より明瞭に異常を観察できると考えました。
研究手法と成果
1)患者由来の神経幹/前駆細胞、神経細胞、グリア細胞では分化に異常
国際共同研究グループは神経幹/前駆細胞、神経細胞、グリア細胞における分化異常を調べるため、22q11.2欠失症候群の統合失調症患者2人から4つのiPS細胞と、健常者3人から4つのiPS細胞を作製しました。これらのiPS細胞から分化誘導によってニューロスフィア[5](神経幹/前駆細胞の塊)、神経細胞、グリア細胞を作製し、細胞の形態や分化効率を調べました。
その結果、患者由来のニューロスフィアのサイズは、健常者と比べて約30%小さいことが分かりました(図1)。
また、このニューロスフィアを神経系の細胞(神経細胞とグリア細胞)に分化誘導したところ、患者由来のニューロスフィアは、健常者由来と比べて神経細胞に分化する割合が約10%低く、アストロサイト(グリア細胞の一種)に分化する割合が約10%高いことが分かりました(図2)。
また、患者由来の神経細胞では神経突起が短い、細胞の移動能が低いといった異常がみられました。以上のように、患者由来の神経幹/前駆細胞、神経細胞、アストロサイトでは、さまざまな異常が起きていることが分かりました。
2)患者由来の神経幹/前駆細胞では、特定のマイクロRNAの発現が低下
患者由来のニューロスフィアでは、サイズの減少といった分化異常がみられましたが、同じ異常は、22q11.2欠失領域に存在するDGCR8遺伝子[6]を欠失させたDgcr8ヘテロ欠損マウス[6]でも報告されています。DGCR8はマイクロRNA(miRNA)の生合成に関与する遺伝子です。このことから国際共同研究グループは、患者由来のニューロスフィアでみられた分化異常にはmiRNAの発現変化が関わっていると考え、患者由来のニューロスフィア におけるmiRMAの発現変化をmiRNAアレイ法[7]とTaqMan法[8]を用いて調べました。
その結果、患者由来のニューロスフィアでは、miR-17/92クラスター[9]のmiRNAや miR-106a/b、miRNA-185の発現の割合が、健常者由来のニューロスフィアに比べて20~60%低下していました。miR-17/92クラスターのmiRNAは、神経幹細胞の増殖や分化制御に関わる遺伝子(BIM、PTEN)を標的とすることから、患者由来の神経幹細胞にみられたニューロスフィアのサイズの減少は、これらのmiRNAの発現低下が関わっている可能性が示されました。
3)患者由来の神経幹/前駆細胞の分化効率の異常にはp38αタンパク質が関与
神経幹/前駆細胞から神経細胞、グリア細胞への分化には、miR-17、miR-106a/bが重要な働きをしています。miR-17、miR-106a/bは、p38αタンパク質(p38MARK)[10]をコードするMAPK14遺伝子の発現を抑制し、神経幹/前駆細胞が神経細胞やグリア細胞に分化するタイミングを制御しています。
患者由来のニューロスフィアでmiR-17、miR-106a/bが低下していたことから、これらのmiRNAの発現低下がp38αの発現上昇を引き起こし、患者由来のニューロスフィアでみられた分化効率の異常につながると考えました。患者由来のニューロスフィアにおけるp38αの発現量を調べた結果、健常者由来のニューロスフィアに比べて約30%上昇していました。
また、培養時にp38の阻害剤を加えた患者由来のニューロスフィアでは、神経細胞になる割合が上昇し、逆にアストロサイトになる割合が低下するなど、異常が改善することが分かりました(図3)。p38の阻害剤によって、患者由来のニューロスフィアの分化効率を改善できたことから、p38αが統合失調症の新たな創薬ターゲットとなる可能性が示されました。
4)患者死後脳では神経細胞マーカーやアストロサイトマーカーの発現が変化
国際共同研究グループは、22q11.2欠失症候群の統合失調症患者由来の神経幹/前駆細胞でみられた分化効率の異常が、統合失調症に共通してみられる異常なのか、統合失調症患者の死後脳を用いて調べました。その結果、差は小さいものの、健常者の死後脳(健常群)と比べて患者の死後脳(統合失調症群)では神経細胞のマーカーであるMAP2遺伝子の発現量の低下と、アストロサイトのマーカーであるGFAP遺伝子の発現量の上昇がみられました(図4)。GFAPの発現量の上昇は、脳内の炎症によっても起こりますが、患者の死後脳において炎症マーカー(IL1B遺伝子、IL6遺伝子)の発現上昇はみられませんでした。患者の死後脳においても神経細胞とアストロサイトの量比に異常がみられたことから、脳発達期における神経幹/前駆細胞の分化効率の微少な変化が、統合失調症の病因の可能性の一つであると考えられます。
5)まとめ
本研究から統合失調症患者の脳では、神経幹/前駆細胞から神経細胞とグリア細胞(アストロサイト)への分化が僅かながら偏っていることが示されました。その原因として、iPS細胞を用いたアプローチからは、miRNA発現異常からp38αタンパク質の発現上昇に至る経路が考えられました(図5)。p38αの発現上昇は、脳の発達期にさまざまなストレスを受けることでも生じるため、死後脳で得られた所見は、産科合併症、周産期障害[11]などによる胎児脳発達期の炎症や酸化ストレス[12]にも由来していると考えられます。以上から、今まで提唱されていた統合失調症の神経発達障害仮説の重要な鍵分子として、p38αが見出されました。
今後の期待
現在使用されている向精神薬[13]は主に神経伝達物質の受容体をターゲットとするもので、神経分化や神経発達に関連するmiRNAや分子は、患者の神経発達障害の分子メカニズムが不明だったため、創薬のターゲットにはなっていませんでした。今回、特定のmiRNAや、そのmiRNAが制御するp38αタンパク質が神経発達障害に関わっている可能性が示されたことにより、神経分化や神経発達という新たな視点からの創薬の可能性が期待できます。
※国際共同研究グループ
理化学研究所 脳科学総合研究センター
分子精神科学研究チーム
チームリーダー 吉川 武男 (よしかわ たけお)
研究員 豊島 学 (とよしま まなぶ)
タンパク質構造疾患研究チーム
チームリーダー 田中 元雅 (たなか もとまさ)
慶應義塾大学 医学部
教授 岡野 栄之 (おかの ひでゆき)
順天堂大学大学院 医学研究科
特任教授 赤松 和土 (あかまつ わど)
愛知医科大学 医学部
准教授 岡田 洋平(おかだ ようへい)
新潟大学 医学部
准教授 矢野 真人(やの まさと)
メルボルン大学 フローリー神経科学精神医学研究所
教授 ブライアン・ディーン(Brian Dean)
原論文情報
- Toyoshima M, Akamatsu W, Okada Y, Ohnishi T, Balan S, Hisano Y, Iwayama Y, Toyota T, Matsumoto T, Itasaka N, Sugiyama S, Tanaka M, Yano M, Dean B, Okano H, Yoshikawa T, "Analysis of induced pluripotent stem cells carrying 22q11.2 deletion", Translational Psychiatry, doi: 10.1038/tp.2016.206
発表者
理化学研究所
脳科学総合研究センター 分子精神科学研究チーム
チームリーダー 吉川 武男(よしかわ たけお)
研究員 豊島 学(とよしま まなぶ)

報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.グリア細胞、アストロサイト
グリア細胞は、神経系そのものを作る細胞の中で神経細胞ではない細胞の総称。脳や脊髄などの中枢神経系では、アストロサイト、オリゴデンドロサイト、ミクログリアがある。主に、神経細胞に栄養を与えること、また神経細胞を取り巻く環境の整備をすることで、神経細胞の活躍を助けている。一方、さまざまな脳の病気ではグリア細胞の活動が上昇することが知られている。 - 2.マイクロRNA(miRNA)
タンパク質をコードしていない21~25塩基程度の1本鎖RNAで、標的となるタンパク質をコードしているmRNAの3’末端側の非翻訳領域に結合して翻訳を阻害する。同様の翻訳抑制を行うsiRNA(干渉RNA)とは異なり、標的の結合部位の配列と完全に一致する必要はないため、1個のmiRNAは平均200個のmRNAを標的としている。 - 3.神経発達障害仮説
「脳発達期の微細な障害が統合失調症を引き起こす基盤となる」という有力な病因仮説の一つ。疫学調査やマウスを用いた実験により支持され、広く知られているが、実際のヒトの脳でどのようなことが起こっているのか、その分子メカニズムはよく分かっていない。 - 4.22q11.2欠失症候群
22番染色体の長腕(q)の11.2の部分(22q11.2領域)の微細欠失により生じる疾患群。22q11.2欠失は、2,000~4,000人に1人の割合で起こる染色体異常症の一つ。心血管形成の異常、胸腺の低形成、低カルシウム血症などの症状がみられる。また、約30%の患者は、統合失調症やその他の精神疾患を発症する。この領域の欠失によって、統合失調症などの精神疾患の発症率が大きく上昇するため、欠失領域の遺伝子( PRODH、COMT、DGCR8、ZDHHC8、RTN4Rなど)が精神疾患の発症に関わっているとして注目されている。しかし、各遺伝子が精神疾患発症にどのように関わっているか、ヒトでの具体的なメカニズムは不明な点が多い。 - 5.ニューロスフィア
神経幹/前駆細胞を増殖因子であるEGFとbFGFを含む無血清培地中で浮遊培養することで、作製できる細胞塊。この細胞塊を用いることで、神経幹/前駆細胞を選択的に増殖できる。 - 6.DGCR8遺伝子、 Dgcr8ヘテロ欠損マウス
Dorosha(核内でmiRNA前駆体を切断する酵素)と複合体を形成し、miRNAの生合成のプロセスの中で、核内で行われる1段階目の切断に関わる。 DGCR8遺伝子の一方を欠損させた Dgcr8ヘテロ欠損マウスでは、miRNAの生成異常のほかに、プレパルス抑制(強い知覚刺激を動物に突然与えると驚愕反応が引き起こされるが、その刺激の直前に微弱な刺激を先行させると驚愕反応が大幅に抑制される現象のこと)や空間的ワーキングメモリーの低下といった行動異常や、海馬における神経新生の低下、海馬CA1錐体細胞や前頭葉皮質第Ⅴ層錐体細胞の樹状突起スパインの減少、皮質第Ⅱ層の神経細胞密度の低下といった形態異常など、統合失調症に関連する異常が起こることが報告されている。 - 7.miRNAアレイ法
miRNAと特異的に結合するマイクロアレイプローブを高密度に配置して固定した基板を使って、細胞内で発現しているmiRNAを網羅的に解析する方法。極めて短時間で、一度に大量のmiRNAの発現を解析できる。 - 8.TaqMan法
リアルタイムPCR(ポリメラーゼ連鎖反応)法における、PCR増幅産物の定量的検出方法の一つ。TaqManプローブと呼ばれる蛍光標識プローブを用いる。リアルタイムPCR法は、PCR増幅産物の増加をリアルタイムでモニタリングし、解析する方法。TaqMan法はスタンダードな遺伝子発現解析法の一つとなっている。 - 9.miR-17/92クラスター
ゲノム上に近接して存在し、一つのホストRNA(miRNA一次転写産物)から産生されるmiRNA群をmiRNAクラスターと呼ぶ。miR-17/92クラスターは6個のmiRNA(miR-17、miR-18a、miR-19a、miR-20a、miR-19b-1、miR-92a-1)が、13番染色体の長腕の31.3の部分(13q31.3領域)に近接して存在し、これらのmiRNAの前駆体を含む一つのホストRNAから産生される。
- 10.p38(p38MAPK)
サイトカインによる刺激や紫外線照射、熱・浸透圧ストレスなどによって活性化されるプロテインキナーゼ(タンパク質リン酸化酵素)。細胞の分化、アポトーシス(プログラム細胞死)、オートファジー(自食)に関与している。p38MAPKの遺伝子にはα、β、γ、<a;の4種類が知られている。 - 11.産科合併症、周産期障害
産科合併症とは、妊娠したことで生じる異常のこと。主なものに、つわり、切迫流産、前期破水、妊娠高血圧症候群、妊娠糖尿病、羊水過多・減少、前置胎盤、胎盤早期剥離などがある。周産期とは出産前後の期間(妊娠22週から出生後7日未満)を指し、周産期障害には、新生児仮死、重症黄疸後遺症、未熟児に合併する病気等がある。また、母体の栄養不良、過多、偏り、そして母体のさまざまな感染症も胎児の脳の発達に影響すると考えられる。 - 12.酸化ストレス
生体内で酸化還元状態の均衡が崩れたとき、過酸化水素やヒドロキシラジカルを代表とする活性酸素が産生される。これらがタンパク質や脂質、あるいは核酸と反応し、生体にダメージを与える。 - 13.向精神薬
中枢神経に作用して脳に影響を及ぼす薬物の総称。抗うつ薬、抗不安薬、睡眠薬、抗精神病薬、気分安定薬などが含まれる。統合失調症の治療薬は抗精神病薬といわれる。
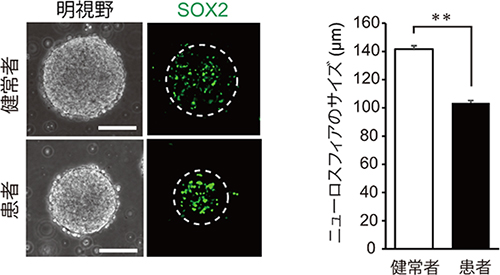
図1 22q11.2欠失症候群の統合失調症患者のニューロスフィアのサイズの変化
健常者および22q11.2欠失症候群の統合失調症患者由来のiPS細胞からニューロスフィアを作製し、そのサイズを比較した。
左:明視野観察法で観察したニューロスフィアの写真と、神経幹/前駆細胞に特徴的なSOX2タンパク質の蛍光染色写真。患者由来のニューロスフィアが有意に小さく、それに伴いSOX2タンパク質の分布範囲も小さいことが分かる。スケールバーは50マイクロメートル(1μmは1,000分の1mm)。
右:健常者由来と患者由来のニューロスフィアの直径。健常者由来のニューロスフィアの直径が約140μmであるのに対し、患者由来は約100μmで、健常者由来よりも約30%小さかった。
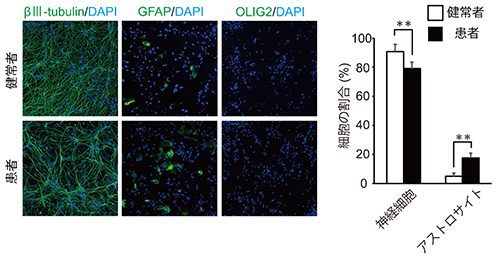
図2 ニューロスフィアから神経系の細胞への分化誘導
健常者と22q11.2欠失症候群の統合失調症患者由来のiPS細胞から作製したニューロスフィアを神経系の細胞に分化誘導した。
左:神経細胞のマーカー(βⅢ-tubulin)、グリア細胞の一種であるアストロサイトのマーカー(GFAP)、グリア細胞の別の種のオリゴデンドロサイトのマーカー(OLIG2)で分化した細胞の種類を調べた。写真の緑色に染まっている細胞が各細胞マーカーを発現している細胞。DAPI(青色の部分)は細胞核のある位置を示している。患者由来の細胞群ではβⅢ-tubulin陽性の神経細胞は健常者群に比べて少なく、逆にGFAP陽性のアストロサイトは多かった。OLIG2陽性のオリゴデンドロサイトは両群で非常に少なく、差は確認できなかった。
右:患者由来のニューロスフィアは、健常者由来と比べて神経細胞に分化する割合が約10%低く、アストロサイトに分化する割合が約10%高かった。
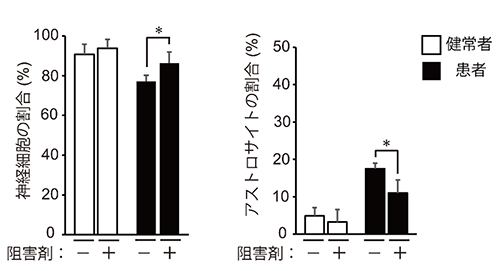
図3 ニューロスフィアの神経分化効率へのp38の阻害剤の効果
健常者と患者由来のニューロスフィアの培養時にp38の阻害剤を加え、分化誘導を行った。患者由来のニューロスフィアでのみ、神経細胞へ分化する細胞の割合が上昇し、アストロサイトへ分化する細胞の割合が低下した。
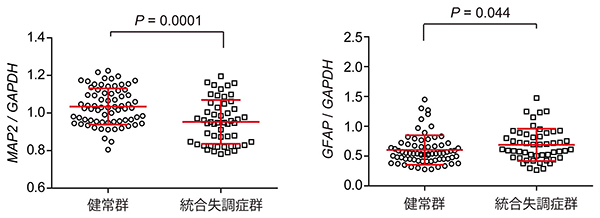
図4 死後脳における遺伝子発現解析
統合失調症患者の死後脳では、健常者の死後脳と比べて神経細胞のマーカーであるMAP2遺伝子の発現量が低下し(左)、逆にアストロサイトのマーカーであるGFAP遺伝子の発現量が上昇していた(右)。図中の横線の中央線は平均値を示し、上下の線は標準偏差(値のばらつきの程度)を示す。
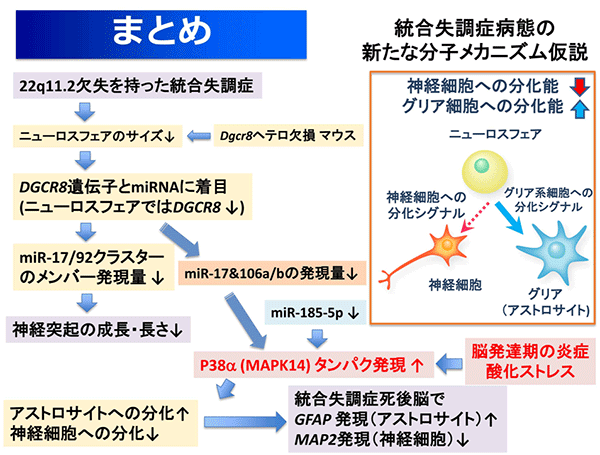
図5 今回の研究で明らかになった統合失調症発症の分子メカニズム
22q11.2欠失を持った統合失調症患者の脳では、健常人に比べて神経幹/前駆細胞が神経細胞へ分化する割合が低く、グリア細胞(アストロサイト)へ分化する割合が高かった。その原因として、iPS細胞を用いたアプローチからは、miRNAの発現異常によるp38αタンパク質(MARK14)の発現上昇に至る経路が考えられた。p38αの発現上昇は、脳の発達期にさまざまなストレスを受けることでも生じる。そのため、患者の死後脳で神経細胞とアストロサイトのそれぞれの量に異常がみられた所見は、胎児脳発達期の炎症や酸化ストレスにも由来していると考えられる。以上から、今まで提唱されていた統合失調症の「神経発達障害仮説」の重要な鍵分子として、p38αが見出された。
