要旨
理化学研究所(理研)放射光科学総合研究センター生命系放射光利用システム開発ユニットの岡島公司客員研究員(慶應義塾大学理工学研究科特任助教)、山本雅貴ユニットリーダーらの共同研究チームは、大型放射光施設「SPring-8[1]」の放射光を用いたX線小角散乱法[2]によって、植物個体の光屈性や葉緑体の細胞内運動を制御する青色光受容タンパク質「フォトトロピン[3]2」の全長の立体構造を明らかにしました。
1880年、チャールズ・ダーウィンらは、光の方向に植物の茎などが屈曲する「光屈性」という植物における光合成効率を最適にする運動を発見しました。その後の研究で、光屈性の原因タンパク質として、青色光受容によって制御されるタンパク質フォトトロピン1とフォトトロピン2が見いだされています。特に、フォトトロピン2が青色光受容すると、その信号が酸化酵素ドメインに伝達され他のタンパク質をリン酸化してさまざまな細胞運動を誘起します。 一方で、青色光という物理刺激をリン酸化という生体内信号に変換するメカニズムは解明されておらず、この分野での大きな課題となっています。
今回、共同研究チームは、これまで難しかったフォトトロピン2全長の大量発現と生化学的な調製に成功し、その立体構造をSPring-8の放射光を用いて調べました。その結果、青色光受容に伴って分子が大きく変形することやフォトトロピン2を構成する二つの光受容ドメイン[4]LOV1とLOV2の役割が明らかになりました。
本成果は今後、生体における光センシング[5]の解明につながると期待できます。また、フォトトロピンのような光受容分子は、光を利用して細胞を制御する光遺伝学に利用され始めています。光刺激をリン酸化に変換する分子機構が解明できれば、光によって遺伝子発現を制御する光遺伝学[6]への応用も期待できます。
本研究は、米国の科学雑誌『Journal of Biological Chemistry』掲載に先立ち、オンライン版(12月1日付け)に掲載されました。
※共同研究チーム
理化学研究所 放射光科学総合研究センター 利用システム開発研究部門
ビームライン基盤研究部 生命系放射光利用システム開発ユニット
研修生 大出 真央(おおいで まお)(慶應義塾大学 理工学研究科 博士課程1年)
客員研究員 岡島 公司(おかじま こうじ)(慶應義塾大学 理工学研究科 特任助教)
研修生(研究当時) 関口 優希(せきぐち ゆうき)
客員研究員 苙口 友隆(おろぐち ともたか)(慶應義塾大学 理工学部 専任講師)
研究員 引間 孝明(ひきま たかあき)
ユニットリーダー 山本 雅貴(やまもと まさき)
客員主管研究員 中迫 雅由(なかさこ まさよし)(慶應義塾大学 理工学部 教授)
環境資源科学研究センター 植物免疫研究グループ
客員研究員 中神 弘史(なかがみ ひろふみ)
大阪大学 生命機能研究科
特任准教授 加藤 貴之(かとう たかゆき)
背景
1880年、チャールズ・ダーウィンと息子のフランシスは『The power of movements in plants(植物の運動力)』という本を著しました。この中で、彼らは、植物が行うさまざまな屈曲運動を報告しています。なかでも、大きく興味を引かれるのは、光の方向に植物の茎などが屈曲する「光屈性」と呼ばれる現象です。
そして1997年、光屈性を示さないシロイヌナズナの研究から、タンパク質「フォトトロピン」が青色光受容体として光屈性の初発反応を担っていることが明らかになりました。その後の研究によって、フォトトロピンには「フォトトロピン1」と「フォトトロピン2」があり、高等植物において光屈性だけでなく、青色光強度に応じた葉緑体の集合や逃避運動、気孔開口や葉の展開を制御していることが明らかになりました。また、これらの運動制御は、光合成の効率を個体レベルで最適化することも分かりました。
フォトトロピンは青色光で活性が制御されるリン酸化酵素で、約1,000個のアミノ酸と2個の光を受容するための低分子フラビンモノヌクレオチド[7]で構成され、二つの青色光受容ドメインLOV1、LOV2とリン酸化酵素ドメインに折り畳まれていると考えられています。各LOVドメインには、フラビンモノヌクレオチド1分子が結合しています。LOV2が青色光受容すると、その信号がリン酸化酵素ドメインに伝達され、他のタンパク質をリン酸化してさまざまな細胞運動を誘起します。青色光という物理刺激をリン酸化という生体内信号に変換する仕組みを知るためには、それらの配置や青色光照射での変化を知る必要があります。
研究手法と成果
これまで、フォトトロピン2の全長を大腸菌などで大量に発現することは難しく、LOV1とLOV2ドメインの結晶構造および、リン酸化酵素ドメインのバイオインフォマティクス[8]による予測構造が知られているだけでした。
共同研究チームは、フォトトロピン2の全長を大腸菌で大量発現させる系とその生化学的な精製方法を確立しました。そして、SPring-8のBL45XUにおいて、X線小角散乱法により、フォトトロピン2全長の青色光受容に伴う構造変化や、青色光受容したLOV1とLOV2がリン酸化酵素活性に対してどのような役割を担うのかを、それぞれのLOVドメインで青色光受容後に発生する光反応サイクルを欠落させた変異体を用いて調べることにしました。
X線小角散乱法では、高純度に精製したタンパク質溶液にX線を照射し、得られる散乱パターンからタンパク質の低分解能構造を推定することができます。特にBL45XUでは、アンジュレータ[9]から得られる高輝度なX線を集光して試料に照射するため、極微量のタンパク質溶液試料の測定が可能です。
試料の均質性を保つために、リン酸化酵素活性をなくしたフォトトロピン2について測定を行ったところ、溶液中ではフォトトロピン2が二つ組み合わさって、二量体として存在していることが分かりました。また、暗中と青色光照射下での測定を行い、暗中では棒状構造のフォトトロピン2が、青色光照射によって折れ曲がった形に変化することを見いだしました(図1)。
散乱パターンから予測された分子の形に対して、これまでに得られている各ドメインの構造モデルを当てはめたところ、主に青色光受容によってLOV2とリン酸化酵素ドメインの相対位置が変化していることが明らかになりました。この結果は、全長が得られない時期に行った、フォトトロピン2のLOV2とリン酸化酵素ドメインのみからなるフラグメントに対する構造研究と一致するものでした。
さらに、青色光照射によってLOV1やLOV2の光反応が進行しない変異体についても、暗中と青色光照射下でX線小角散乱法による測定を行いました。その結果、従来の説とは異なり、青色光受容で励起されたLOV2のみがリン酸化酵素ドメインを制御するのではなく、青色光受容で励起されたLOV1もリン酸化酵素ドメインの活性化に少なからず寄与していることを直接確かめることができました。
今後の期待
岡島客員研究員らはこれまでに、藻類のフォトトロピン、シロイヌナズナのフォトトロピン1、フォトトロピン2、について研究を行ってきました注1)。これまでの研究と今回の結果を併せると、藻類のフォトトロピンが原型となり、進化的に先に登場したと考えられるフォトトロピン2と後に登場したフォトトロピン1で二量体の構造形成に大きな違いがあり、これが、個体制御における役割分担につながっている可能性も強く示されました。
いずれのフォトトロピンも結晶化が難しいため、今後、分子の全体構造を原子レベルで明らかにするためには、電子顕微鏡単粒子解析[10]と放射光X線小角散乱がその鍵になるものと思われます。
本成果は今後、生体における光センシングの解明につながると期待できます。また、フォトトロピンのような光受容分子は、光を利用して細胞を制御する光遺伝学に利用され始めています。フォトトロピンにおいて光刺激をリン酸化に変換する分子機構が解明できれば、より複雑な細胞制御を可能にする技術開発への展開が期待できます。
注1)2016年9月17日プレスリリース「植物青色光受容タンパク質の形と光受容変化」
原論文情報
- Mao Oide, Koji Okajima, Hirofumi Nakagami, Takayuki Kato, Yuki Sekiguchi, Tomotaka Oroguchi, Takaaki Hikima, Masaki Yamamoto, and Masayoshi Nakasako, "Blue-light excited LOV1 and LOV2 domains cooperatively regulate the kinase activity of full-length phototropin2 from Arabidopsis", The Journal of Biological Chemistry, doi: 10.1074/jbc.RA117.000324
発表者
理化学研究所
放射光科学総合研究センター 利用システム開発研究部門 ビームライン基盤研究部 生命系放射光利用システム開発ユニット
客員研究員 岡島 公司(おかじま こうじ)
(慶應義塾大学 理工学研究科 特任助教)
ユニットリーダー 山本 雅貴(やまもと まさき)
 岡島 公司
岡島 公司
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
慶應義塾 広報室
Tel: 03-5427-1541 / Fax: 03-5441-7640
m-koho [at] adst.keio.ac.jp(※[at]は@に置き換えてください。)
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部お問い合わせフォーム
補足説明
- 1.SPring-8
理化学研究所が所有する兵庫県の播磨科学公園都市にある世界最高性能の放射光を生み出す施設。その運転管理と利用者支援は高輝度光科学研究センターが行っている。SPring-8の名前はSuper Photon ring-8 GeVに由来。放射光とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する強力な電磁波のこと。SPring-8では、この放射光を用いての基礎科学からリチウムイオン電池や製薬などの産業利用までの幅広い研究が行われている。 - 2.X線小角散乱法
X線を物質に照射して散乱するX線のうち、散乱角が小さいものを測定することにより物質の構造情報を得る手法。タンパク質や核酸などの生体高分子、微粒子や液晶、合金の内部構造といった数ナノメートル(nm、1nmは10億分の1m)での構造解析に用いる。例えば、超臨界流体のような系では、その中・長距離構造を粗密な領域からなる不均一構造(密度ゆらぎ)や密度ゆらぎの相関距離といった構造パラメータにより、定量的に評価することが可能となる。 - 3.フォトトロピン
植物の青色光受容タンパク質の一種。茎などが光の方向に曲がる現象の光屈性(フォトトピズム)に関わっており、これが語源となっている。多くの植物にはフォトトロピン1とフォトトロピン2の2種類がある。 - 4.ドメイン
タンパク質の構造の一部で、機能的なもの。タンパク質は一つ、あるいはいくつかのドメインから成り立つ。 - 5.光センシング
光を対象物に照射することで生じる相互作用を観測し、対象物の構造・特性を非破壊的に調べる技術である。最近では医療診断分野において積極的に応用され、光干渉断層法や血糖値計測、血液中の酸素濃度測定などに利用されている。 - 6.光遺伝学
光と遺伝子操作を使って、神経回路機能を活性化もしくは抑制させる手法。ミリ秒単位の時間的精度を持った制御を特徴とする。 - 7.フラビンモノヌクレオチド
ビタミンB2(リボフラビン)から作られる生体分子。酵素の補酵素として働くことが知られている。酸化型は黄色を呈する。 - 8.バイオインフォマティクス
応用数学、情報学、統計学、計算機科学などの技術応用によって生物学の問題を解こうとする学問。「生命情報学」「生物情報学」などと訳される。近年、多くの生物を対象に実施されているゲノムプロジェクトや構造ゲノムプロジェクトによって、大量のバイオ関連情報が得られるようになり、それらの情報をタンパク質の系統解析、構造予測、相互作用予測など有用なバイオインフォマティクス技術につなげることが求められている。 - 9.アンジュレータ
NとSの磁極を交互に上下に配置し、その間を通り抜ける電子を周期的に小さく蛇行させ、特定の波長を持った光を作り出す装置。SPring-8では、世界に先駆けて開発した真空封止型アンジュレータや27mにおよぶ長尺アンジュレータなどを整備し、世界最高レベルの放射光発生を実現している。X線自由電子レーザー施設用に開発したアンジュレータは、1台の長さが約5mであり、1台あたり277周期で磁石が交互に配列されている。 - 10.電子顕微鏡単粒子解析
透過型電子顕微鏡を用いて、多数の粒子を撮影した画像からその立体構造を明らかにする解析手法。タンパク質複合体やウイルスなどの三次元構造が明らかにされている。
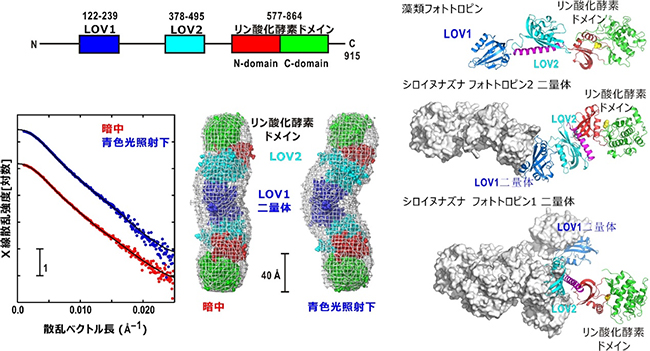
図1 フォトトロピン2全長からのX線小角散乱プロファイルと予測された構造モデル
左上:アミノ酸配列上で予想されるフォトトロピン2の機能ドメインの位置。
左下:暗中と青色光照射下でのX線小角散乱プロファイルと予想されるドメイン相対配置の変化。
右:一連のX線小角散乱研究から明らかとなった藻類のフォトトロピン、シロイヌナズナのフォトトロピン1およびフォトトロピン2の全体構造。
