要旨
理化学研究所(理研)統合生命医科学研究センター融合領域リーダー育成(YCI)プログラム[1]の伊川友活上級研究員(研究当時)、免疫器官形成研究グループの宮井智浩特別研究員らの共同研究グループ※は、マウスを用いて、免疫細胞の一種で抗体を作る機能を持つB細胞が作られるときの分子制御機構を明らかにしました。
B細胞は他の免疫細胞と同様に、血液のもととなる造血幹細胞[2]から作られます。造血幹細胞は骨髄中でB細胞へと分化・成熟します。B細胞の分化に重要ないくつかの転写因子[3]はこれまでにも報告されていましたが、それらがどのように協調して運命を制御しているかは不明でした。伊川友活上級研究員らは2015年に造血幹・前駆細胞を無限に増幅する方法として、人工白血球幹細胞(iLS細胞[4])を開発しました注1)。そこで、共同研究グループはこの方法を用いて、造血幹・前駆細胞がB細胞系列へ進むために必要な分子機構の解明に取り組みました。
まず、iLS細胞がB細胞へ分化するときの遺伝子発現の変化を、時系列を追って解析したところ、約4,000個の遺伝子の発現が変動すること、そのうち転写因子は約1,100個存在することが分かりました。また、遺伝子発現パターンに基づいて数学的に解析すると、これら転写因子は大きく初期・中期・後期の3段階に分けられました。この解析結果と公共のデータベースを用いて各転写因子間の関係(ネットワーク)を調べたところ、3段階それぞれに特異的な転写ネットワークを形成していました。さらに、三つの分化段階に相当する細胞をマウスの骨髄から採取し、1細胞レベルで網羅的に遺伝子発現を調べたところ、iLS細胞を用いた解析で明らかとなった転写ネットワークが、正常なB細胞分化においても正しいことが示されました。このことから、B細胞の生成は3段階で転写因子群が活性化する“分子スイッチ”(転写のプライミング[5])によって制御されることが明らかになりました。
ネットワークを形成している転写因子の中には、遺伝子の変異などにより活性化されたり抑制されたりすると、白血病や免疫不全症を引き起こすことが分かっています。今後、こうした疾患における転写因子の役割を研究することにより、疾患のメカニズムの解明が進めば、新たな薬剤や治療法の開発につながると期待できます。
本成果は、米国の科学雑誌『Genes & Development』オンライン版(2月9日付:日本時間2月10日)に掲載されました。
本研究は、文部科学省 科学研究費補助金 新学術領域「B細胞系列への運命決定を制御する転写制御ネットワークの解明」の支援を受けて実施されました。
注1)2015年10月23日プレスリリース「多能造血前駆細胞を無限に増幅させる方法を開発」
※共同研究グループ
理化学研究所 統合生命医科学研究センター
融合領域リーダー育成(YCI)プログラム
上級研究員(研究当時)伊川 友活(いかわ ともかつ)(現 免疫器官形成研究グループ 上級研究員)
免疫器官形成研究グループ
特別研究員 宮井 智浩(みやい ともひろ)(科学技術ハブ推進本部 医科学イノベーションハブ推進プログラム 疾患機序研究グループ 特別研究員)
東京理科大学 生命医科学研究所
教授 久保 允人(くぼ まさと)(統合生命医科学研究センター サイトカイン制御研究チーム チームリーダー)
東京大学大学院 新領域創成科学研究科
教授 鈴木 穣(すずき ゆたか)
背景
B細胞は抗体を産生する免疫細胞で、感染防御に重要な役割を果たします。B細胞は他の免疫細胞と同様に造血幹細胞から作られます。造血幹細胞は骨髄中で徐々に分化能が限定され、最終的にB細胞にしかなれない前駆細胞(B前駆細胞)となった後にB細胞へと成熟します。
伊川友活上級研究員らは、2004年にE2A[6]という転写因子を欠損させたマウスを使った実験により、E2Aを欠損するとB細胞の分化が初期段階で停止し、B前駆細胞が多能造血前駆細胞としての特徴を示すことを報告しました注2)。これは、E2AがB細胞分化への第一歩に重要であることを示しています。この知見を応用し、伊川上級研究員らは2015年にE2Aの機能を人為的に抑えることにより、造血幹・前駆細胞を無限に増幅する方法として、人工白血球幹細胞(iLS細胞)を開発しました(図1)。iLS細胞は多能前駆細胞で、T細胞やB細胞、ミエロイド系細胞などさまざまな免疫細胞への分化能を保っています。実際、このiLS細胞を用いて試験管内でB細胞へ分化させると、わずか6日間でB細胞系列への運命決定を誘導することができます。
そこで、共同研究グループはこのiLS細胞によるB細胞分化誘導系を用いることにより、多能前駆細胞がB細胞系列へ運命決定される過程において、E2Aが活性化された後に起こる遺伝子制御機構を詳しく調べました。
注2)Ikawa et al. “Long-term cultured E2A-deficient hematopoietic progenitor cells are pluripotent.” Immunity. 2004;20:349–360.
研究手法と成果
共同研究グループはまず、マウスのiLS細胞をB細胞へ分化誘導する系を用いて、培養時間(0、0.5、1、2、4…168時間:計16ポイント)ごとに細胞を回収し、細胞からRNAを採取しました(図2A)。このとき、時系列サンプルをRNA-seq[7]法を用いて網羅的に遺伝子発現を解析したところ、4,290個の遺伝子の発現に変動がみられました。さらに、これらの遺伝子の発現パターンをもとにクラスター解析を行うと、分化誘導と同時に発現が減少するもの、一過性に発現が上昇するもの、分化誘導の後期に発現が上昇するものなど10個のクラスターに分けられることが分かりました。
次に、この発現変動遺伝子の中から転写因子を抽出すると、1,144個の転写因子が含まれていました。この転写因子の遺伝子発現データと公共のデータベースを用いて転写因子間ネットワークを構築したところ、転写因子はその発現パターンに応じて初期(0.5~4時間)、中期(6~48時間)、後期(72~168時間)の3段階に分けられ、それぞれの段階において転写因子同士の密接な相互作用がみられました。また、各段階の転写因子が転写レベル、タンパク質レベルで密接につながり、次々と活性化されることが明らかになりました。(図2B)。興味深いことに、これまで分化決定をつかさどる主要な遺伝子と考えられてきたEBF1[8]やPAX5[9]が発現するのは後期の段階であり、それ以前にさらに2段階の分子スイッチ(転写のプライミング)が存在することが明らかになりました。これらの転写因子の多くは、これまでB細胞分化との関係は知られていませんでした。
続いて、この転写ネットワークのモデルが正常なB細胞分化にも当てはまるかどうかを調べるために、正常なマウスの骨髄細胞からリンフォ・ミエロイド前駆細胞(LMPP)、リンパ球系前駆細胞(CLP)、プロB(pro-B)細胞を採取し、個々の細胞の遺伝子発現を網羅的に解析できる1細胞RNA-seq法を用いて解析しました。得られたデータを遺伝子発現パターンに基づいて数学的に解析したところ、LMPPは均一でしたが、CLP、pro-Bはそれぞれさらに二つの分画に分けられることが明らかになりました(図3)。
さらに、転写ネットワーク解析から明らかになった代表的な遺伝子の1細胞レベルでの発現を調べたところ、iLS細胞を用いた培養系で初期に発現が上昇していた転写因子(例えばFOS[10]、EGR1[11]など)は、正常な骨髄細胞においても多能前駆細胞段階であるLMPPで高く発現し、その後、減少する傾向がみられました。中期および後期に特徴的な遺伝子の発現も同様に調べたところ、骨髄前駆細胞における発現パターンと非常によく相関していました(図3)。このことから、iLS細胞の分化誘導系を用いて明らかになった転写ネットワークは正常なB細胞分化においても正しいことが示されました。
次に、iLS分化誘導系の解析から明らかになったKLF4[12]やEGR1などの初動遺伝子、CBX2[13]やUHRF1[14]などのエピジェネティック因子[15]のB細胞分化における役割を明らかにするために、これらの遺伝子の機能を阻害するshRNA[16]を作成し、レトロウイルスベクター[17]を用いてiLS細胞へ導入しました。これらのshRNAを発現させたiLS細胞をB細胞系列へ分化誘導したところ、いずれもB細胞の生成が阻害されました(図4)。このことは、これら転写因子・エピジェネティック因子がB細胞分化に重要であることを示しています。
今後の期待
本研究では、独自に開発したiLS細胞およびその分化誘導系を用いて、造血幹細胞からB細胞系列への運命決定におけるダイナミックな転写制御機構が明らかになりました。これまで細胞分化における個々の転写因子やエピジェネティック因子の機能解析は行われていましたが、遺伝子発現がダイナミックに変化する分化途上での転写因子の動態や相互関係は不明でした。したがって、この転写ネットワークの発見は今後の細胞分化研究に新たな視点をもたらすものと考えられます。
また、ネットワークを形成している転写因子の中には、遺伝子の変異などにより活性化されたり抑制されたりすると、白血病や免疫不全症を引き起こすことが分かっています。今後、こうした疾患における転写因子の役割を研究することにより、疾患のメカニズムの解明が進めば、新たな薬剤や治療法の開発につながると期待できます。
原論文情報
- Tomohiro Miyai, Junichiro Takano, Takaho A Endo, Eiryo Kawakami, Yasutoshi Agata, Yasutaka Motomura, Masato Kubo, Yukie Kashima, Yutaka Suzuki, Hiroshi Kawamoto, and Tomokatsu Ikawa, "Three-step transcriptional priming that drives the commitment of multipotent progenitors toward B cells", Genes & Development, doi: 10.1101/gad.309575.117
発表者
理化学研究所
統合生命医科学研究センター 融合領域リーダー育成プログラム
上級研究員(研究当時) 伊川 友活(いかわ ともかつ)
(現 免疫器官形成研究グループ 上級研究員)
統合生命医科学研究センター 免疫器官形成研究グループ
特別研究員 宮井 智浩(みやい ともひろ)
 伊川 友活
伊川 友活
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
お問い合わせフォーム
補足説明
- 1.融合領域リーダー育成(YCI)プログラム
理研統合生命医科学研究センターが独自に推進する若手研究者のためのリーダー育成プログラム制度。免疫と他分野との融合研究を推進する若手研究者を育成するために設立された。ホストラボ制度、メンター制度などユニークなシステムを持つ。YCI はYoung Chief Investigatorの略。参照: 理研 統合生命医科学研究センター YCIプログラムのページ - 2.造血幹細胞
血液を作る大元の細胞のこと。幹細胞とは自己複製能と多分化能を兼ね備えた細胞と定義される。白血球や赤血球、血小板などすべての血液細胞を作り出す。成体では骨髄に主に存在する。 - 3.転写因子
遺伝子の発現を制御するタンパク質。多くはDNAとの結合部位を持ち、標的遺伝子のエンハンサー、プロモーター、サイレンサーなどの配列に結合して、標的遺伝子の発現を活性化または抑制する。 - 4.iLS細胞
人工的に作成した多能血液前駆細胞。試験管内で無限に増幅し、白血球(T細胞、B細胞、ミエロイド細胞)への分化能を保っている。iLSはinduced Leukocyte Stem cellsの略。 - 5.転写のプライミング
転写因子同士は互いの発現を制御し合い、密接につながっている。細胞分化においては、転写因子の発現が次々と活性化・抑制されることから、転写のプライミング(点火)とも呼ばれる。 - 6.E2A
EボックスというDNA配列に特異的に結合し、さまざまな遺伝子の発現(転写)を制御するEタンパク質と呼ばれるタンパク質の一つ。bHLH(ベーシック・ヘリックス・ループ・ヘリックス)領域と呼ばれる構造を持つ。B細胞やT細胞の生成に必須のタンパク質であることが知られている。 - 7.RNA-seq
次世代シーケンサーを用いた網羅的遺伝子発現解析法。細胞内のRNAの発現量を定量的に調べることができる。RNA-sequencingの略。 - 8.EBF1
B細胞の分化を制御する代表的な転写因子の一つ。E2Aによってその発現が活性化され、一度EBF1が活性化されるとE2Aと協調してB細胞分化を促進する。 - 9.PAX5
E2A、EBF1とともにB細胞分化のマスター遺伝子の一つ。B細胞の生成に重要な多くの遺伝子の転写制御領域に結合し、その発現を制御している。E2A、EBF1によって活性化される。 - 10.FOS
FOSB、FOSL1、FOSL2とともにFOSファミリー遺伝子の一つ。JUNファミリータンパク質と二量体を形成し、AP-1と呼ばれる転写因子として働く。細胞の増殖、分化、アポトーシスなどさまざまな生命現象に関わる。 - 11.EGR1
ジンクフィンガー型の転写因子。細胞が刺激を受けると活性化され、細胞の増殖や分化に広く関わる。 - 12.KLF4
ジンクフィンガー型の転写因子。皮膚の細胞の分化に重要である。細胞周期を制御すると考えられている。 - 13.CBX2
エピジェネティック因子として代表的なポリコーム複合体を構成するタンパク質の一つ。ポリコームタンパク質はもともと形態形成に関わるホメオティック遺伝子の発現を調節する因子として発見されたが、現在ではさまざまな細胞の遺伝子発現を制御することにより、発生・分化に重要な働きをすることが知られている。 - 14.UHRF1
NP95ともいう。維持型DNAメチル化酵素であるDNMT1とともにDNAのメチル化に関わるタンパク質。DNAの修復や細胞周期の進行にも重要であるとされている。 - 15.エピジェネティック因子
遺伝情報を伝達するゲノムDNAの塩基配列には変更を加えずに、DNA塩基やゲノムを構成するタンパク質を化学修飾することにより遺伝子発現を調節する因子のこと。発生や分化など多様な生命現象に関係する。 - 16.shRNA
任意の遺伝子の機能を阻害する実験手法。配列特異的にRNAが分解されるRNA干渉という現象を利用したもの。shRNAは切断されて短い二本鎖RNAとなり、標的遺伝子の発現を長期的に抑制する。 - 17.レトロウイルスベクター
ベクターとは「運び屋」のこと。1本鎖RNAウイルスで、細胞に感染し遺伝子を内部に運び入れてくれるウイルスのことをレトロウイルスベクターと呼ぶ。ウイルスが持つ病原性に関する遺伝子は取り除かれている。
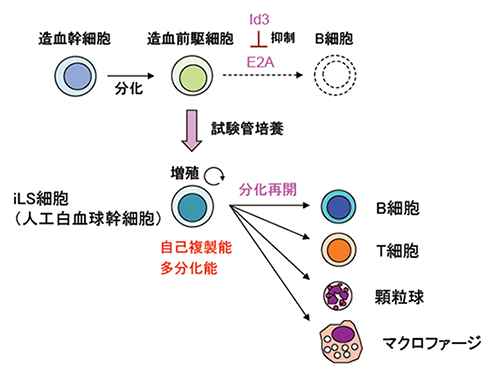
図1 自己複製能と多分化能を兼ね備えたiLS細胞
Id3を導入した造血前駆細胞はE2Aの活性が下がるため、多能前駆細胞段階で分化が停止し、試験管内で自己複製する。また、この細胞は多能性を維持し、主にリンパ球(B細胞、T細胞)や顆粒球などの白血球を作り続けるため、induced Leukocyte Stem(iLS)細胞と呼ぶ。
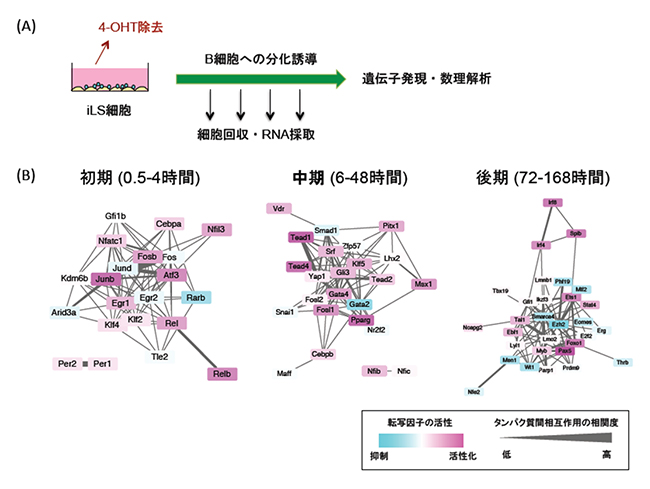
図2 iLS細胞を用いたB細胞への分化誘導とB細胞分化を制御する転写ネットワーク
- (A) マウスのiLS細胞を用いたB細胞分化誘導系。iLS細胞は4-OHT(4-hydroxytamoxifen)依存的に多能性を維持している。培養系から4-OHTを除去することにより、B細胞への分化を誘導した。培養後、所定の時間に細胞を回収した後、この時系列サンプルからRNAを採取し、RNA-seq法を用いて網羅的に遺伝子発現を解析した。
- (B) 時系列解析によって明らかになった転写ネットワーク。初期、中期、後期の3段階に分けられ、それぞれ異なったネットワークを形成していた。各転写因子の活性を色で示す。転写活性化因子(標的遺伝子の発現を上昇させる)として働いていれば赤く、逆に転写抑制因子(標的遺伝子の発現を減少させる)として働いていれば青色が濃くなる。転写因子(タンパク質)間相互作用の相関度を線の太さで示す。
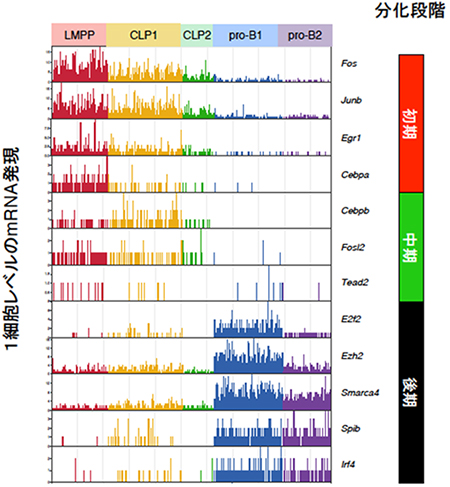
図3 マウス骨髄の前駆細胞における1細胞レベルの遺伝子発現
正常なマウス骨髄のリンフォ・エミロイド前駆細胞(LMPP)、リンパ球系前駆細胞(CLP)、プロB(pro-B)細胞を採取し、1細胞RNA-seqにより解析した。解析の結果、CLPおよびpro-B細胞はそれぞれ二つの分画(CLP1とCLP2、pro-B1とpro-B2)に分かれた。さらに、転写ネットワーク解析により明らかになった3段階(初期、中期、後期)に特徴的な遺伝子の発現を調べたところ、正常な骨髄前駆細胞においても発現パターンが相関していた。
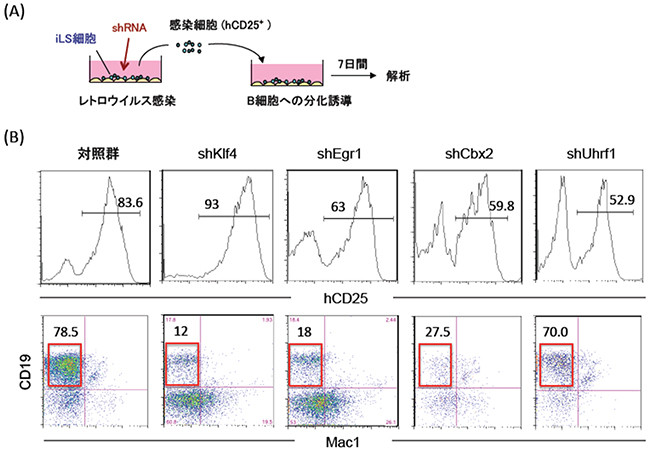
図4 ネットワーク解析により明らかとなった転写因子・エピジェネティック因子の機能解析
- (A) 遺伝子阻害実験系。iLS細胞にそれぞれの遺伝子の機能を阻害するshRNAレトロウイルスを感染させ、感染細胞(hCD25陽性)をB細胞系列へ分化誘導した。7日後に細胞を回収し、フローサイトメーターを用いて解析した。
- (B) 培養後のフローサイトメーター図。上の図は、レトロウイルスに感染した細胞(hCD25陽性)の割合を示す。hCD25陽性細胞をさらにMac1とCD19という表面抗原マーカーで解析した結果を下の図に示す。B細胞分画(CD19陽性)を赤で囲い、その割合を数字で示している。対照群と比べて、いずれもB細胞の生成が阻害されたことが分かる。
