理化学研究所(理研)開拓研究本部伊藤ナノ医工学研究室の上田一樹研究員、伊藤嘉浩主任研究員らの研究グループ※は、両親媒性ポリペプチド[1]でナノサイズの筒状構造体を作製し、その中に抗がん剤を入れ、筒の両端を半球でキャップした「魚雷型ナノカプセル」を開発しました。
本研究成果は、がん治療をはじめとするさまざまな薬剤体内輸送用カプセルや細胞内への核酸輸送用カプセルとしての応用が期待できます。
アスペクト比[2]を持ったロッド状材料は、高い血中滞留性や細胞内輸送性、細胞内でのエンドソーム[3]脱出性を示すことなどが報告されており、ロッド状のカプセル開発が期待されていました。しかし、ナノサイズでロッド状の中空構造体を作ることは困難であり、これまで達成されていませんでした。
今回、研究グループは、両親媒性ポリペプチドで形成される筒状構造体の存在下で、球状構造体を作る両親媒性ポリペプチドを自己集合化させることで、ロッド状の魚雷型ナノカプセルの作製に成功しました。サイズは筒状構造体と球状構造体に由来しており、筒状構造体の部分は加熱によって伸長させることができ、さまざまな長さのナノカプセルを調製できます。また、この魚雷型ナノカプセルは、球状カプセルと比較して、細胞内に素早く多量に取り込まれやすいことを示しました。さらに、抗がん剤を内包して担がんマウスに注射することで、腫瘍患部へ素早く薬剤を輸送し、抗がん効果を発揮させることにも成功しました。
本研究は、米国の国際科学雑誌『ACS Nano』掲載に先立ち、オンライン版(1月4日付け)に掲載されました。
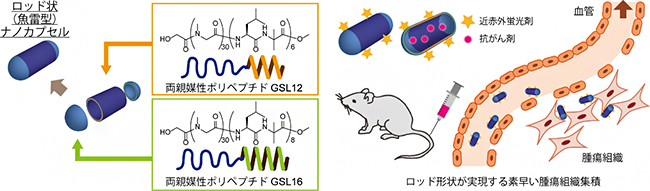
図 魚雷型ナノカプセルの設計と薬剤輸送
※研究グループ
理化学研究所
開拓研究本部 伊藤ナノ医工学研究室
研究員 上田 一樹(うえだ もとき)
主任研究員 伊藤 嘉浩(いとう よしひろ)
生命医科学研究センター 免疫細胞治療研究チーム
チームリーダー 藤井 眞一郎(ふじい しんいちろう)
研究員 伊豫田 智典(いよだ とものり)
脳神経科学研究センター 研究基盤開発部門 動物資源開発支援ユニット
ユニットリーダー 高橋 英機(たかはし えいき)
専門技術員 荒井 高(あらい たかし)
背景
近年、ドラッグデリバリーシステム[4]や生体機能解明の基礎研究分野において、アスペクト比を持つロッド状構造が注目されています。ロッド状構造は従来の球状構造に比べ、より素早く細胞内に取り込まれるといった研究成果注1)をはじめ、血流中において長く滞留する注2)、特定の組織に集積するなど注3)、ユニークな性質を示すことが報告されているからです。
ロッド形状がもたらすこれらの性質は、ドラッグデリバリーシステムのキャリアーや細胞内輸送ベクター(運び屋)の開発にとって魅力的です。しかし、ロッド状カプセル構造をナノサイズで実現することは難しく、実際にロッド状ナノカプセルを開発した例は少なく、応用研究した報告例はありませんでした。
両親媒性分子による分子集合体は、中空構造体を形成するには適していますが、自発的な集合化のため形状制御が困難です。そこで、研究グループはロッド形状を部位に分け、筒状構造と半球状構造の組み合わせであることに着目しました(図1)。筒状構造体と球状構造体は、分子集合体の分野では比較的一般的な形状であり、実際、これまでに伊藤嘉浩主任研究員らは、疎水性のαヘリックス構造を持つ両親媒性ポリペプチドを用いて筒状構造体、球状構造体の作り分けを報告してきました注4)。
分子集合体は疎水性相互作用によって形成されることから、球状構造体形成分子は筒状構造体の疎水性末端に集まり、その場で球状構造体を形成すると予想し、今回、筒状構造体の存在下での球状構造体形成を行い、ロッド状の「魚雷型ナノカプセル」の作製を試みました。さらに、魚雷型ナノカプセルが薬物を内包できるか、細胞内取り込みは速いかなどを調べました。
- 注1) Barua. S.; Yoo, J.-W.; Kolhar, P.; Wakankar, A.; Gokarn, R. Y.; Mitragotri, S.., Particle shape enhances specificity of antibody-displaying nanoparticles. Proc. Natl. Acad. Sci, 2013, 110(9), 3270-3275.
- 注2) Blanco, E.; Shen, H.; Ferrari, M., Principles of nanoparticle design for overcoming biological barriers to drug delivery. Nat. Biotech. 2015, 33(9), 941-951.
- 注3) Hinde, E.; Thammasiraphop, K.; Duong, T. T. H.; Yeow, J.; Karagoz, B.; Boyer, C.; Gooding, J. J.; Gaus, K., Pair correlation microscopy reveals the role of nanoparticle shape in intracellular transport and site of drug release. Nat. Nanotechnol. 2017. 81-89.
- 注4) Ueda, M.; Seo, S.; Müller, S.; Md. Rahman, M.; Ito, Y., Integrated Nanostructures Based on Self-Assembled Amphiphilic Polypeptides. Advances in Biosinpired and Biomedical Materials, volume 1, 2017, 19–30. ed by Yoshihiro Ito, Xuesi Chen and Inn-Kyu Kang, American Chemical Society.
研究手法と成果
研究グループはまず、疎水部にαヘリックス構造[5]を持つ2種の両親媒性ポリペプチドGSL12とGSL16が、それぞれ筒状構造体と球状構造体を形成するかを検討しました(図2)。GSL12のαヘリックス構造は、リッジアンドグルーブ(尾根と谷)相互作用[6]により、互いの分子が傾いて自己集合化することで、異方性と曲率が形成され筒状構造体となります。一方、GSL16のαヘリックス構造はより長いため、平行的な分子配向が優先され、球状構造体となります。GSL12の筒状構造体分散液にGSL16分子を加え、90℃で加熱することで、筒の口がシーリング(密封)され、魚雷型ナノカプセルの作製に成功しました(図2)。
透過型電子顕微鏡(TEM)[7]で調べたところ、この魚雷型ナノカプセルの直径(80ナノメートル[nm、1nmは10億分の1メートル])および長さ(200nm)は、筒状集合体と同じでした。つまり、筒状構造体の疎水性末端にGSL16が集まり、半球を形成したことを示しています。実際、球状構造体を作った後に筒状構造体と混ぜても、魚雷型ナノカプセルは得られず、筒状構造体存在下で自己集合化を行うことが重要であることが分かりました。
この魚雷型ナノカプセルは、筒状構造体と半球状構造体を組み合わせているため、筒状構造体の長さを制御することでカプセルの長さも制御することができます。筒状構造体を80℃あるいは90℃で数時間加熱することで、100nmから1000nmまでの筒状構造体を得ることに成功しました。このとき、高温の方が長い構造体、低温の方が短い構造体の作製に適していることも分かりました。また、TEM画像観察から、筒状構造体が疎水性末端を介して融合することで伸長していることが予想されます。この長さの異なる筒状集合体の存在下で、GSL16を自己集合化させることで、長さの異なる魚雷型ナノカプセルの調製に成功しました(図3)。
次に、115、200、305、560nmの長さを持つ筒状構造体(直径80nm)と直径80nmの球状構造体を用いて、HeLa細胞(ヒト子宮頸がん細胞)に対する細胞内取り込み速度の評価を行いました。その結果、これらのうち115、200、305nmの筒状構造体(アスペクト比はそれぞれ約1.4、2.4、3.8)は、80nmの球状構造体に比べて素早く多量に細胞に取り込まれることが分かりました。具体的には、1~4時間で球状構造体に比べ、5倍もの筒状構造体(200nm)がHeLa細胞に取り込まれていました。さらに本実験では、200nmが最も素早く取り込まれることから、最適なアスペクト比(2.4)が存在することが分かりました(図4左)。
アスペクト比を持つ材料が球状材料よりも素早く取り込まれる理由として、点ではなく面で細胞膜に接するために細胞膜に斜めに侵入することで素早く細胞膜に包まれること、多点で膜タンパク質を刺激することなどが仮説として挙げられます(図4右)。また、細胞を用いた実験から細胞取り込み機構がクラスリン介在性エンドサイトーシス[8]であることが分かりました。クラスリン介在性エンドサイトーシスは取り込む物資のサイズに上限があるため、300nm以上の筒状構造体では取り込み量が著しく減少し、200nmの取り込み量が最大となったものと考えられます。
魚雷型ナノカプセルは中空のため、親水性薬物を内包できます。抗がん剤のシスプラチンを溶かした水溶液で魚雷型ナノカプセルを作り、外部液を洗い流し、シスプラチンを内包できることを確認しました。そして、このナノカプセルを胆がんマウスに注射したところ、投与後12時間をかけて徐々に腫瘍に集積する球状カプセルに比べて、投与後2時間程度で速やかに腫瘍に集積することが分かりました。さらに、シスプラチン単独や球状カプセルの場合と比較して、その腫瘍の成長抑制効果を大きく向上させることも分かりました。具体的には、投与した2週間後、シスプラチンそのままでは1.3倍のサイズにがん細胞が成長し、シスプラチン内包球状ナノカプセルでは1.2倍に成長しましたが、シスプラチン内包魚雷型ナノカプセルを投与した場合では、がん細胞のサイズの増加(成長)を抑えることに成功しました(図5)。
今後の期待
これまでにも、アスペクト比を持つロッド状の材料が、球状の材料とは異なる組織集積を示すことが報告されています。本研究で開発した「魚雷型ナノカプセル」を用いることで、従来の球状カプセルでは困難であった、がん治療をはじめとするさまざまな薬剤体内輸送用カプセルや細胞内への核酸輸送用カプセルとしての応用が期待できます。
原論文情報
- Motoki Ueda, Siyoong Seo, Baiju G. Nair, Stefan Müller, Eiki Takahashi, Takashi Arai, Tomonori Iyoda, Shin-ichiro Fujii, Satoshi Tsuneda, Yoshihiro Ito, "End-sealed high aspect ratio hollow nanotube encapsulating anticancer drug - Torpedo-shaped peptidic nanocapsule", ACS Nano, 10.1021/acsnano.8b06189
発表者
理化学研究所
主任研究員研究室 伊藤ナノ医工学研究室
研究員 上田 一樹 (うえだ もとき)
主任研究員 伊藤 嘉浩 (いとう よしひろ)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
補足説明
- 1.両親媒性ポリペプチド
親水性と疎水性を示す部位を持つポリマー分子であり、水中において疎水性相互作用により分子集合体を形成する。本研究では、親水部に26量体のポリサルコシン、疎水部にLロイシンとアミノイソ酪酸の交互配列12量体からなる両親媒性ポリペプチドを合成して用いている。 - 2.アスペクト比
一般的には長方形の長辺と短辺の比率のことをいう。本研究の魚雷ナノカプセルについては、カプセルの直径と長さの比を指す。 - 3.エンドソーム
細胞小器官の一つ。細胞内に取り込まれた物質の輸送や代謝に関与する袋状の構造体。 - 4.ドラッグデリバリーシステム
薬物送達システムの総称。組織や細胞、また病変部などへ、直接に適時適量の薬剤などを運搬する方法。 - 5.αヘリックス構造
タンパク質の二次構造の共通モチーフの一つで、バネのような右巻きらせんの形をしている。 - 6.リッジアンドグルーブ(尾根と谷)相互作用
偶数番目に側鎖の大きなアミノ酸、奇数番目に側鎖の小さなアミノ酸を配列したペプチドがαヘリックス構造を取る際、ヘリックス軸に沿って、2、6、10番目、4、8、12番目が一直線に並び尾根のように大きい側鎖が連なる構造ができ、1、5、9番目、3、7、11番目に小さな側鎖が連なる谷のような構造ができる。この凹凸が噛み合うことで、ヘリックスは特徴的に配向する。これをリッジアンドグルーブ相互作用という。 - 7.透過型電子顕微鏡(TEM)
観察対象に電子線をあて、透過してきた電子線の強弱から観察対象の形態を観察する電子顕微鏡。ナノメートルサイズの構造物を観察することができる。 - 8.クラスリン介在性エンドサイトーシス
エンドサイトーシスとは、細胞が細胞外の物質を取り込む過程の一つである。さらに、クラスリン介在性エンドサイトーシスはそのエンドサイトーシスの機構の一つである。物質が細胞膜上のリガンドと結合すると、細胞内に存在するクラスリンタンパク質は、細胞膜の内側に作用してその内側表面を覆う。クラスリンに覆われた穴は深くなり細胞質の中に陥入し、クラスリンは籠構造を形成して陥入した細胞膜ごと細胞膜上の物質を取り込み、細胞内部へと送り込む。

図1 ロッド状構造体の分割
研究グループは、ロッド状構造体が筒状構造と両端の半球状構造の組み合わせであることに着目した。
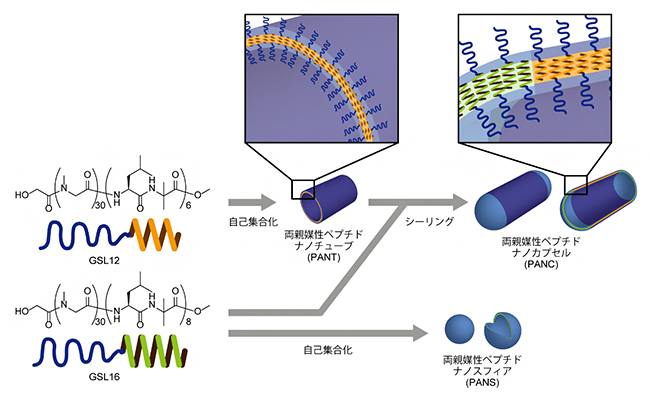
図2 魚雷型ナノカプセル作製の概念
GSL12(黄色の部分がαへリックス構造)は自己集合化により、筒状構造(PANT)を形成する。GSL(緑の部分がαへリックス構造)は自己集合化により、球状構造(PANS)を形成する。SL12の筒状構造体分散液にGSL16分子を加え、90℃で加熱すると魚雷型ナノカプセル(PANC)が作製される。
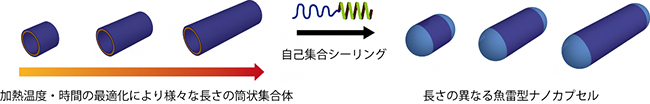
図3 長さの異なる魚雷型ナノカプセルの作製
加熱温度や加熱時間を最適化することで、100nm~1000nmの長さの筒状構造体が作製できる。それらにGSL16を自己集合化させることで、さまざま長さの魚雷型ナノカプセルが調整できる。
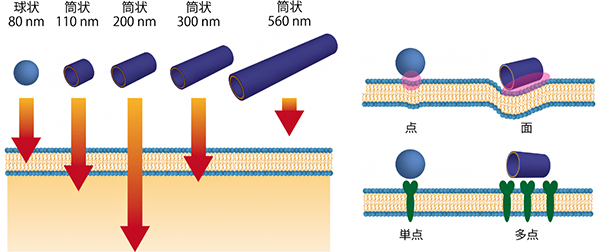
図4 球状より素早く細胞に取り込まれる筒状構造体とその理由の仮説
- 左: 同じ直径の球状構造体よりも110nm、200nm、300nmの長さの筒状構造体は、細胞内に取り込まれる速度が速かった。
- 右: 左で示された違いの理由は、点ではなく面で細胞膜に接するために細胞膜に斜めに侵入することで素早く細胞膜に包まれること、多点で膜タンパク(緑)を刺激することなどが考えられる。
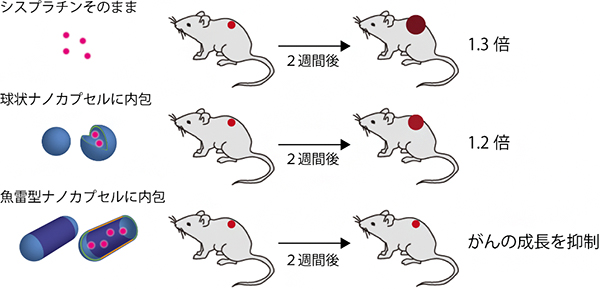
図5 シスプラチン内包魚雷型ナノカプセルの投与によるがんの成長抑制
投与2週間後で比較すると、シスプラチンそのままでは1.3倍のサイズにがん細胞が成長(上段)。シスプラチン内包球状ナノカプセルでは1.2倍に成長(中段)、シスプラチン内包魚雷型ナノカプセルではがん細胞のサイズの増加(成長)を抑えることに成功した。
