理化学研究所(理研)生命医科学研究センター疾患遺伝研究チームの山本雅チームリーダー(沖縄科学技術大学院大学細胞シグナルユニット教授)、鈴木亨上級研究員らの共同研究グループ※は、生物の成長過程で肝臓が成熟した機能を獲得するために、メッセンジャーRNA(mRNA)[1]を分解する酵素が大きな役割を果たすことを発見しました。
本研究成果は、幼少期の未成熟な肝臓が成熟した状態になるまでに、遺伝子の発現がどのように調節されているかを明らかにするものです。今後、肝疾患が発症する原因の究明や治療法の開発に貢献すると期待できます。
今回、共同研究グループは、mRNAを分解する作用を持つタンパク質複合体[2]「CNOT」が、マウスの幼少期の肝臓で多く発現しており、その後の組織形成過程で不要になるmRNAを分解することで、代謝などの機能を担う成熟した肝臓の形成を促進していることを明らかにしました。必要のないmRNAが存在していると、肝臓の機能に不可欠なmRNAの発現が不十分になり、結果としてさまざまな肝機能障害が起こりました。器官の成熟にはそれぞれの機能を獲得するために、mRNAを増加させることが重要であることは分かっていましたが、本研究は不要なmRNAを積極的に分解することも同様に不可欠であることを示しています。
本研究は、英国の科学雑誌『Development』(2月15日付け)に掲載されました。
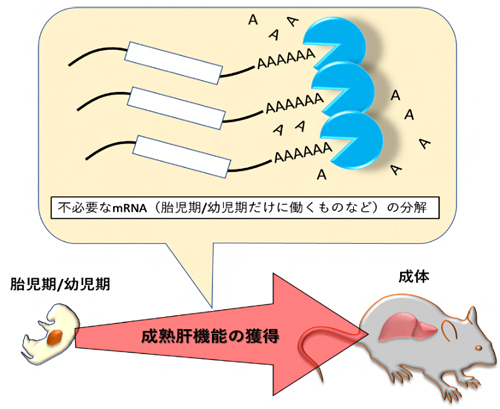
図 肝臓機能の成熟を促すmRNA分解
※共同研究グループ
理化学研究所 生命医科学研究センター
疾患遺伝研究チーム
チームリーダー 山本 雅(やまもと ただし)
(沖縄科学技術大学院大学 細胞シグナルユニット 教授)
上級研究員 鈴木 亨(すずき とうる)
テクニカルスタッフI 菊口 千智(きくぐち ちさと)
統合細胞システム研究チーム
チームリーダー 岡田 眞理子(おかだ まりこ)
(大阪大学 蛋白質研究所 細胞システム研究室 教授)
沖縄科学技術大学院大学 細胞シグナルユニット
研究員 高橋 明格(たかはし あきのり)
テクニカルスタッフ 西島 さおり(にしじま さおり)
東北大学大学院医学系研究科附属創生応用医学研究センター がん医学コアセンター 細胞増殖制御分野
助教(研究当時)長嶋 剛史(ながしま たけし)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金 基盤研究S「CCR4-NOTデアデニレース欠損に伴う病態解析と新たな遺伝子発現制御機構」(研究代表者:山本雅)、同基盤研究C「細胞間相互作用を介した肝再生機構の解明と再生肝細胞の起源の同定」(研究代表者:鈴木亨)による支援を受けて行われました。
背景
動物個体の各器官は、代謝、呼吸、循環など固有の機能を持っています。それぞれの機能の獲得には、それぞれの役割を持つタンパク質の産生を必要とします。器官の形成過程では、必要なタンパク質を産生するために、対応するメッセンジャーRNA(mRNA)の発現が増加します。
肝臓では、胎児期/幼少期と成体で、造血から代謝へと役割が変わるため、多様なmRNAの発現変動が観察されます。肝臓の形成において、成熟した器官としての機能に必要なmRNAを増加させる仕組みが、多くの研究によって明らかにされてきました。一方で、肝臓形成の初期段階で必要であったmRNAは、その後不要になると増加させる仕組みが働かなくなります。しかし、それまでに合成されたmRNAはそのまま残るため、そのmRNAがどのような制御を受けるのかはよく分かっていませんでした。
山本雅チームリーダーらは、mRNAを分解する活性を持つタンパク質複合体に注目し、mRNA分解が生命現象に果たす役割を解析してきました注1)。今回、共同研究グループは、肝臓の成熟過程でmRNA分解を担う複合体が働かなくなったときの影響を調べました。
注1)Li X., Morita M., Kikuguchi C., Takahashi A., Suzuki T., and Yamamoto T. Adipocyte-specific disruption of mouse Cnot3 causes lipodystrophy. FEBS Lett (2017) 591, 358-368.
研究手法と成果
「CNOT」タンパク質複合体は、mRNAのポリA鎖[3]を削る活性を持つRNA分解酵素です。ポリA鎖は3’末端[4]に存在しており、このポリA鎖を削る反応によりmRNA分解が開始すると考えられています。CNOTタンパク質複合体は、酵母から哺乳動物まで幅広い種に存在することが分かっており、普遍的かつ主要なmRNA分解酵素であると考えられています。
そこで共同研究グループは、肝臓の成熟が開始する段階でCNOTタンパク質複合体が働かなくなる遺伝子改変マウス(CNOT変異体マウス)を作製し、肝臓の形成に与える影響を調べました。その結果、CNOT変異体マウスの肝臓は、炎症、壊死、脂肪の異常蓄積など、さまざまな病態を発症していることが分かりました(図1)。さらに、CNOT変異体マウスの血液検査を行ったところ、AST[5]、ALT[5]の値が高く、肝機能障害を起こしていました。また、CNOT変異体マウスは、炎症に伴って胸腺、脾臓が肥大化しており、肝機能障害が原因となり体重が減少していました。
また、肝臓の形成段階を追ってmRNAの発現を調べたところ、野生型マウスでは胎児期/幼少期の肝臓で発現の高いmRNAが、成熟した時期には大きく減少しているのに対し、CNOT変異体マウスでは、成熟しているはずの時期でもmRNAの発現が高いままであることが分かりました(図2A)。さらに、CNOT変異体のmRNAは、ポリA鎖が削られていないことも分かりました(図2B)。
胎児期/幼少期から成熟した肝臓へ変化したことを示す特徴として、分裂している細胞がほとんどなくなること、一つの細胞に核をニつ持つことがあります。しかし、CNOT変異体マウスでは、成熟するはずの時期でも分裂している細胞、核が一つの細胞が多いことが分かりました(図3)。細胞分裂の促進に関わるmRNA、核を一つのまま維持することに関わるmRNAも、胎児期/幼少期の肝臓で発現の高いmRNAに属しています。
一方で、成熟した肝臓で増加するmRNAを調べた結果、CNOT変異体マウスでは十分に増加していないことが示されました。胎児期/幼少期の肝臓で発現の高いmRNAから産生されるタンパク質の中には、成熟した肝臓で働くmRNAを増加させない効果を持つものが知られており、それらのmRNAが分解されなかった影響と考えられます。
今後の期待
本研究から、肝臓の成熟には、不要なmRNAを積極的に分解することが必要であると分かりました。mRNA分解を実行していたCNOTタンパク質複合体は、肝臓以外の器官にも存在するので、他の器官の形成・成熟の仕組みを理解することにも役立つと考えられます。
器官の機能が損なわれる疾患では、mRNAの異常な増加を伴っている場合があります。mRNAの異常な増加が、合成と分解のどちらの(あるいは両方の)異常を原因としているのかを突き止めることで、標的とすべき因子が明確になり、より効果的な治療法の開発につながると期待できます。
原論文情報
- Toru Suzuki, Chisato Kikuguchi, Saori Nishijima, Takeshi Nagashima, Akinori Takahashi, Mariko Okada, and Tadashi Yamamoto, "Postnatal liver functional maturation requires Cnot complex-mediated decay of mRNAs encoding cell cycle and immature liver genes", Development, 10.1242/dev.168146
発表者
理化学研究所
生命医科学研究センター 疾患遺伝研究チーム
チームリーダー 山本 雅(やまもと ただし)
(沖縄科学技術大学院大学 細胞シグナルユニット 教授)
上級研究員 鈴木 亨(すずき とうる)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
沖縄科学技術大学院大学 広報ディビジョン メディアセクション
Tel: 098-982-3447 / Fax: 098-966-2887
E-mail:tomomi.okubo[at]oist.jp
※上記の[at]は@に置き換えてください。
産業利用に関するお問い合わせ
補足説明
- 1.メッセンジャーRNA(mRNA)
伝令RNAとも呼ばれる。DNA上の(アデニン、グアニン、シトシン、チミンからなる塩基配列に基づいて合成される一本鎖のヌクレオチド。mRNAを使ってタンパク質が合成される。 - 2.タンパク質複合体
複数の異なるタンパク質が結合した状態のもの。各タンパク質は異なる役割を担っているが、結合した状態で一つの機能を果たす(CNOT複合体の場合はmRNA分解)。 - 3.ポリA鎖
mRNAやその他いくつかのRNAの3’末端に付加されるAMP(アデノシン一リン酸)の重合体。 - 4.3’末端
DNAやRNAは、リン酸が糖の3’位と5’位の炭素を結んで長い鎖が作られている。この3’と5’方向を示す指標として使用され、核酸の鎖を5’側から3’方向へたどったときの最後の部位を3’末端と呼ぶ。 - 5.AST、ALT
どちらも肝臓の細胞で作られるトランスアミナーゼと呼ばれる酵素。肝細胞が破壊されると血液中に放出されるので、肝機能を測定するときの血液検査の項目になっている。
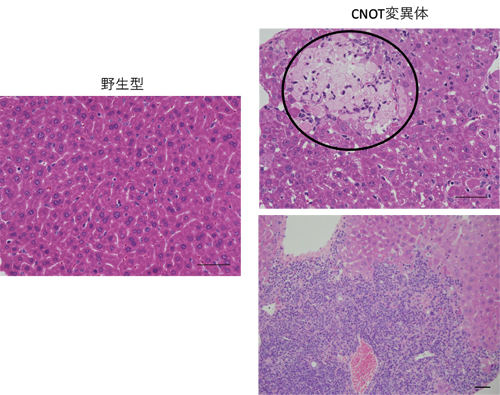
図1 CNOT変異体マウスの肝臓で見られる壊死と炎症
ヘマトキシリン―エオシン染色した肝臓の組織切片。左は野生型マウス由来の正常な肝臓の画像。右の二つはCNOT変異体マウス由来の肝臓。右上の黒枠内は壊死を起こしている部分を示している。右下は、肝臓内に炎症を引き起こす細胞(紫)が写真内全体的に浸潤してきていることを示している。
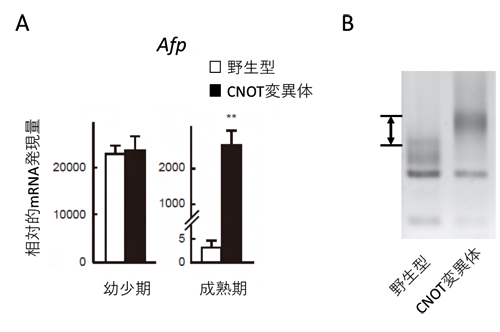
図2 CNOT変異体マウスの肝臓で見られるmRNA発現量の亢進と分解異常
- (A) 胎児期/幼少期で高い発現を示す遺伝子(Afp)のmRNA量の比較。幼少期(生後1週)と成熟期(生後4週)の肝臓におけるAfp mRNA量を、野生型とCNOT変異体で比較している。幼少期で同程度だった発現量が、成熟期ではCNOT変異体マウスで非常に高くなっている。
- (B) 野生型とCNOT変異体におけるmRNA分解の比較。図の上部ほど長く、下部に行くほど短いmRNAが検出される方法を用いており、CNOT変異体のmRNAは矢印に相当する分だけ野生型のmRNAより長く、mRNAが削られていないことを示している。
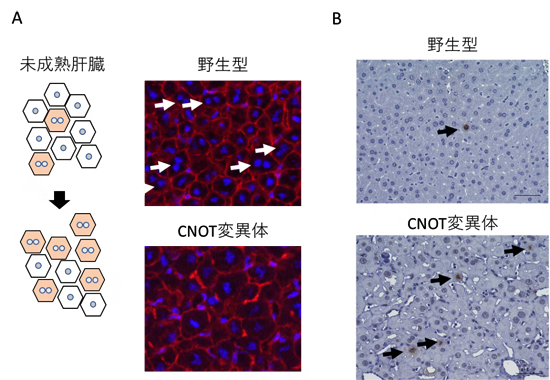
図3 CNOT変異体マウスの肝臓で見られる未成熟肝臓の特徴
- (A) 左は、肝臓が成熟するにしたがって1つの細胞内に2つの核を持つようになることを示す概念図。右の写真は、生後4週の野生型、およびCNOT変異体マウスの肝臓から切片を作製して、核(青)と細胞の境界(赤)を染色したものを示している。野生型に見られるニつの核を持つ細胞(白矢印)が、CNOT変異体ではあまり確認できない。
- (B) 分裂している細胞を検出する抗体(リン酸化されたヒストンH3に対する抗体)による肝臓切片の免疫組織化学染色の写真。濃い茶色で染色された細胞(矢印)が分裂している細胞を示している。CNOT変異体マウスの肝臓では分裂している細胞が多いことが分かる。
