ポイント
理化学研究所(理研)生命機能科学研究センター集積バイオデバイス研究チームの田中陽チームリーダー、田中信行研究員、慶應義塾大学理工学部の山下忠紘助教、スイス連邦工科大学チューリッヒ校健康科学技術学部のヴィオラ・フォーゲル教授らの国際共同研究チーム※は、微小な溝が刻まれたシート上でラットの心筋細胞を培養することで、溝を橋渡しする立体的な拍動組織「心筋ブリッジ」を自発的に形成させ、さらにその特性から“マイクロ心臓”ともいうべき機能性が実現できることを明らかにしました。
本研究成果は、心筋細胞が集まって心臓を形作る際の実験モデルとして、あるいは創薬分野で行われている心毒性[1]試験や薬効試験のための系として、さらには拍動そのものを利用した微小動力源としての利用が期待できます。
今回、国際共同研究チームは、細胞を小さな環境に閉じ込めて培養した場合とそうでない場合では、細胞が異なる振る舞いを示すことに注目しました。シリコーンゴム[2]のシートに深さ0.15mm、幅0.2mmの溝を刻み込んだ構造体を作製し、それを培養皿内に入れて、ラット心筋細胞(大きさ約0.02mm)を7日間培養しました。その結果、心筋細胞が自然と寄り集まり、溝の間に橋のような大きな細胞組織(心筋ブリッジ)が形成されました。さらに、心筋ブリッジの拍動による微細構造のたわみを利用し、その間を満たす培養液を動かすことができました。これら一連の結果により、“マイクロ心臓”ともいうべき機能性が実現されました。
本研究は、オランダの科学雑誌『Sensors and Actuators B: Chemical』のオンライン版(4月18日付け)に掲載されました。
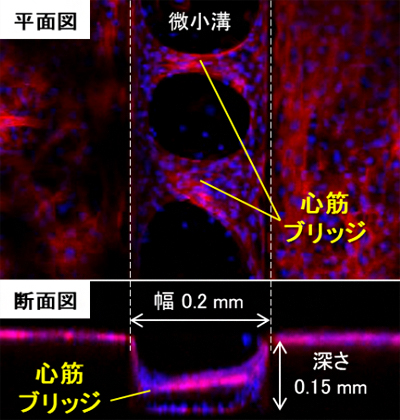
図 微小溝に生じたラットの心筋ブリッジ
※国際共同研究チーム
理化学研究所 集積バイオデバイス研究チーム
チームリーダー 田中 陽(たなか よう)
研究員 田中 信行(たなか のぶゆき)
テクニカルスタッフI 天谷 諭(あまや さとし)
テクニカルスタッフII 佐藤 麻子(さとう あさこ)
客員研究員 ヤシャイラ・ヤリクン(Yaxiaer Yalikun)
慶應義塾大学 理工学部 助教 山下 忠紘(やました ただひろ)
スイス連邦工科大学チューリッヒ校 健康科学技術学部
教授 ヴィオラ・フォーゲル(Viola Vogel)
※研究支援
本研究は、日本学術振興会(JSPS)二国間交流事業「細胞ブリッジ現象を用いた超小型心筋細胞ポンプの開発(研究代表者:田中陽)」ほか2課題(研究代表者:田中信行、山下忠紘)、海外特別研究員制度(研究代表者:山下忠紘)、科学研究費補助金 挑戦的萌芽研究「ミミズ体壁筋を用いた微小流路内流体制御・物質輸送システムの創出(研究代表者:田中陽)」、「シビレエイの細胞を用いたバイオマイクロ発電デバイスの開発(研究代表者:田中陽)」およびスイス連邦工科大学チューリッヒ校(研究代表者:ヴィオラ・フォーゲル)による支援を受けて行われました。
背景
生体を構成する細胞を生体外で育てる細胞培養は、生命機能の解明や、薬品に対する反応の解析のために、生物学や創薬の分野でよく用いられています。近年では、培養された細胞を治療の一環として患者に移植する再生医療においても基本となる技術です。一般的な細胞培養は、栄養分などが含まれた培養液が注がれた平らなシャーレ(培養皿)の底に細胞が接着した状態で行われます。これに対して、細胞を小さな空間に閉じ込めて培養すると、細胞の振る舞いが変わることが知られています。
田中信行研究員らは、これまでに微小構造体を使った幹細胞の分化パターン解析法を開発してきました注1)。また、田中陽チームリーダーらは、心臓を構成する心筋細胞を培養すると、心臓と同じように自律的に拍動するため、これを動力源として利用することを提案しています注2)。今回は、心筋細胞と微小構造体とを組み合わせて細胞培養するとどのような現象が起こるか、またその利用法について研究を進めました。
注1)2017年4月6日プレスリリース「「どこでも微小構造体」で幹細胞の分化パターンを解析」
注2)Yo Tanaka, Keisuke Morishima, Tatsuya Shimizu, Akihiko Kikuchi, Masayuki Yamato, Teruo Okano and Takehiko Kitamori, Demonstration of a PDMS-based bio-microactuator using cultured cardiomyocytes to drive polymer micropillars, Lab Chip, 6, 230-235, 2006.
研究手法と成果
国際共同研究チームはまず、細胞を小さな空間に閉じ込めて培養を行うために、フォトリソグラフィ[3]と呼ばれる半導体製造でも利用される技術を使って、幅0.05mmから0.8mm、深さ0.1mmから0.8mmの微小溝を有するシリコーンゴム製シートを作製しました(図1A)。この微小溝シートを培養皿の中に置き、ラットの心筋細胞(大きさ約0.02mm)を培養液の中で7日間培養しました(図1B)。すると、個々の心筋細胞が自然と寄り集まって、一つの大きな組織を作り、微小溝の側面と側面をつなぐ様子が観察されました(図1C)。
研究チームは、この組織を「心筋ブリッジ」と名付け、その特性を解析しました。その結果、心筋ブリッジは、心筋細胞を微小溝シートで単に培養するだけで生じる自発的な現象であり、深すぎる溝(深さ0.8mm)の場合を除いて、細胞の大きさの10倍に相当する幅0.2mmぐらいの微小溝で、最も多数の心筋ブリッジができることが分かりました。
次に、心筋ブリッジの動きを解析しました。まず、シリコーンゴム製シート上に、厚み0.05mm、長さ0.2mm、高さ0.15mmの2本のシリコーンゴム製の微小柱を内幅0.15mmで並べた構造体を作製しました(図2A)。そして、微小溝シートのときと同様にラットの心筋細胞を培養したところ、心筋細胞が寄り集まって2本の微小柱をつなぐ心筋ブリッジができました(図2B)。心筋細胞は、通常培養すると自律的に拍動することが知られていますが、微小柱をつなぐ心筋ブリッジも自律的に拍動することが確認できました。
また、微小柱は柔らかいため、心筋ブリッジの拍動によって、およそ10秒間に5回ほどの頻度で内側にたわむ様子も確認できました(図2C,D)。微小柱の大きさや柔らかさ、変形量から、心筋ブリッジの収縮力はおよそ15マイクロニュートン(μN、1μNは100万分の1ニュートン。心筋ブリッジの収縮力は、蚊1匹にかかる重力におおよそ相当する)と見積もられました。このことは、心筋ブリッジが培養液に含まれる栄養素をもとに、収縮力を発揮し、微小柱を変形させるという外部に対する仕事をしたといえます。
2本の微小柱が内側にたわむと、その間を満たしている培養液が押し出されます。このことから、微小柱をつなぐ心筋ブリッジの収縮を利用することで、培養液を動かすポンプのような機能が実現できると考えました。そこで、培養液中に蛍光ビーズを浮遊させ、その動きを追跡・解析しました。その結果、微小柱の中間付近の最も流れが大きくなると考えられる地点で、心筋ブリッジの収縮に合わせて蛍光ビーズがおよそ2マイクロメートル(μm、1μmは1,000分の1mm)移動する様子が観察されました(図3)。これは、約0.01ナノリットル(nL、1nLは100万分の1mL。0.01nLはインクジェットプリンターから滴下される数ドット分のインク量に相当する)の培養液の移動に相当します。このことから、心筋ブリッジの収縮と微小な構造体をうまく組み合わせることで、生物的エネルギー源を液体の流れという機械的エネルギーに変換する機能を実現できることが分かりました。
今後の期待
今回培養したラット心筋細胞は、さまざまな化学物質の安全性をチェックする際の心毒性試験や、新しい薬を開発する際の薬効試験に利用されています。このような場面において、個々の細胞ではなく心筋ブリッジという組織を使い、周りの培養液の動きを高感度カメラで捉え、拍動を定量的に評価することによって、より実際の心臓機能に近い状態で心毒性試験や薬効試験を実施できる可能性があります。特に近年、iPS細胞[4]などの幹細胞から心筋細胞を作製する技術が開発されています。iPS細胞由来の心筋細胞から心筋ブリッジを作製することで、臨床試験の負担を軽減し、心疾患の解明につながる実験プラットフォームへの展開が期待できます。
また、技術の進歩により微小構造体の作製が容易になってきましたが、動力源を内蔵することが技術的な課題です。今回、心筋細胞が微小環境において自発的に組織を形成する心筋ブリッジ現象が確認でき、柔らかい構造体であれば心筋ブリッジの収縮によって動かすことができました。将来、微細な弁のような構造と組み合わせることができれば、生物的エネルギー源のみによって動く極めて微小なポンプ、いわゆる“マイクロ心臓”の実現も期待できます。
今後、心筋ブリッジ現象のさらなる解明によって、効果的に心筋ブリッジを誘導することができれば、心臓や筋肉の発生そして機能発現を理解するための基礎研究に貢献すると期待できます。
原論文情報
- Nobuyuki Tanaka, Tadahiro Yamashita, Yaxiaer Yalikun, Satoshi Amaya, Asako Sato, Viola Vogel, and Yo Tanaka, "An ultra-small fluid oscillation unit for pumping driven by self-organized three-dimensional bridging of pulsatile cardiomyocytes on elastic micro-piers", Sensors and Actuators B: Chemical, 10.1016/j.snb.2019.04.087
発表者
理化学研究所
生命機能科学研究センター 集積バイオデバイス研究チーム
チームリーダー 田中 陽(たなか よう)
研究員 田中 信行(たなか のぶゆき)
慶應義塾大学 理工学部
助教 山下 忠紘(やました ただひろ)
スイス連邦工科大学チューリッヒ校 健康科学技術学部
教授 ヴィオラ・フォーゲル(Viola Vogel)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
補足説明
- 1.心毒性
薬物が心臓に与える急性あるいは慢性の悪影響。不整脈、心筋炎、うっ血性心不全など、さまざまなものが知られている。 - 2.シリコーンゴム
シリコーンを主成分とする樹脂。液体の状態に触媒を加えると、シリコーンの重合反応により硬化し、ゴム状になる。 - 3.フォトリソグラフィ
感光性物質を表面に薄膜塗布し、露光する部分としない部分で微細な回路などを描き出す半導体加工技術。本研究ではこの技術によって鋳型となる微小な凹凸を作製し、そこにシリコーンゴムを流し入れて、固め、微細構造を作り出している。 - 4.iPS細胞
脊椎動物の初期胚が持つ、全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。iPS細胞(人工多能性幹細胞)は、皮膚や血液などから採取した細胞に少数の遺伝子などを導入して作製された多能性幹細胞である。iPSはinduced Pluripotent Stemの略。
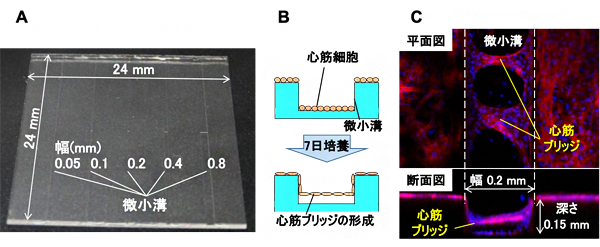
図1 微小溝シートを用いた細胞培養と心筋ブリッジの顕微鏡画像
A:シリコーンゴム製微小溝シート。ここでは、24mm四方のシートに、幅0.05~0.8mm、深さ0.1~0.15mmの微小溝が刻まれている。
B:培養の流れ。Aのシートを培養皿に入れて、ラットの心筋細胞を7日間培養する。
C:形成された心筋ブリッジの蛍光顕微鏡画像。心筋細胞に含まれるアクチン繊維を鮮紅色に、細胞核を青色に蛍光染色した。
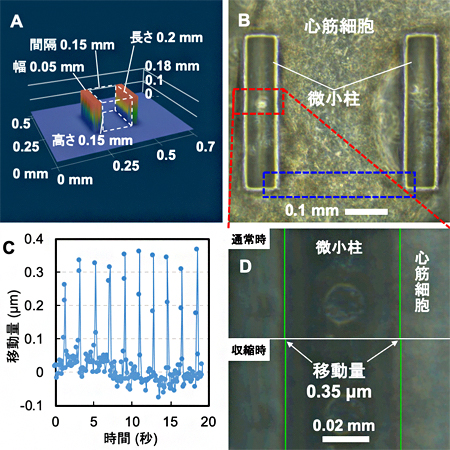
図2 微小柱を使った心筋ブリッジの動き解析
A:2本の微小柱を並べたシリコーンゴム製シートのサイズ。
B:Aのシートを培養皿に入れ、ラットの心筋細胞を培養した結果、得られた心筋ブリッジの顕微鏡写真。赤の破線の枠内は図2Dで観察している領域。青の破線の枠内は図3で観察している領域。
C:心筋ブリッジによって、微小柱が内側にたわむ様子を移動量と時間で示したグラフ。約10秒間に5回たわんだことが分かる。
D:心筋ブリッジの通常時と収縮時における微小柱の位置のずれから、移動量を計測した。微小柱は内側に0.35μm移動した。
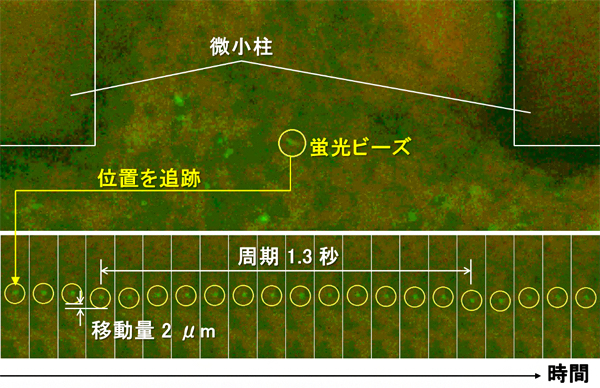
図3 微小柱の間の培養液の流れ
培養液に蛍光ビーズを浮遊させ、動きを追った結果。画像は、図2Bの青破線の枠内と同じである。心筋ブリッジの動きに合わせて、蛍光ビーズが周期1.3秒で2μm上側に移動し、ふたたび元に戻ってくることが分かった。
