2017年4月6日
理化学研究所
スイス連邦工科大学チューリッヒ校
「どこでも微小構造体」で幹細胞の分化パターンを解析
-コンピュータの目が解析作業をお手伝い-
要旨
理化学研究所(理研)生命システム研究センター集積バイオデバイス研究ユニットの田中信行研究員、佐藤麻子テクニカルスタッフⅡ、田中陽ユニットリーダーとスイス連邦工科大学チューリッヒ校の山下忠紘博士研究員らの国際共同研究チーム※は、ヒト間葉系幹細胞(MSC)が微小領域に閉じ込められた際に生じる分化パターンを簡便かつ効率的に解析する手法を開発しました。
ヒトMSCは、骨髄や脂肪組織などに含まれる幹細胞[1]の一種です。培養条件によって骨や脂肪など幅広い細胞に分化誘導できるため、再生医療への応用も期待されています。また、周囲の環境によって分化プロセスが調節される性質があり、例えば、細胞を微小領域に制限して培養・分化誘導を行うと、空間的に種類の異なる細胞分化パターンが出現します。このような空間的制限と細胞分化プロセスとの関係性は、組織・臓器の再生過程や多細胞システムがどのように形作られるのかを理解する上で欠かせません。細胞の培養領域を制限する手法としては、細胞が接着しやすいタンパク質をインクとして、判子のような微小な凹凸構造を持つスタンプに塗布し、これを細胞培養皿に接触させることによりタンパク質を培養皿表面に転写するマイクロコンタクトプリンティングが主流でした。しかしこの方法では、きれいなタンパク質パターンを長期安定的に得ることが難しいという課題がありました。
今回、国際共同研究チームは、寒天の大部分を占めるアガロースでできた直径0.05~0.8mmの円形状微小構造体で培養皿表面の覆うことにより、細胞を多数の円形内に閉じ込めて培養することを考えました。アガロースは細胞が接着しにくい性質を持ち、生物学系の研究室ではどこでも簡単に手に入ります。ヒトMSCを微小構造体内で培養・分化誘導したところ、細胞集団の形状ごとの分化パターンの作製に成功しました。また分化パターンを定量的に解析するためには、多数の画像に対して、どの部分がどの細胞であるかを決定する必要があります。これに対して、あらかじめ切り出しておいた各種分化細胞の画像を使って機械学習し、学習結果に基づいて分化パターンを自動的に識別する解析手法を開発しました。この手法により、これまで研究者が目視で行っていた解析を「コンピュータの目」を使って飛躍的に省力化することに成功しました。
本手法は今後、生物学研究分野での幅広い応用展開が期待できます。
本成果は、オープンアクセスの科学雑誌『PLOS ONE』オンライン版(4月5日付け、日本時間4月6日)に掲載されます。
本研究は、日本学術振興会二国間交流事業の支援を受けて実施されたものです。
※国際共同研究チーム
理化学研究所 生命システム研究センター 集積バイオデバイス研究ユニット
研究員 田中 信行(たなか のぶゆき)
テクニカルスタッフⅡ 佐藤 麻子(さとう あさこ)
ユニットリーダー 田中 陽(たなか よう)
スイス連邦工科大学チューリッヒ校 健康科学技術学科
博士研究員 山下 忠紘(やました ただひろ)
教授 ヴィオラ・フォーゲル(Viola Vogel)
背景
多数の細胞からなる組織や臓器は、周囲の環境と相互作用しながら形作られていきます。個体発生における物質の空間的な濃度の違いが重要であるように、細胞集団の形状や周囲環境の硬さといった“機械的な特性”も、幹細胞の分化といった細胞運命を調節する重要な要因です。このような機械的な特性は、細胞接着から細胞骨格[2]などを介して細胞内の核にまで伝達され、結果として細胞の振る舞いを変化させる機械的情報伝達経路が存在します。機械的特性に起因する細胞の振る舞いを理解する場合、人為的に細胞集団の形状や周囲環境の硬さを精度よく制御した上で、細胞がどのように反応・変化するかなどを解析する必要があります。ここでは、細胞集団の形状に着目します。
従来、人為的に細胞集団の形状を制御するには、細胞の接着が、細胞外にあるタンパク質などの複合体である細胞外マトリックスと細胞側のタンパク質との結合であることを利用し、細胞外マトリックスに含まれるフィブロネクチンなどのタンパク質のパターンを細胞培養皿表面に作製することが一般的でした。タンパク質パターンの作製では、タンパク質溶液をインクとして、判子のような微小な凹凸構造を持つスタンプに塗布し、これを細胞培養皿に接触させることによりタンパク質を培養皿表面に転写するマイクロコンタクトプリンティングを利用することが主流でした。しかしこの方法では、スタンプへのインク塗布量やスタンプと培養皿との接触力をうまく制御しなければ、例えば、押印の際に朱肉が染み出したり、不鮮明になったりするのと同様に、きれいなタンパク質パターンを安定的に得ることが難しいという課題がありました。
また、実験結果の解析にも課題がありました。実験では多数の顕微鏡画像から細胞集団の形状と細胞の振る舞いとの関係性を調査します。通常、細胞はほぼ透明ですが、細胞の種類を特定するマーカーが分かるように染色を行います。この染色結果をもとに顕微鏡画像に写っている細胞の種類を見分けますが、一般的に1枚の顕微鏡画像の中には、数百から数千の細胞が含まれており、これらを目視で見分けるには、多大な労力が必要でした。
ヒト間葉系幹細胞(MSC)は、骨髄や脂肪組織などに含まれる幹細胞の一種です。培養条件によって骨や脂肪など幅広い細胞に分化誘導できるため、再生医療への応用も期待されています。今回、国際共同研究チームはヒトMSCを用いて、研究を進めました。
研究手法と成果
国際共同研究チームは細胞集団の形状を制御する方法として、アガロースの微小構造体を使って細胞に対する壁を設けることにしました。アガロースは海藻から作られる寒天を精製したもので、タンパク質などの吸着が少ないため細胞が接着しにくく、また動物細胞は消化できないため長期安定性にも優れています。また、生物学系の研究室ではどこでも簡単に手に入る身近な材料です。
アガロース微小構造体の作製には、鋳造の手法を応用しました。これは、微細な凹凸構造をもつ鋳型を細胞培養皿に載せ、鋳型に開けられた注入口からアガロース水溶液を注入し、固化した後に鋳型を取り外すことで、培養皿に微小構造体を形成するものです(図1)。今回は、一つの鋳型の中に直径0.05~0.8mm、高さ約5マイクロメール(μm、1μmは1,000分の1mm)の円形状パターンを数百個集積し、一つの培養皿の中で多数の条件を一度に調査できるように工夫しました(図2)。
続いて、アガロース微小構造体を成型した細胞培養皿上でヒトMSCの培養と分化誘導を行いました。細胞培養皿ごとに培養液の種類を、増殖培地、脂肪分化培地、骨分化培地、脂肪分化と骨分化の培地を等量で混合した培地(脂肪-骨分化培地)に変え、細胞集団の形状ごとの分化パターンを解析しました。その結果、培養開始後1日で細胞がアガロース微小構造体に囲まれた細胞培養皿表面に接着する様子が観察されました。その後15日間にわたって、細胞集団の形状を維持したまま培養・分化誘導を継続することができました。また最終的に、脂肪-骨分化混合培地では、構造体の境界付近と中央部で細胞の種類が異なる細胞分化パターンが表れました(図3)。これはタンパク質パターンを用いなくても、身近なアガロースを用いた微小構造体を利用することで細胞分化パターンができることを意味しています。
さらに、このような実験結果の画像を50枚以上取得し、細胞分化パターンの空間分布を調査しました。この作業を効率的に行うために、オープンソースのライブラリを活用して、機械学習を利用した画像処理プログラムを独自に作成し自動解析を実施しました(図4)。その結果、通常目視であれば何十分もかかるような識別作業を、一般的なラップトップコンピュータでも1分程度で済ませることができました。また、人間は疲労などによって解析結果が変わってしてしまうこともありますが、コンピュータでは識別基準が変わらないので大量の画像であっても解析結果が一定であることも利点です。
今後の期待
今回利用したアガロースは、生物学系の研究室においてDNAやRNAなどの核酸を分子量に応じて分離するアガロースゲル電気泳動[3]などで多用します。このため、身近で取り扱いやすい材料で実験できることは本成果の大きな利点です。また一度、鋳型を手に入れれば、繰り返し安価なアガロースを使って微小構造体を作製できます。そのため、幹細胞の分化だけにとどまらず、単一細胞を整列させて逐次観察するなど、世界中どこでも実施できる技術として、生物学研究分野での幅広い応用展開が期待できます。
さらに、本研究で作成した機械学習を利用した画像処理プログラムは、オープンソースソフトウェアとして公開されます。大量の画像処理や解析に苦労する研究者は多く、自由に利用できるソフトウェアはその手助けになると考えられます。またソースコードを公開することで、ソフトウェアへ独自機能を組み込むなどのさらなる利用も期待できます。
原論文情報
- Nobuyuki Tanaka, Tadahiro Yamashita, Asako Sato, Viola Vogel, and Yo Tanaka, "Simple agarose micro-confinement array and machine-learning-based classification for analyzing the patterned differentiation of mesenchymal stem cells", PLOS ONE, doi: 10.1371/journal.pone.0173647
発表者
理化学研究所
生命システム研究センター 細胞デザインコア 合成生物学研究グループ 集積バイオデバイス研究ユニット
研究員 田中 信行(たなか のぶゆき)
テクニカルスタッフⅡ 佐藤 麻子(さとう あさこ)
ユニットリーダー 田中 陽(たなか よう)
スイス連邦工科大学チューリッヒ校 健康科学技術学科
博士研究員 山下 忠紘(やました ただひろ)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部お問い合わせフォーム
補足説明
- 1.幹細胞
発生や組織・器官・臓器の再生・維持の過程で、細胞を作るもととなる母細胞のこと。体のさまざまな細胞に分化する力と自分と同じ幹細胞を作る力の両方を持つ。 - 2.細胞骨格
細胞内に張り巡らされている繊維状の構造の総称。アクチンや微小管などがその代表。細胞の運動、分裂などさまざまな機能を担っている。 - 3.アガロースゲル電気泳動
核酸(DNAやRNA)の分子は負に帯電しており、溶液に電圧をかけると陽極(+)側に移動する。これをアガロースゲルの中で行うと、分子の小さいもの(短い核酸)ほど遠くまで流れやすいため、特定の長さの核酸の分離や検出に用いられる。
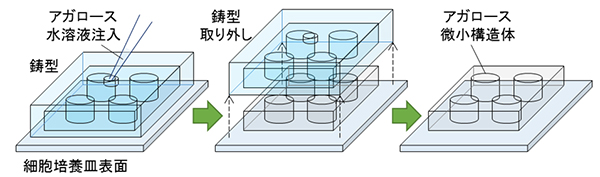
図1 アガロース微小構造体の作製
微細な凹凸構造を持つ鋳型を細胞培養皿に載せ、鋳型に開けられた注入口からアガロース水溶液を注入する(左)。アガロースが固化した後に鋳型を取り外す(中)。培養皿にアガロース微小構造体が形成される(右)。
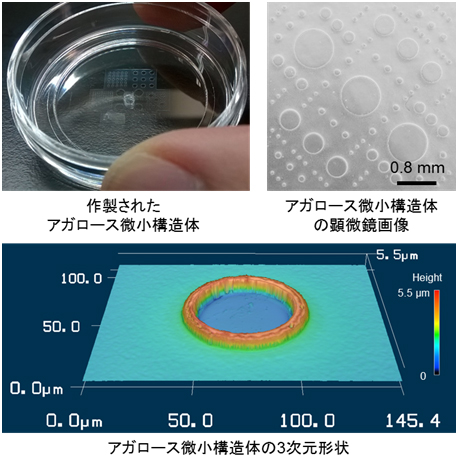
図2 細胞培養皿表面に成型されたアガロース微小構造体
一つの鋳型の中に、直径0.05~0.8mm、高さ約5.5μmの円形状パターン(アガロース微小構造体)を数百個作製した。
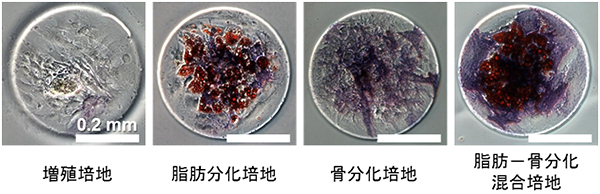
図3 直径0.4mm領域に制限し培養・分化誘導を行った場合のヒト間葉系幹細胞の染色画像
4種類の培養条件でヒトMSCを分化誘導した15日目の画像。赤色が脂肪分化、青色が骨分化を表す。脂肪-骨分化混合培地では、構造体の境界付近では骨分化パターン、中央部では脂肪分化パターンがみられる。
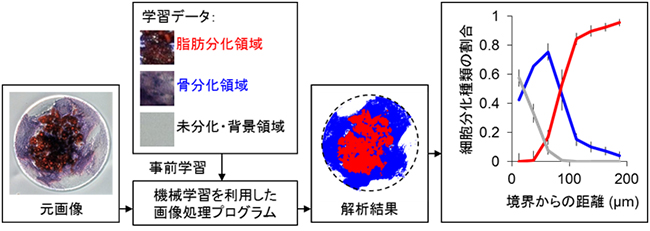
図4 機械学習を利用した細胞分化パターンの識別と細胞分化種類の空間分布
専門家が選択した画像を元に機械学習を行い、顕微鏡画像に含まれる分化パターンの識別を自動的に行う。その後、境界からの距離と細胞分化種類の割合との関係を定量的に調査した。
