理化学研究所(理研)生命機能科学研究センター 一細胞質量分析研究チームの川井隆之研究員、集積バイオデバイス研究チームの太田亘俊研究員、田中陽チームリーダーらの研究チームは、単一細胞という超微量の生体試料から代謝物[1]を網羅的に計測する超高感度メタボローム分析法[2]を開発しました。
本研究成果は、これまで解析が難しかった微量のがん細胞などを対象とした次世代病理診断や薬効評価などへの応用が期待できます。
今回、研究チームは、高性能なメタボローム分析法として知られる「キャピラリー電気泳動[3]-質量分析[4](CE-MS)分析法[5]」において、従来法と比べて最大3.5倍の高感度で検出可能な「nanoCESI法」を開発し、さらに代謝物を高効率に濃縮する「LDIS法[6]」と組み合わせることで、検出下限濃度450フェムトモーラー(fM、1fMは1,000兆分の1モーラー)という、従来法の約800倍の超高感度を実現しました。この濃度は、東京ドーム40杯分の水に対して、うま味調味料(グルタミン酸ナトリウム)小さじ1杯分に相当します。この技術を用いて、これまで解析が難しかった一般的なヒト培養細胞(HeLa細胞)1個から抽出された40種類の代謝物を、網羅的かつ定量的に検出することに初めて成功しました。
本研究は、国際科学雑誌『Analytical Chemistry』オンライン版(7月30日付)に掲載されます。
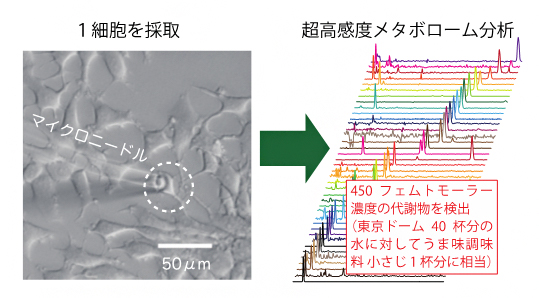
図 わずか1個の細胞から40種類の代謝物を同定することに成功
※研究チーム
理化学研究所 生命機能科学研究センター
一細胞質量分析研究チーム
研究員 川井 隆之(かわい たかゆき)
研究パートタイマー 岡田 かおり(おかだ かおり)
研究パートタイマー 今里 亜貴子(いまさと あきこ)
研究パートタイマー 森田 牧子(もりた まきこ)
研究パートタイマー 夛田 美沙(ただ みさ)
集積バイオデバイス研究チーム
研究員 太田 亘俊(おおた のぶとし)
研究パートタイマー(研究当時) 小和 百合(おわ ゆり)
チームリーダー 田中 陽(たなか よう)
※研究支援
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業さきがけ「超高感度CE-MS分析システムによる極微量プロテオーム解析 (研究代表者: 川井隆之)」などによる支援を受けて行われました。
背景
代謝物とは、生命活動における代謝過程において産生される中間生成物、もしくは最終生成物のことで、主にアミノ酸や有機酸、アミン類などの低分子化合物が知られています。特定の細胞や組織、個体での代謝物の種類や濃度を集約した情報(代謝物プロファイル)は、その瞬間の生命活動を直接的に反映していると考えられます。そのため、代謝物を網羅的に解析する「メタボローム分析」により、生命活動の様子を詳細に解析できます。例えば、細胞ががん化などで病変する際には、解糖系[7]が亢進し、代謝物プロファイルが大きく変化する「ワールブルク効果[7]」が知られています。
このような代謝動態を細胞1個1個で知ることができれば、複雑な細胞の集合体である生命の謎を解き明かす第一歩になると考えられます。また、疾患特異的な代謝を発見してその経路を標的とする医薬品を開発できれば、これまでよりも副作用が少なく効果の高い画期的な治療が実現できると期待されています。
高性能なメタボローム分析法として、「キャピラリー電気泳動-質量分析(CE-MS)分析法」が知られています。CE-MS分析法は、電気泳動で分離した代謝物を順次エレクトロスプレーイオン化(ESI)法[8]によってイオン化して質量分析法で検出する手法で、定性能と定量性を両立できる優れた分析手法です。しかし、従来のCE-MS分析法では最低でも1万細胞以上の試料が必要であり、特殊な巨大細胞を除いて、これまで1細胞メタボローム分析は実現していませんでした。
研究手法と成果
研究チームは、高性能なCE-MS分析法をさらに大幅に高感度化するため、まず従来のESI法を高効率化した「nanoCESI(Capillary Electrophoresis Sheathless Ionization)法」の開発を行いました。開発にあたって、電気泳動での分離に用いる溶融石英製のキャピラリーの先端部分(エミッター)15mm程度をフッ酸やCO2レーザーなどで加工し、壁厚が10マイクロメートル(μm、1μmは100万分の1メートル)程度で先端径が5~10μmと薄く尖った構造物を作製しました(図1)。これにより、先端から吐出される液滴の初期サイズが小さくなり、さらに先端に電界が収束することから、高効率で安定したエレクトロスプレーを形成できます。こうして開発したnanoCESIエミッターを用いて、20種類のアミノ酸それぞれの検出感度を調べたところ、従来のESI法と比較して最大で3.5倍の高感度で検出できることが分かりました。
次に、nanoCESIエミッターを用いたCE-MS分析により、20種類のアミノ酸混合溶液からそれぞれのアミノ酸の種類と濃度を識別できるかを確認しました。分析の結果、全てのアミノ酸を分離し、高感度で検出することに成功しました(図2)。先端が尖っているnanoCESIでは、微小なゴミで閉塞することなく、50回以上の分析を再現よく行うことができました。検出下限の濃度は、リジンの170ピコモーラー(pM、1pMは1兆分の1モーラー=10-12モーラー)、絶対量にして約50万分子に相当する850ゼプトモル(zmol、1zmolは10垓分の1モル=10-21モル)と、極めて良好でした。
さらなる高感度化のために、代謝物をキャピラリー内部で濃縮するLDIS法の適用を検討しました。LDIS法は、キャピラリー内部で試料をニつの異なる原理に基づいて2回濃縮することで、分離性能を損なうことなく高感度化を行う手法であり注)、濃縮のために必要な泳動液はアウトレット側(試料の移動方向側)から引き込みます。一方、CE-MSのアウトレット側(キャピラリー先端)はエレクトロスプレーの形成に特化しており、そのままではLDIS法を適用できません。
そこで、泳動液を引き込めるように、キャピラリー先端に液滴を供給することで、LDIS法をCE-MSに適用しました(図3-3)。これにより、分離性能を損なうことなく、濃縮を適用しないときと比べて最大で380倍もの高感度化に成功しました。最終的に、LDIS法とnanoCESI法とを組み合わせることで、従来法と比較して最大で800倍の高感度化を達成し、検出下限の濃度は最高で450フェムトモーラー(fM、1fMは1,000兆分の1モーラー=10-15モーラー)と極めて良好でした。この濃度は、東京ドーム40杯分の水に対して、うま味調味料(グルタミン酸ナトリウム)小さじ1杯分に相当します。
図3に示すように、本手法を用いた1細胞のメタボローム解析の手順は、①マイクロマニピュレーターでマイクロニードルを精密に制御し、1細胞を採取(図3-1)、②細胞をチューブに取り出し、細胞を溶解して代謝物を抽出(図3-2)、③代謝物をキャピラリーに導入後、キャピラリー先端に液滴を供給、④LDISによる濃縮・分離(図3-3)、nanoCESI法による質量分析(図3-4)の4段階です。
本手法の実証実験として、HeLa細胞(子宮頸がん由来培養細胞株)1細胞に含まれる20種類のアミノ酸を定量しました。その結果、各アミノ酸は2.2~32.7フェムトモル(fmol、1fmolは1,000兆分の1モル)程度含まれることが示され、極めて微量の代謝物を正確に定量できることが示されました。
続いて、HeLa細胞1個に含まれる代謝物の網羅解析を行ったところ、450種類の代謝物ピークを検出し、そのうち40種類について分子同定を行うことに成功しました(図4)。この中には、従来の分析法では検出できなかった酸化ストレス[9]マーカーである酸化型グルタチオン[10]など、さまざまな重要代謝物が含まれており、1細胞ごとの代謝状態が把握できると考えられます。
注)2018年7月26日プレスリリース「超微量糖鎖分析法を開発」
今後の期待
今回、1細胞という極微量の生体試料であっても、十分な感度で代謝物の網羅的解析が可能であることが実証されました。今後、nanoCESI法やLDIS法で検出できる代謝物ピークと化合物の対応データベースを拡充していくことにより、より多くの代謝物を同定できるようになると考えられます。さらに、病理切片に含まれる重要な疾患細胞や、血液試料にごく僅かに含まれる疾患細胞などから代謝物プロファイルを取得し、その代謝動態を解明することで、新たな診断法や治療薬の開発につながると期待できます。
また、今回開発した一連の分析法は、代謝物のみならずタンパク質など他のさまざまな生体関連物質も効率的に濃縮して分析できる手法です。細胞1個1個のあらゆる生体分子を網羅的に解析することで、新たな生命現象の解明、疾患メカニズムの解明など、医療・創薬に限らずあらゆる生命科学研究への貢献が期待できます。
原論文情報
- Takayuki Kawai, Nobutoshi Ota, Kaori Okada, Akiko Imasato, Yuri Owa, Makiko Morita, Misa Tada, and Yo Tanaka, "Ultra-sensitive Single Cell Metabolomics by Capillary Electrophoresis-Mass Spectrometry with a Thin-walled Tapered Emitter and Large-volume Dual Sample Preconcentration", Analytical Chemistry, 10.1021/acs.analchem.9b01578
発表者
理化学研究所
生命機能科学研究センター 一細胞質量分析研究チーム
研究員 川井 隆之(かわい たかゆき)
生命機能科学研究センター 集積バイオデバイス研究チーム
研究員 太田 亘俊(おおた のぶとし)
チームリーダー 田中 陽(たなか よう)
 川井 隆之
川井 隆之
 太田 亘俊
太田 亘俊
 田中 陽
田中 陽
お問い合わせ先
理化学研究所 生命機能科学研究センター センター長室 報道担当
山岸 敦(やまぎし あつし)
Tel: 078-306-3095 / Fax: 078-306-3090
※上記の[at]は@に置き換えてください。
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
補足説明
- 1.代謝物
酵素などの働きにより、生体内で合成・分解された化合物。中間生成物もしくは最終生成物のどちらも指す。 - 2.メタボローム分析
代謝物を網羅的に解析する手法。現状では、検出法の限界により計測可能な代謝物の種類や感度が限られてしまうことが多く、技術的課題となっている。 - 3.キャピラリー電気泳動(CE)
内径数十μm、外径数百μm、全長数十cm程度の石英ガラス細管に、数万ボルト程度の高電圧をかけることで、電荷を持った分子を分離する手法。分離分析法として有名な液体クロマトグラフィー法と比べて高い分離性能、少ない試料消費量などの利点がある。CEはCapillary Electrophoresisの略。 - 4.質量分析(MS)
試料に含まれる分子の分子量を測定する装置。試料をイオン化して高真空の装置内部に導入し、そのイオン化分子の質量ごとに電磁気的に分離して検出する。MSはMass Spectrometryの略。 - 5.キャピラリー電気泳動-質量分析(CE-MS)分析法
キャピラリー電気泳動で分離した試料を順次エレクトロスプレーイオン化法によってイオン化し、質量分析で分析する方法。分離により各試料を精製して導入できるため、試料間でのイオン化の干渉を抑制することができ、定量性と定性能を両立した高性能なメタボローム分析を実現できる。CE-MSはCapillary Electrophoresis-Mass Spectrometryの略。 - 6.LDIS法
キャピラリー内部において、電場増強スタッキング法と過渡的等速電気泳動と呼ばれる2種類の濃縮法を用いて試料を高効率に濃縮する手法。従来の濃縮法では難しかった、高感度・高耐塩濃度・高分離能を全て満たす次世代濃縮法。LDISはLarge-volume Dual preconcentration by Isotachophoresis and Stackingの略。 - 7.解糖系、ワールブルグ効果
細胞はグルコースを代謝(分解)して、ATPを産生する。この一連の反応のうち、酸素を必要としない経路を解糖系と呼び、生物の持つ最も基本的な代謝経路の一つである。好気呼吸を行う生物は、解糖系で生じた代謝物を利用してさらにATP産生を行うが、がん細胞は有酸素下でも解糖系でのATP産生を促進することが知られている。この現象は、発見者のオットー・ワールブルグにちなんでワールブルグ効果と呼ばれる。 - 8.エレクトロスプレーイオン化(ESI)法
ニードルに高電圧をかけた状態で試料を吐出すると、帯電した液滴が霧状に噴出され(エレクトロスプレー)、最終的に試料に含まれる分子に主にプロトン(H+)が付加されてイオン化される手法。初期液滴が小さい程感度が向上することから、ニードルの先端径を小さくすることで高感度化できる。ESIはElectroSpray Ionizationの略。 - 9.酸化ストレス
生体内で酸化還元状態の均衡が崩れたとき、過酸化水素やヒドロキシラジカルを代表とする活性酸素が生産される。これらが生体内のタンパク質、脂質、核酸などと反応し、生体にダメージを与えることから、さまざまな疾患の原因となることが知られている。 - 10.酸化型グルタチオン
細胞が酸化ストレスに暴露した際、細胞を保護するために還元型グルタチオンが酸化型グルタチオンへ酸化される。酸化型グルタチオンの量を計測することで、この酸化ストレス状態を推定できると考えられている。

図1 新開発したnanoCESI法のためのエミッター
(a)に示すように、キャピラリー電気泳動による濃縮・分離を行うキャピラリーカラムの内径は50μm、エレクトロスプレーを噴出する開口部の先端径は5~10μmを実現した。(b)と(c)はその拡大写真。
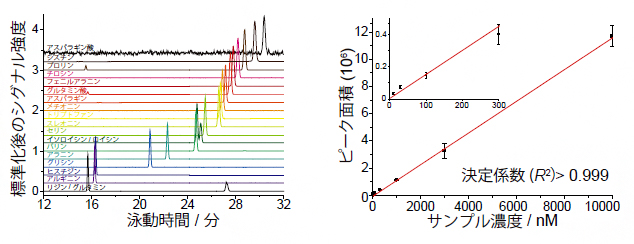
図2 nanoCESI法を用いた20種類のアミノ酸分析結果
- 左) 20種類のアミノ酸の泳動時間と検出ピークの関係。それぞれ異なった特徴を持ち、互いに分別可能であることが示された。
- 右) アミノ酸の一つセリンについて、検量線を用いて定量分析を行った。質量分析では、ピークの高さ(ピーク面積)は成分濃度に比例する性質があり、100nM以下の希薄濃度でも比例関係が保たれていることが分かる。なお、最も検出感度が高かったのはリジンの170pMであった。
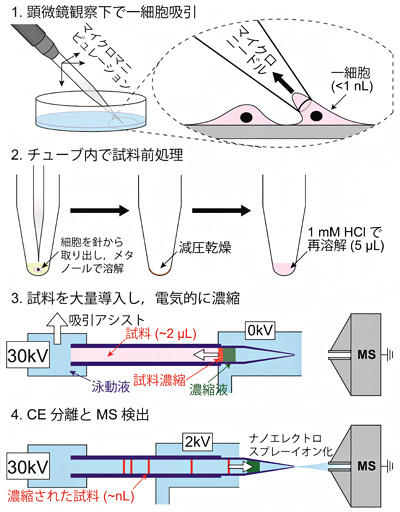
図3 1細胞メタボローム分析の手順
- 1. マイクロマニピュレーターでマイクロニードルを精密に制御し、1細胞を採取する。
- 2. 細胞をチューブに取り出し、細胞を溶解・乾燥して代謝物を抽出する。
- 3. 代謝物をキャピラリーに導入後、キャピラリー先端に液滴を供給する。
- 4. LDIS法により濃縮・分離された代謝物を、nanoCESIエミッターを用いてエレクトロスプレーイオン化し、質量分析を行う。
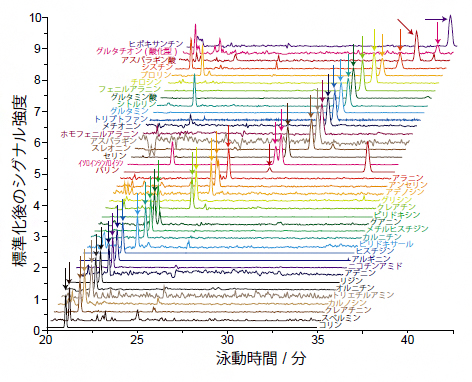
図4 1個のHeLa細胞から検出された40種類の代謝物
1細胞から抽出された代謝物の分析結果。検出されたピーク(矢印)の特徴から既存の化合物データベースを参照したところ、20種類のアミノ酸を含む40種類の化合物を同定できた。
