2019年11月29日
理化学研究所
慶應義塾大学医学部
DNAバーコーディングによるタンパク質のデジタル定量法
-より高感度なタンパク質定量が可能に-
理化学研究所(理研)生命医科学研究センター統合ゲノミクス研究チームの矢崎潤史上級研究員、小原收チームリーダー、理研生命機能科学研究センター 細胞システム動態予測研究チームの城口克之チームリーダー、慶應義塾大学医学部の天谷雅行教授らの共同研究グループは、新しいタンパク質標識法である「タンパク質-DNA複合体作製法(ハロタグ[1]タンパク質バーコーディング法)」を開発し、次世代シーケンサー[2]を用いたタンパク質の定量に成功しました。
本研究成果は、医療基礎科学、特に医療プロテオミクス[3]研究に影響を与え、高精度な予防医学に貢献すると期待できます。
今回、共同研究グループは、クリックケミストリー反応[4]と結合タグタンパク質のハロタグを利用して、標的タンパク質にDNA分子を1対1で共有結合させてタンパク質-DNA複合体を作製し、この標的タンパク質に結合するタンパク質分子をDNAにより定量する新しいタンパク質標識法を開発しました。本手法は、従来のルシフェラーゼ法[5]よりも100~1000倍以上高い感度を持ち、既報のタンパク質-タンパク質間相互作用の再現にも成功しました。また、自己免疫疾患[6]の一つである天疱瘡症[7]の抗原であるデスモグレイン3を用いた抗デスモグレイン3抗体の検出では、従来のELISA法[8]の100倍以上の感度を示しました。
本研究は、英国の科学雑誌『Nucleic Acids Research』のオンライン版(11月22日付:日本時間11月22日)に掲載されました。
背景
生物の染色体上には、役割が不明な遺伝子が多数存在します。それら遺伝子の機能を解明する主な方法の一つが、遺伝子から作られるタンパク質の機能プロファイリングです。タンパク質の機能プロファイリングは基礎生物学にとって大切なだけでなく、例えば自己免疫疾患患者の血液中に存在する抗体の測定など医療現場での診断においても重要です。異なるタンパク質同士の相互作用に基づいたタンパク質の検出法にはELISA法、質量分析を用いた親和性測定[9]、タンパク質アレイ[10]を用いた測定などがあり、これらは疾患のバイオマーカー候補の探索にも用いられています。
近年、世界中でゲノム情報解析に盛んに利用されている次世代シーケンサーは、タンパク質測定においても使用され始めています。次世代シーケンサーを用いると少量のDNAを容易に検出できますが、DNAの増幅に偏りがあるという問題がありました。これを解決するために、計測対象のDNA分子の一つ一つに、それぞれ異なる配列を持つDNA分子(DNAバーコード)を付加する「DNA分子バーコーディング法[11]」が開発されました。
次世代シーケンサーを用いたタンパク質の測定では、タンパク質分子にDNA分子を連結した「タンパク質-DNA複合体」が標識として用いられ、抗体測定や細胞イメージングなどに利用されています。タンパク質-DNA複合体は、一般的には試料のタンパク質と相互作用する標的タンパク質とDNAをpH依存的にアミド化反応で結合させて作製されますが、反応に毒性があるという問題があります。一方で、最近多くの生物学分野で急速に進展しているクリックケミストリー反応を利用した結合反応は、pHに依存しない、反応に毒性がないなどの長所があります。
そこで、共同研究グループは、クリックケミストリー反応と結合タグタンパク質の「ハロタグ」を利用した新しいタンパク質標識法の開発を試みました。
研究手法と成果
共同研究グループは、東京医科歯科大学の細谷孝充教授らが開発した新しいハロタグ結合分子(以下ハロタグリガンド[12])注1)と理研の城口克之チームリーダーらが開発したDNA分子バーコード注2)を用いて、新しいタンパク質標識法である「タンパク質-DNA複合体作製法(ハロタグタンパク質バーコーディング法)」を開発しました。
まず、アジド化ハロタグリガンドとアルキン化DNAバーコードをクイックケミストリー反応によって結合させ、ハロタグリガンドとDNAバーコードが連結した「DNAバーコード-リガンド複合体」を生成します。次に、標的タンパク質をハロタグと融合させ、「ハロタグ標的タンパク質」を生成します。このハロタグ標的タンパク質とDNAバーコード-リガンド複合体を共有結合させて、標的タンパク質とDNAバーコードが連結した「バーコード化標的タンパク質」を生成します。標的タンパク質は、試料中の調査対象となるタンパク質と相互作用しやすいものが選ばれます。ここまでがハロタグタンパク質バーコーディング法です(図1)。
次に、例えば自己抗体[13]を含む患者血清といった試料に含まれるタンパク質(自己抗体や病気由来の抗体)の量を測るために、バーコード化標的タンパク質と試料中のタンパク質を相互作用させることで、対象のタンパク質を捕捉し、その数を次世代シーケンサーで定量します(図1)。
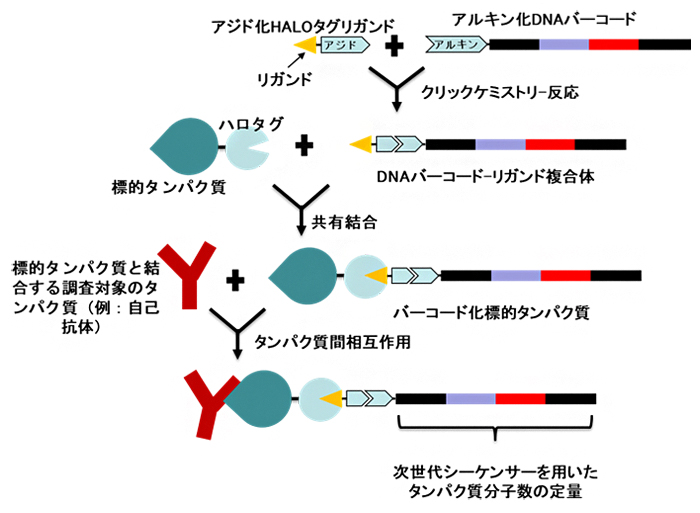
図1 ハロタグタンパク質バーコーディング法によるタンパク質定量
- (a)ハロタグタンパク質バーコーディング法。まず、ハロタグがアジド化されたアジド化ハロタグリガンドとDNA分子バーコードがアルキン化されたアルキン化DNAバーコードをクリックケミストリー反応により結合させて、「DNAバーコード-リガンド複合体」を生成する。それを、標的タンパク質に融合したハロタグタンパク質と共有結合させて、「バーコード化標的タンパク質」を生成する。
- (b)タンパク質の定量。標的タンパク質と相互作用する調査対象のタンパク質を含む試料(例:自己抗体を含む患者血清)とバーコード化標的タンパク質を相互作用させ、対象のタンパク質(例:自己抗体、病気由来の抗体)を捕捉し、その数を次世代シーケンサーで定量する。
ハロタグタンパク質バーコーディング法は、他の主要なタンパク質標識法と比べてさまざまな点で有利です。ビオチン-アビジン反応[14]により形成される結合では、一つのアビジンに対し最大4個までのビオチンが結合するため、たとえビオチンにDNAバーコードを結合させたとしても、標的タンパク質とDNAバーコードを1対1として数えることはできません。これに対して、ハロタグはハロタグリガンドが結合したDNAバーコードと1対1で共有結合するため、その結果生成するバーコード化標的タンパク質の数を容易に数えることができます。また、ビオチン-アビジンの大きさはハロタグ-ハロタグリガンドの約8倍もあるため、標的タンパク質が試料のタンパク質と相互作用する際の妨げになる可能性があります。
次に、ELISA法などの従来法では、高分子ビーズやプラスチック表面などの固相に標的タンパク質を結合させて対象のタンパク質を測定する必要がありました。しかし、本手法は水溶性条件で行うため、標的タンパク質は固相に妨げられることなく、タンパク質の折り畳みが行われ、対象のタンパク質と相互作用できるという長所もあります。
また、バーコード化標的タンパク質を用いて、化学発光物質によるタンパク質測定法であるルシフェラーゼ法と検出感度を比較したところ、標的タンパク質の種類にかかわらず100~1000倍以上の感度を示すことが分かりました。さらに、バーコード化標的タンパク質を用いて、既報のタンパク質-タンパク質間相互作用を調べた結果、報告されていた相互作用のうち約50%が再現されました。
最後に、実際の病気の患者血清を用いた抗原-抗体反応(タンパク質-タンパク質間相互作用の一種)実験を行いました。慶應義塾大学医学部の天谷雅行教授らが発見した自己免疫性水疱性疾患の一つである天疱瘡症の抗原であるデスモグレイン3タンパク質を標的タンパク質として用い、ハロタグタンパク質バーコーディング法でDNAを付加し、バーコード化デスモグレイン3を作製しました。これを用いて、天疱瘡症の患者血清から抗デスモグレイン3抗体の検出を行った結果、従来のELISA法よりも100倍以上の感度で検出できることが分かりました。
- 注1)Kii,I., Shiraishi,A., Hiramatsu,T., Matsushita,T., Uekusa,H., Yoshida,S., Yamamoto,M., Kudo,A., Hagiwara,M. and Hosoya,T. (2010) Strain-promoted double-click reaction for chemical modification of azido-biomolecules. Org. Biomol. Chem., 8, 4051-4055
- 注2)2017年10月19日プレスリリース「DNA分子バーコード法の新機能」
今後の期待
本研究では、ハロタグタンパク質バーコーディング法により感度の高いタンパク質測定を実現し、タンパク質-タンパク質間相互作用、抗原-抗体反応の検出を実際に行うことができました。将来的には、複数種の抗原を異なるDNAバーコードでラベルすることで、複数の異なる病気を区別し検出できるようになるかもしれません。
医療診断用に利用できるようにするには、どの程度の測定エラーがあるのかをこれまでの方法と多数のサンプルで比較する必要があります。
今後、さまざまな抗体のコレクションをDNAバーコーディングすることで、多様な種類の細胞やがんの特異性が同定され、病気の診断に貢献すると期待できます。
補足説明
- 1.ハロタグ
ハロタグタンパク質。ロドコッカス属バクテリアhaloalkane dehalogenaseの遺伝子を改変して得られるタンパク質。ハロタグリガンドと共有結合を形成する。 - 2.次世代シーケンサー
2005年ごろに米国で開発された、遺伝子情報を桁違いに大量・高速に検出できる装置。 - 3.医療プロテオミクス
医療現場において、例えば病気の診断などで用いられるタンパク質測定技術。 - 4.クリックケミストリー反応
化学分野において、新たな機能性分子を簡単・安定な結合を利用して作り出す反応技術。 - 5.ルシフェラーゼ法
ルシフェラーゼタンパク質が発する蛍光を利用した分子測定法。 - 6.自己免疫疾患
何らかの免疫異常によって自分の身体を構成する物質を異物のように認識し、自己抗体や自己に反応するリンパ球を作り、自分の組織を攻撃する疾患。代表的なものに関節リウマチなどあるが、根本的な治療法は見つかっていない。 - 7.天疱瘡症
粘膜・皮膚に水ぶくれを生じる病気で、上皮細胞接着分子(例:デスモグレイン)に対する抗体が原因で起きる。 - 8.ELISA法
エライザ法と呼ぶ。試料溶液中の目的抗原または目的抗体を、特異的抗体または抗原で検出する方法のこと。ELISAはEnzyme-Linked Immuno Sorbent Assayの略。 - 9.質量分析を用いた親和性測定
質量分析器(分子をイオン化し、そのイオンや分子の質量を測定する分析法)を用いた相互作用分子の検出法。 - 10.タンパク質アレイ
数千から数万のタンパク質が固相(スライドガラスなど)に固定されているマイクロアレイ。 - 11.DNA分子バーコーディング法
それぞれ異なる配列を持つDNA分子(DNA分子バーコード)を計測対象の核酸分子(DNAやRNA)の一つ一つに付加することで、増幅時のバイアスや配列決定のエラーなどを除き、核酸分子の数をデジタル的に正確に数えることができる方法。 - 12.ハロタグリガンド
ハロタグタンパク質に共有結合するクロロアルカン構造を持つ低分子化合物。機能性部位を持つハロタグリガンドを用いることで、その機能を持つタンパク質を簡便に作製できる。 - 13.自己抗体
抗体は、主に細菌やウイルスなどの外来の異物(抗原)を排除する目的で産生されるタンパク質であり、ワクチンや疾患の治療にも使用される。しかし、自分の体由来の物質を異物として認識する抗体が産生されることがあり、これを自己抗体と呼ぶ。自己抗体は、関節リウマチをはじめとした種々の自己免疫疾患で認められ、診断や治療経過のモニターに使用される。 - 14.ビオチン-アビジン反応
低分子化合物のビオチンとタンパク質のアビジンとの親和性を利用した結合反応。
共同研究グループ
理化学研究所
生命医科学研究センター
統合ゲノミクス研究チーム
上級研究員 矢崎 潤史(やざき じゅんし)
研究員(研究当時) 川島 祐介(かわしま ゆうすけ)
(現 かずさDNA研究所 研究員)
テクニカルスタッフI 小林 敦夫(こばやし あつお)
テクニカルスタッフI 大越 麻由(おおこし まゆ)
上級研究員 渡辺 貴志(わたなべ たかし)
チームリーダー 小原 收(おはら おさむ)
生命機能科学研究センター
細胞システム動態予測研究チーム
基礎科学特別研究員 小川 泰策(おがわ たいさく)
チームリーダー 城口 克之(しろぐち かつゆき)
(理研 生命医科学研究センター 疾患遺伝研究チーム 上級研究員)
健康生き活き羅針盤リサーチコンプレックス推進プログラム
共同利用設備構築・利用促進ユニット
ユニットリーダー(研究当時) 喜井 勲(きい いさお)
(現 信州大学 准教授)
慶應義塾大学 医学部 皮膚科学教室
助教 江上 将平(えがみ しょうへい)
教授 天谷 雅行(あまがい まさゆき)
(理研 生命医科学研究センター 皮膚恒常性研究チーム チームリーダー)
東京医科歯科大学 生体材料工学研究所 生命有機化学分野
准教授 吉田 優(よしだ すぐる)
教授 細谷 孝充(ほそや たかみつ)
(理研 生命機能科学研究センター 分子標的化学研究チーム チームリーダー)
研究支援
本研究の一部は、住友財団基礎科学研究助成「デジタルタンパクカウンティング技術の開発とそれを利用したタンパク間相互作用の絶対定量(代表者:矢崎潤史)」、武田財団ビジョナリー研究助成「DNAバーコーディングによるデジタルタンパク絶対定量(代表者:矢崎潤史)」による支援を受けて行いました。
原論文情報
- Junshi Yazaki, Yusuke Kawashima, Taisaku Ogawa, Atsuo Kobayashi, Mayu Okoshi, Takashi Watanabe, Suguru Yoshida, Isao Kii, Shohei Egami, Masayuki Amagai, Takamitsu Hosoya, Katsuyuki Shiroguchi and Osamu Ohara, "HaloTag-based conjugation of proteins to barcoding-oligonucleotides", Nucleic Acids Research, 10.1093/nar/gkz1086
発表者
理化学研究所
生命医科学研究センター 統合ゲノミクス研究チーム
上級研究員 矢崎 潤史(やざき じゅんし)
チームリーダー 小原 收(おはら おさむ)
生命機能科学研究センター 細胞システム動態予測研究チーム
チームリーダー 城口 克之(しろぐち かつゆき)
(理研 生命医科学研究センター 疾患遺伝研究チーム 上級研究員)
慶應義塾大学 医学部 皮膚科学教室
教授 天谷 雅行(あまがい まさゆき)
(理研 生命医科学研究センター 皮膚恒常性研究チーム チームリーダー)
 矢崎 潤史
矢崎 潤史
 小原 收
小原 收
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
慶應義塾大学 信濃町キャンパス総務課
Tel: 03-5363-3611 / Fax: 03-5363-3612
E-mail:med-koho[at]adst.keio.ac.jp ※[at]は@に置き換えてください。
