理化学研究所(理研)生命医科学研究センター免疫恒常性研究チームの秋山泰身チームリーダー、東京大学生産技術研究所の小林徹也准教授らの共同研究グループは、リンパ組織[1]である「胸腺」が機能傷害を受けた後に修復する過程についての数理モデル[2]を構築し、その解析により胸腺修復に重要な新たな機構を明らかにしました。
本研究成果は、環境変化によるストレス、骨髄移植治療、さらには老化による免疫機能低下の改善を目指す予防法や治療法の開発に貢献すると期待できます。
今回、共同研究グループは、マウスの全身に放射線を照射してリンパ組織の胸腺を損傷させ、その修復過程で起きる未熟Tリンパ球[3]と胸腺上皮細胞[4]の細胞数変動を、フローサイトメーター[5]を利用した実験により取得しました。そして得られた細胞数変動データをもとに、胸腺修復過程の数理モデルを構築しました。さらに、この定量的な数理モデルから、胸腺が修復するときにだけ機能する未熟Tリンパ球(DP細胞[3])の細胞応答を予測し、実験により実証しました。すなわち、数理科学と実験生物学のコラボレーションにより、胸腺傷害からの修復機構の一端が明らかになりました。
本研究は、英国の科学雑誌『Communications Biology』オンライン版(11月29日)に掲載されました。
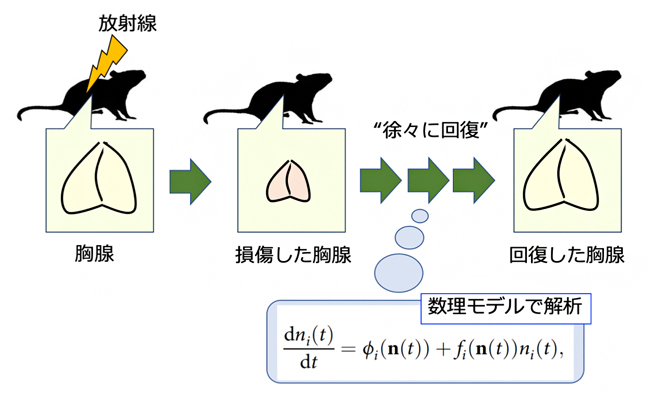
図 胸腺傷害からの修復過程を定量的にモデリング
背景
ヒトは一生の間、自分を取り巻くさまざまな環境の変化に何度も直面します。これらの環境変化には、免疫系に悪影響を与えるものが少なからず存在します。例えば、放射線のような物理的ストレスや心理的ストレスなどの環境変化は、リンパ組織の一つである「胸腺」に傷害を引き起こすことが知られています。
胸腺は、免疫応答に重要なTリンパ球を産生する臓器です。ストレスなどにより傷害を受けた胸腺は、そのストレスがなくなると修復を始めます。しかし、修復が不完全な場合、免疫不全や自己免疫疾患[6]などの疾患のリスク因子になると考えられています。そのため、胸腺の修復に必要な機構を理解することは、さまざまなストレスなどの環境変化により惹起あるいは増悪する疾患の予防や治療を行うためにも重要な課題といえます。
胸腺を構成する細胞は、主に未熟Tリンパ球と胸腺上皮細胞に分類されます。胸腺が傷害を受けて修復するまでには、それらの細胞が時間の経過とともに増殖、分化そして相互作用すると予想されます。しかし、その一連の過程は複雑であり、実験的にデータを取得するだけでは、その全貌を解明するのは困難でした。
こうした背景のもと、共同研究グループは、実験データと数理モデルを組み合わせることでその課題解決に挑みました。
研究手法と成果
致死量に満たない放射線をマウスへ一過的に照射すると、胸腺は急激に傷害を受けますが、しばらくすると修復することが知られています。共同研究グループは、まずマウスの全身へ放射線を照射し、その修復過程において継時的に胸腺を採取しました。胸腺内には、さまざまな分化段階の未熟なTリンパ球に加えて、それらの分化に重要な胸腺上皮細胞が存在し、それぞれの細胞数は胸腺傷害からの修復時に継時的に変化すると予想されます。そこで、採取した胸腺について、さまざまな分化段階の未熟Tリンパ球と胸腺上皮細胞をフローサイトメーターにより分離・検出し、時間依存的な細胞数の変動を決定しました(図1各点)。
次に、この細胞数変動を定量的に再現しうる細胞間相互作用の組み合わせと対応する数理モデルを、最適化手法[7]などを援用して探索した結果、細胞変動を極めてよく再現し得る数理モデルの構築とパラメータの同定に成功しました(図1)。そして、得られたネットワークの構造と細胞の増殖率や分化率などのパラメータの推定範囲は、これまでに行われた分化実験データから推定されていた知見とよく整合することが確認されました。
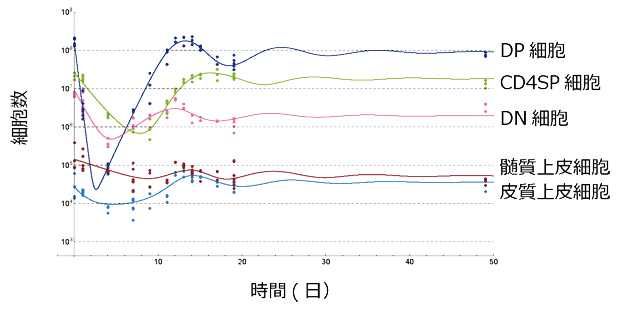
図1 胸腺修復過程における細胞数の変動と数理モデル
未熟Tリンパ球のDP細胞、DN細胞、ほぼ成熟したCD4SP細胞、胸腺の二つの上皮細胞(髄質上皮細胞と皮質上皮細胞の実験データ(各点)および数理モデルから予想される細胞数変動の曲線。青線は、DP細胞が急激に増殖し、さらに細胞数が十分に増えると自己抑制が起きるという細胞数制御の新たな機構を示す。
さらに、得られた数理モデルを検討したところ、これまであまり増殖が盛んでないと考えられていた、CD4CD8両陽性の未熟Tリンパ球(DP細胞)が急激に増殖し、さらに細胞数が十分に増えると自己抑制が起きるという細胞数制御の新たな機構が推測されました(図1青線)。そこで、この機構を実験的に検証するため、増殖マーカーであるKi67タンパク質[8]の発現を測定し、胸腺修復時の細胞増殖の状態を調べました。その結果、予想通り、CD4CD8両陽性未熟Tリンパ球が急激に増殖し、ついで急激に増殖停止することが分かり、今回樹立した数理モデルの妥当性が証明されました。
今後の期待
胸腺の傷害は、放射線だけでなく、さまざまな物理的、精神的ストレスでも起きることが知られています。今回の研究で、傷害を受けた胸腺の回復を精密かつ迅速に行うことで、疾患発症のリスクを下げる手法の開発へ発展が期待できます。
またストレスのみならず、老化によっても胸腺は萎縮し、高齢者の免疫能低下の原因の一つであると考えられています。今回の研究成果により、老化による胸腺萎縮を抑制する手段の開発につながる可能性もあります。
補足説明
- 1.リンパ組織
免疫反応の担い手であるリンパ球(Tリンパ球とBリンパ球)の発生、分化、増殖、そして抗体産生などの機能発現の場となる器官。胸腺、骨髄、リンパ節、脾臓など。 - 2.数理モデル
複雑な現象の重要な側面を簡略化した形で数式で表現したもの。本研究では、細胞数の時間変化を微分方程式などの数式を用いて捉え、論理的かつ定量的に記述した。 - 3.未熟Tリンパ球、DP細胞
Tリンパ球は、他の免疫細胞(Bリンパ球など)の機能を誘導したり、ウイルス感染細胞を除去したりする細胞。未熟Tリンパ球は、胸腺で分化途中のTリンパ球のこと。細胞表面のタンパク質であるCD4とCD8で分類され、CD4CD8両陰性細胞(DN細胞)からCD4CD8両陽性Tリンパ球(DP細胞)へ分化する。DP細胞は、最終的にCD4単陽性Tリンパ球(CD4SP細胞)あるいはCD8単陽性Tリンパ球(CD8SP細胞)へ分化する。 - 4.胸腺上皮細胞
胸腺に存在する特殊な上皮細胞であり、胸腺でのTリンパ球分化に不可欠である。胸腺内の局在により、髄質上皮細胞と皮質上皮細胞に分類される。 - 5.フローサイトメーター
蛍光抗体などで標識した細胞を個々に検出できる装置。 - 6.自己免疫疾患
何らかの免疫異常によって自分の身体を構成する物質を異物のように認識し、自己抗体や自己に反応するリンパ球を作り、自分の組織を攻撃する疾患。代表的なものに関節リウマチなどあるが、根本的な治療法は見つかっていない。 - 7.最適化手法
特定の性質を満たす数理モデルのパラメータなどを探索する手法。本研究では、実験データを再現するように、細胞数変動の微分方程式の持つ細胞の増殖率や分化率などのパラメータ値を探索するために用いた。 - 8.増殖マーカーであるKi67タンパク質
増殖中の細胞の多くは、タンパク質の一つであるKi67を高く発現する。これを利用し、Ki67タンパク質に対する抗体で、増殖中の細胞を検出できる。
共同研究グループ
理化学研究所 生命医科学研究センター
免疫恒常性研究チーム
チームリーダー 秋山 泰身(あきやま たいしん)
技師 宮尾 貴久(みやお たかひさ)
研究パートタイマーⅠ 高倉 勇気(たかくら ゆうき)
疾患遺伝研究チーム
上級研究員 秋山 伸子(あきやま のぶこ)
東京大学 生産技術研究所 定量生物学研究室
准教授 小林 徹也(こばやし てつや)
大学院生 金子 和正(かねこ かずまさ)
特任研究員 横田 亮(よこた りょう)
研究支援
本研究は、文部科学省科学研究費補助金新学術領域研究(研究領域提案型)「宇宙に生きる(領域代表者:古川聡)」の研究課題「宇宙環境によるリンパ組織擾乱の分子機構解明(研究代表者:秋山泰身)」、同基盤研究B(特設)「免疫恒常性の定量生物学(研究代表者:小林徹也):による支援を主に受けて行われました。
原論文情報
- Kazumasa B. Kaneko, Ryosuke Tateishi, Takahisa Miyao, Yuki Takakura, Nobuko Akiyama, Ryo Yokota, Taishin Akiyama* & Tetsuya J. Kobayashi*, "Quantitative analysis reveals reciprocal regulations underlying recovery dynamics of thymocytes and thymic environment in mice", Communications Biology, 10.1038/s42003-019-0688-8
発表者
理化学研究所
生命医科学研究センター 免疫恒常性研究チーム
チームリーダー 秋山 泰身(あきやま たいしん)
東京大学 生産技術研究所 定量生物学研究室
准教授 小林 徹也(こばやし てつや)
 免疫恒常性研究チームと秋山チームリーダー(後列中央)
免疫恒常性研究チームと秋山チームリーダー(後列中央)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
東京大学 生産技術研究所 広報室
Tel: 03-5452-6738 / Fax: 03-5452-6746
E-mail:pro [at] iis.u-tokyo.ac.jp
