理化学研究所(理研)開拓研究本部田中生体機能合成化学研究室の田中克典主任研究員(東京工業大学物質理工学院応用化学系教授、理研科技ハブ産連本部バトンゾーン研究推進プログラム糖鎖ターゲティング研究チーム副チームリーダー)、イヴァン・スミルノフ国際プログラム・アソシエイト(研究当時)らの国際共同研究グループは、4種類の異なる糖鎖[1]から構成される不均一な糖鎖クラスター[1]を、迅速に秩序良く合成することにより、がんを選択的に認識することに成功しました。
本研究成果は、糖鎖の「パターン認識」機構を用いて、がんを選択的に認識する画期的な診断やドラッグデリバリーシステム[2]への展開が期待できます。
生体内で特定のがんを見つけ、即座に治療できる分子の開発は、医療診断分野において最も重要な課題の一つです。
今回、国際共同研究グループは、独自の「理研クリック反応[3]」による糖鎖導入反応を併用することにより、特定のがん細胞と相互作用する4種類の糖鎖の組み合わせを迅速に最適化する方法を開発しました。タンパク質の表面に秩序よく高次化した「糖鎖の不均一性」により、マウスから取り出した生のがん組織をパターン認識で選択的に見分けることに成功しました。
本研究は、科学雑誌『Small』のオンライン版(10月20日付:日本時間10月20日)に掲載されました。
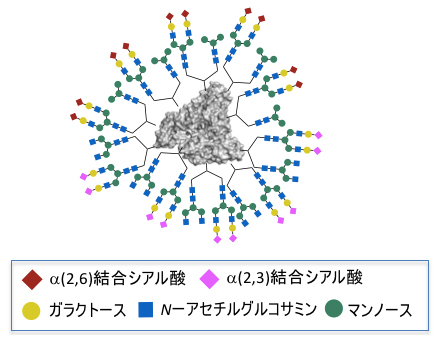
がん細胞と強く相互作用結合した、高次不均一性を持つ糖鎖アルブミン
背景
生体内で特定のがんを見つけ、速やかに治療できる分子やシステムの開発は、医療診断分野において最も重要な課題の一つです。これまでのほとんどの研究では、疾患部位を認識するには、体内の疾患部位にのみ多く発現する分子と強く相互作用するペプチドや抗体、あるいはこれらの分子をナノ粒子などの高分子単体の表面に導入したシステムが使用されてきました。しかし、実際には、疾患部位でのみ多く発現する分子は多くありません。そのうえ、強く相互作用するペプチドや抗体を用いる場合には、疾患部位以外に発現した分子との相互作用も起こり、副作用が生じるという問題もありました。
一方で、これまでに国際共同研究グループは、ペプチドや抗体とは異なる新しいタイプの認識機構として、糖鎖の「パターン認識」を用いた方法を提案してきました。一般的に、糖鎖1分子と細胞表面の糖鎖受容体タンパク質(レクチン)との相互作用は非常に弱く、診断や治療のために疾患を認識することはできません(図1)。しかし、これらの糖鎖を数分子集めてクラスターにすることで、複数の糖鎖分子が細胞表面の複数のレクチンと相互作用を起こせば、相互作用が増強されます(図1A)。実際には、糖鎖・レクチンの相互作用だけでなく、さまざまな細胞表面分子との疎水性相互作用[4]や水素結合もその強度を強めます。さらに複数種類の異なる糖鎖を用いてクラスターにすることで、それぞれの糖鎖に対応するレクチンが発現している特定の細胞とだけ選択的に相互作用することが可能になります(図1B)。
この機構は生体内で実際に用いられている細胞認識機構に近く、従来の方法に比べて疾患部位を正確に認識でき、副作用の抑制が期待できます。しかし、構造の定まった不均一な糖鎖クラスターをどのように効率的に合成するかが大きな課題でした。
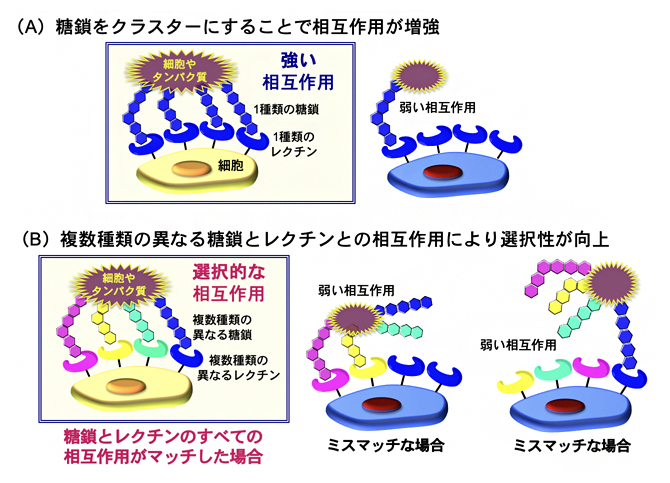
図1 糖鎖の「パターン認識」による細胞の認識
- (A)細胞やタンパク質の表面に複数の糖鎖をクラスター化することで、複数のレクチンとの相互作用が可能になり、黄色で示した標的細胞を強く認識することができる。
- (B)複数種類の異なる糖鎖をクラスター化することで、それぞれの糖鎖に対応するレクチンが発現している細胞に強く選択的に相互作用できる。青、赤、黄、緑色で示した模式図は、糖鎖とレクチンの種類を示し、色が同じ場合に相互作用が起こる。
国際共同研究グループは、タンパク質のアミノ基に効率的に糖鎖を導入する合成反応として、2016年と2018年に2種類の「理研クリック反応」を開発しました注1,2)。さらに、この糖鎖導入反応を用いて、血清アルブミン[5]の表面に2種類の異なる構造の糖鎖を導入し、「糖鎖の不均一性」によるパターン認識でがん細胞を選択的に認識できることを初めて証明しました。
今回、国際共同研究グループは、2種類の理研クリック反応を併用することで、アルブミン上に4種類の糖鎖から構成される高次な「糖鎖の不均一性」を合成することを計画しました。この際に、特定のがん細胞と相互作用する4種類の糖鎖の組み合わせを迅速に最適化する戦略を確立することを目指しました。
- 注1)2016年11月28日プレスリリース「糖鎖は不均一であることが重要」
- 注2)2018年7月4日プレスリリース「がんを糖鎖のパターンで認識」
研究手法と成果
これまでに国際共同研究グループが開発した2種類の理研クリック反応のうち、タイプAの糖鎖導入反応では、2種類の異なる糖鎖を持った理研クリック反応試薬を順にアルブミンに作用させることによって反応性の高いアミノ基から低いアミノ基へと順に糖鎖を導入できます(図2上段)。一方、タイプBの糖鎖導入反応では、あらかじめ2種類の異なる糖鎖をつないだ理研クリック反応試薬をアルブミンに作用させることにより、2種類の糖鎖を一挙にアミノ基に導入できます(図2中段)。
今回、国際共同研究グループは、まずタイプBの糖鎖導入反応を用いて、2種類の糖鎖からなる不均一糖鎖アルブミンのライブラリーを合成し、この中から標的のがん細胞と強く相互作用する2種類の組み合わせを選び出しました。その後、タイプAの糖鎖導入反応を用いて、強く相互作用する2種類の糖鎖の組み合わせをさらにアルブミン上に順番に導入することにより、4種類の異なる糖鎖から構成される不均一糖鎖アルブミンを効率良く合成しました(図2下段)。このように、2種類の理研クリック反応を用いて秩序良く「糖鎖の不均一性」を高次化することで、がんへの選択性を著しく向上させることを計画しました。
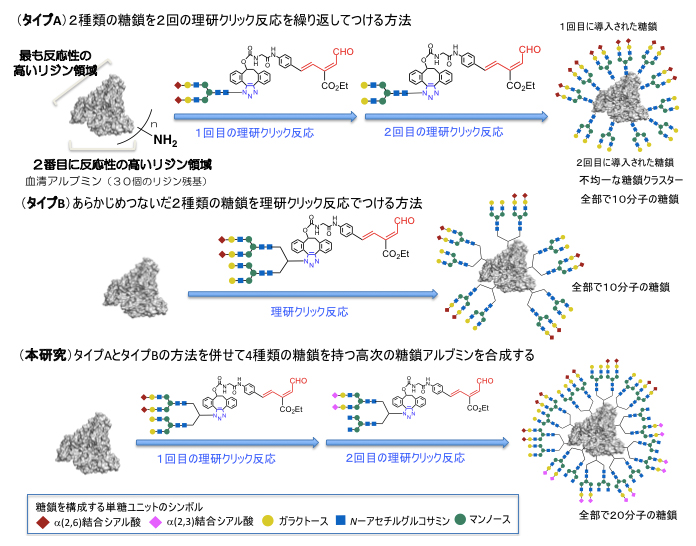
図2 理研クリック反応を使用した不均一な糖鎖アルブミンの効率的合成
- 上段血清アルブミンに対して、2種類の異なる糖鎖を持った理研クリック反応試薬を順に作用させることにより、反応性の高いリジンのアミノ基から低いリジンのアミノ基へと順に糖鎖を導入できる。
- 中段あらかじめ2種類の異なる糖鎖をつないだ理研クリック反応試薬を作用させることにより、2種類の糖鎖を一挙にアミノ基に導入できる。
- 下段タイプAとタイプBを組み合わせて、4種類の異なる糖鎖から構成される不均一糖鎖アルブミンを効率良く合成する。
1例として、ヒト大腸がん細胞であるSW620がん細胞と強く相互作用する高次な不均一糖鎖アルブミンの合成を検討しました(図3)。まず、タイプBの糖鎖導入反応を用いて、ランダムに選んだ2種類の糖鎖1-14からなる14種類の不均一糖鎖アルブミン(A-1?A-14)を合成しました。これらをSW620がん細胞に作用させたところ、3と6の糖鎖を持つ糖鎖アルブミンA-3とA-6が最も強く相互作用し、5の糖鎖を持つ糖鎖アルブミンA-5はほとんど相互作用しないことが分かりました。
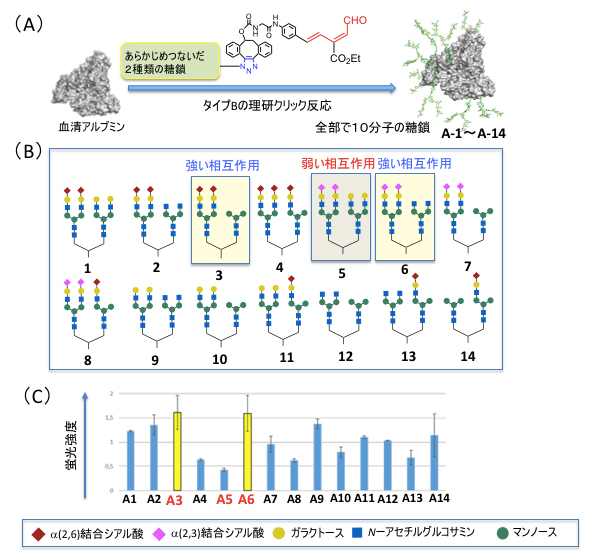
図3 がんを認識する高次な不均一糖鎖アルブミンへの第一段階合成と相互作用
- (A)タイプBの理研クリック反応により、あらかじめつないだ2種類の糖鎖をアルブミンに結合させた。
- (B)アルブミンに結合させた14種類の糖鎖の構造。
- (C)蛍光標識した糖鎖アルブミンをSW620がん細胞に作用させ、蛍光強度により相互作用の強さを評価した。
そこで、さらにタイプAの糖鎖導入反応を用いて、図3で見いだした3および6の糖鎖の組み合わせを順番にアルブミンに導入し、4種類の糖鎖から構成される高次の不均一糖鎖アルブミンA-36を合成しました(図4上段)。この際、理研クリック反応を用いた糖鎖導入反応では、最初に作用させた試薬が最も反応性の高いアミノ基に反応し、次に作用させた試薬は反応性の低いアミノ基に順序よく反応します。そこで、糖鎖3と6を持つ理研クリック試薬を作用させる順番を変えることによって、位置異性体[6]となる不均一糖鎖アルブミンA-63も同時に合成しました(図4下段)。このように、理研クリック反応によって、異なる4種類の糖鎖を持ち、複雑でありながら構造が定まったタンパク質複合体を容易に合成できました。今回合成した不均一糖鎖アルブミンA-36やA-63は、世界で最も大きな人工糖タンパク質複合体です。
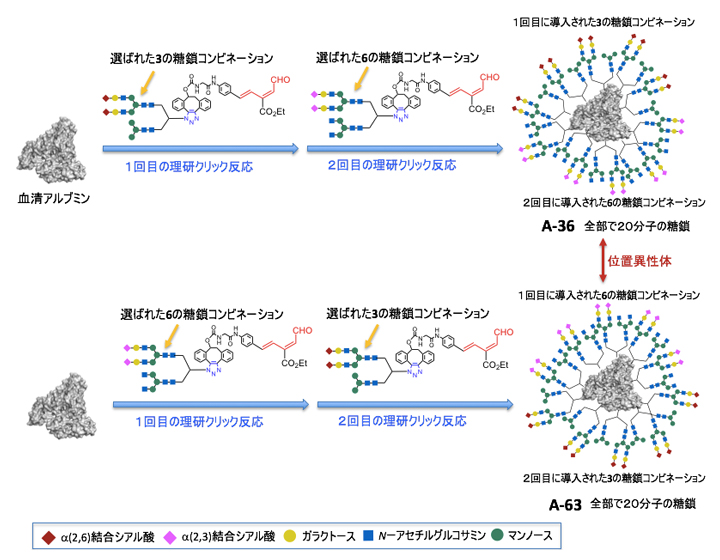
図4 4種類の異なる糖鎖を持つ高次な不均一糖鎖アルブミンの合成
- 上段血清アルブミンに対して、糖鎖3、糖鎖6の順番で作用させると、4種類の糖鎖から構成される高次の不均一糖鎖アルブミンA-36が合成される。
- 下段上段と逆の順番で糖鎖を作用させると、A-63が合成される。A-36とA-63は位置異性体の関係にある。
次に、合成した高次の不均一糖鎖アルブミンA-36とA-63のSW620がん細胞に対する相互作用を調べたところ、予想通りA-3やA-6に比べて強度が強くなっていることが分かりました(図5)。一方で、A-36とA-63は、A-3やA-6に比べて2倍の数の糖鎖を含んでいます。アルブミンに導入した糖鎖の数が相互作用に影響しているかを調べるため、糖鎖の量を2倍に増やしたA-3'とA-6'を合成して調べたところ、SW620がん細胞への相互作用の向上は認められませんでした。このことから、アルブミンとがん細胞の相互作用の向上には「糖鎖の数」ではなく、糖鎖の不均一性の高次化が重要であることが分かりました。
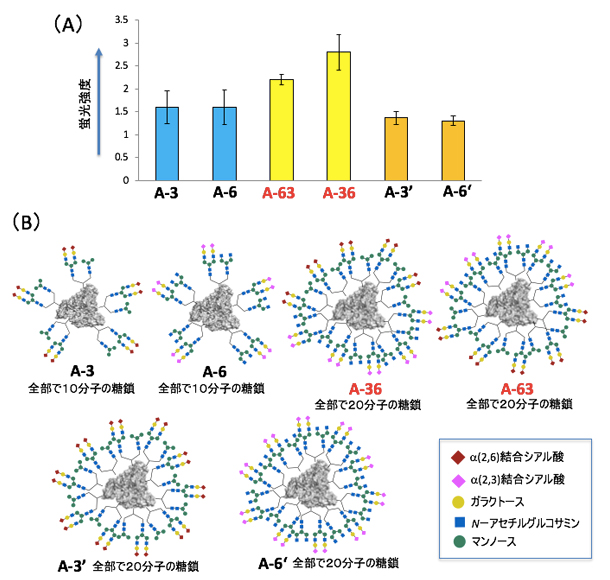
図5 高次な不均一糖鎖アルブミンのSW620がん細胞への相互作用
- (A)蛍光標識した糖鎖アルブミンをSW620がん細胞に作用させ、蛍光強度により相互作用の強さを評価した。4種類の糖鎖を持つ高次な不均一糖鎖アルブミン(A-63、A-36)は、より強くがん細胞と相互作用した。
- (B)細胞相互作用に用いた不均一糖鎖アルブミンの構造。
さらに、SW620がん細胞を移植したがんモデルマウスから腫瘍を取り出した後、その組織に対して、図3の2種類の糖鎖からなる糖鎖アルブミンの中で最も相互作用が弱かったA-5、最も相互作用が強かったA-3、さらに不均一性を高次化した4種類の糖鎖からなる糖鎖アルブミンA-36を作用させました(図6)。その結果、生体のがん組織を用いた実験においても、がん細胞を用いた結果と同じように、A-5、A-3、そしてA-36の順に相互作用が強くなることが分かりました。このように糖鎖の不均一性を高次化させることによって、最も効率的に糖鎖パターン認識を働かせることができ、生体のがんを強く認識させることに成功しました。
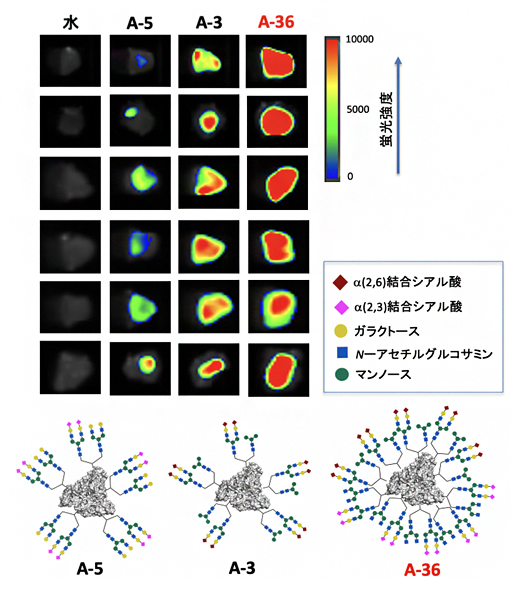
図6 不均一な糖鎖アルブミンの生のがんへの相互作用
蛍光標識した糖鎖アルブミンをマウスから取り出したSW620がん細胞に作用させたところ、高次に不均一化した糖鎖アルブミンが最も強く相互作用した。
今後の期待
糖鎖パターン認識を医療診断の手法として展開するためには、構造の定まった不均一な糖鎖クラスターをどのように効率的に合成し、標的の細胞への相互作用を最適化するかが課題でした。今回、2種類の理研クリック反応による糖鎖導入反応を効率的に利用することによって、特定のがんと選択的に相互作用する糖鎖の不均一性を順序よく高次化する合成戦略を開発しました。
今後、糖鎖パターン認識を用いて、患者にテーラーメードな生検や診断、あるいは薬剤と複合化することにより、新たなドラッグデリバリーシステムへの展開が期待できます。
補足説明
- 1.糖鎖、糖鎖クラスター
糖鎖とは、最も単純な糖である単糖(ガラクトースなど)が数個、ときには数百個以上も枝分かれしながら連なったものである。本研究では、同一あるいは数種類の糖鎖がある高分子の上に複数個並べられた構造を糖鎖クラスターと呼ぶ。 - 2.ドラッグデリバリーシステム
体内の薬物分布を量的・空間的・時間的に制御する薬物伝達システム。特定の組織への効果や副作用の軽減が期待でき、開発が進められている。 - 3.理研クリック反応
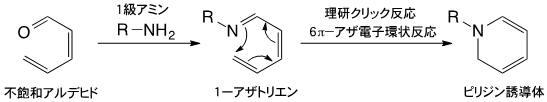
不飽和アルデヒドとリジン残基のような1級アミンが反応すると、1-アザトリエンが生成する。1-アザトリエンは、末端炭素原子と窒素原子が結合してピリジン誘導体を与える(6π-アザ電子環状反応)。この反応は古くから良く知られていたものの、長い反応時間と高い反応温度が必要とされ、さらに収率も良くなかったことから積極的に有機合成に利用されることはなかった。しかし1998年に、田中克典主任研究員らがアザ電子環状反応を強力に促進させる置換基効果を発見して以来、有機合成に限らず生体分子や細胞の標識、あるいは複合化のための反応として利用されている。現在、「理研クリック反応」として、国際共同研究グループが中心となり診断や放射線治療に向けた研究を展開している。
- 4.疎水性相互作用
疎水性の(水分子と親和性の低い)非極性基が、水溶液中で互いに集まろうとする相互作用。例えば、バリン(Val)、ロイシン(Leu)などの疎水性アミノ酸は非極性基の側鎖を持ち、その側鎖同士がタンパク質分子内部で互いに凝集して疎水性相互作用を形成し、タンパク質の安定化に重要な役割を果たしている。 - 5.アルブミン
血清中の大部分を占め、分子量が6万程度の極めて安定な可溶性タンパク質。さまざまな薬物と配位する疎水性ポケットが存在し、血中内を運搬する。表面に反応性の高いリジン残基が30個程度存在するため、機能性低分子を付着させる生体高分子としても良く使用される。生体内に静脈注射すると、皮下の毛細血管を通り、体全体に広く分布する。血流の状態を良く反映するため、MRIなどを用いた疾患の診断薬として利用される。 - 6.位置異性体
ここでは、糖鎖クラスターを構成する糖鎖の分子構造は同じであるが、それぞれが配置される場所が異なることによって生じる異性体を指す。
国際共同研究グループ
理化学研究所
開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
(東京工業大学 物質理工学院 応用化学系 教授)
(理研科技ハブ産連本部バトンゾーン研究推進プログラム 糖鎖ターゲティング研究チーム副チームリーダー)
国際プログラム・アソシエイト(研究当時) イヴァン・スミルノフ(Ivan Smirnov)
国際プログラム・アソシエイト(研究当時) レギーナ・シブガチュリナ(Regina Sibgatullina)
テクニカルスタッフⅡ 浦野 清香(うらの さやか)
研究員 ペニ・アハマディ(Peni Ahmadi)
基礎科学特別研究員(研究当時) アンバラ・プラディプタ(Ambara Pradipta)
(東京工業大学物質理工学院応用化学系助教)
生命機能科学研究センター 健康・病態科学研究チーム
研究員 田原 強(たはら つよし)
チームリーダー 渡辺 恭良(わたなべ やすよし)
カザン大学 生体機能化学研究室(理研-カザン連携研究室)
准教授 アルミラ・クルバンガリエバ(Almira Kurbangalieva)
研究支援
本研究は、日本医療研究開発機構(AMED)先端的バイオ創薬等基盤技術開発事業「糖鎖付加人工金属酵素による生体内合成化学治療(研究代表者:田中克典)」による支援を受けて行われました。
原論文情報
- Ivan Smirnov, Regina Sibgatullina, Sayaka Urano, Tsuyoshi Tahara, Peni Ahmadi, Yasuyoshi Watanabe, Ambara R. Pradipta, Almira Kurbangalieva, and Katsunori Tanaka, "A strategy for tumor targeting by higher-order glycan pattern recognition: synthesis and in vitro and in vivo properties of glycoalbumins conjugated with four different N-glycan molecules", Small, 10.1002/smll.202004831
発表者
理化学研究所
開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
(東京工業大学 物質理工学院 応用化学系 教授、理研 科技ハブ産連本部 バトンゾーン研究推進プログラム 糖鎖ターゲティング研究チーム 副チームリーダー)
国際プログラム・アソシエイト(研究当時) イヴァン・スミルノフ(Ivan Smirnov)
 左からイヴァン・スミルノフ、田中克典
左からイヴァン・スミルノフ、田中克典
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
東京工業大学 総務部 広報課
Tel: 03-5734-2975 / Fax: 03-5734-3661
Email: media [at] jim.titech.ac.jp
産業利用に関するお問い合わせ
AMED事業に関すること
国立研究開発法人 日本医療研究開発機構(AMED)
創薬事業部 医薬品研究開発課 先端的バイオ創薬等基盤技術開発事業担当
Email: sentan-bio [at] amed.go.jp
※上記の[at]は@に置き換えてください。
