理化学研究所(理研)開拓研究本部田中生体機能合成化学研究室の田中克典主任研究員、浦野清香テクニカルスタッフⅡ、レギーナ・シブガトウリナ国際プログラム・アソシエイト、小椋章弘特別研究員(研究当時)らの国際共同研究グループ※は、2種類の糖鎖[1]を含む不均一な糖鎖クラスター[1]を用いることで、さまざまながん細胞を見分けることに成功し、このような「糖鎖のパターン」を使って生体内のがん細胞の「顔」を高度に識別できることを実証しました。
本研究成果は、これまで汎用されてきた抗体に代わる新しいドラッグデリバリーシステム[2]として、がんの診断や創薬研究に活用されると期待できます。
田中主任研究員らは2016年、独自に開発した「理研クリック反応[3]」を用いて、2種類の糖鎖を含む不均一な糖鎖クラスターを効率的に合成することに成功しました。今回、国際共同研究グループは、この方法で合成したさまざまな糖鎖クラスターをがん細胞に作用させた結果、糖鎖クラスター内の糖鎖の組成により、細胞選択性が著しく異なることを見いだしました。さらに、いくつかのがん細胞を移植したマウスに不均一な糖鎖クラスターを静脈注射したところ、特定のがん細胞のみを選択的に検出することに成功しました。
本研究は、英国の科学雑誌『Chemical Communications』の掲載に先立ち、オンライン版(6月27日付け)に掲載されました。
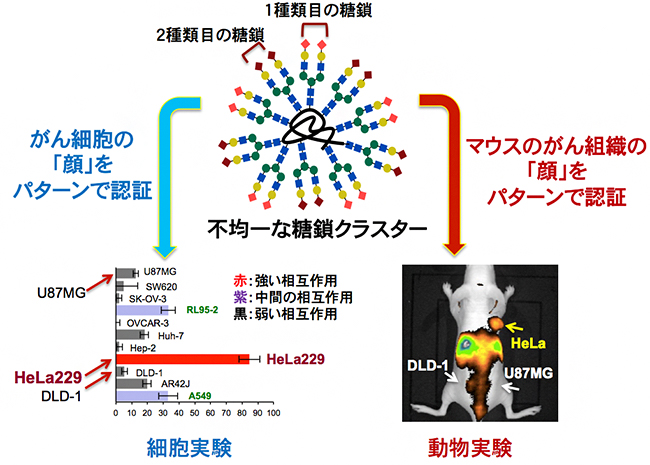
図 不均一な糖鎖クラスターでがん細胞、マウス内のがん組織をパターンで識別できる!
※国際共同研究グループ
理化学研究所
開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
特別研究員(研究当時) 小椋 章弘(おぐら あきひろ)
(現慶應義塾大学理工学部助教)
テクニカルスタッフⅡ 浦野 清香(うらの さやか)
基礎科学特別研究員 ケンワード・ヴォン(Kenward Vong)
国際プログラム・アソシエイト レギーナ・シブガトウリナ(Regina Sibgatullina)
生命機能科学研究センター
健康・病態科学研究チーム
チームリーダー 渡邊 恭良(わたなべ やすよし)
研究員 野崎 聡(のざき さとし)
生体機能動態イメージング研究ユニット
研究員 田原 強(たはら つよし)
環境資源科学研究センター
生命分子解析ユニット
ユニットリーダー 堂前 直(どうまえ なおし)
専任技師 鈴木 健裕(すずき たけひろ)
カザン大学 生体機能化学研究室(理研-カザン連携研究室)
准教授 アルミラ・クルバンガリエバ(Almira Kurbangalieva)
背景
図1で示しているように、上段の口だけを見て、個人を特定するのは難しいですが、下段の顔写真を見ると個々の人物が容易に識別できます。これは「パターン認識」といい、口だけでなく、目、鼻、眉毛、髪などの全体像を眺めると、各人の顔が識別できるようになることを指します。最近は、携帯の画面上で使用者の「顔」がパターン認識によって認証できるようになっています。
生体内でさまざまな分子や細胞が特定の細胞や臓器と相互作用する際に、このパターン認識は重要な役割を果たしています。生体内でのパターン認識を担う重要な生体分子の一つに「糖鎖」を挙げられます。糖鎖はタンパク質や細胞表面にたくさん集まり、クラスターと呼ばれる凝集体を形成しています。1種類の糖鎖分子だけでなく、多種類の異なる糖鎖分子が凝集し、不均一な糖鎖クラスターを形成しています。つまり、複数の糖鎖認識タンパク質(レクチン[4])を選択的に識別することにより、標的細胞が識別可能となります。まさに、図1で口だけを見ていても個人を特定できなかったのが、顔全体を眺めると識別できる仕組みと同じで、糖鎖がさまざまな細胞表面の「顔」を高度に識別できる仕組みの一つです。しかし、複雑な構造を持つ不均一な糖鎖クラスターの化学合成やその解析が難しかったために、これまで、生体内での糖鎖のパターン認識が細胞の識別に利用されていませんでした。
田中克典主任研究員らは2016年、独自に開発した「理研クリック反応」を活用して、血清アルブミン[5]の表面に位置を制御して2種類のアスパラギン結合型糖鎖(N-型糖鎖)を導入し、不均一な糖鎖クラスターを効率的に合成することに成功しました(図2)注1,2)。さらに、これらの糖鎖クラスターをマウス内に静脈注射すると、その2種類の糖鎖の構造や配置によって、臓器への集積や排出時間が異なることを見いだしました。つまり、不均一な糖鎖クラスターによる、糖鎖のパターン認識を生体内で発揮できる可能性を示したのです。
今回、国際共同研究グループは、化学合成したさまざまな不均一な糖鎖クラスターとさまざまながん細胞との相互作用を調べ、マウス体内において糖鎖のパターン認識によりがん細胞の種類を識別できるか検証を試みました。
- 注1) 2016年11月28日プレスリリース「糖鎖は不均一であることが重要」
- 注2) 2018年2月23日プレスリリース「理研クリック試薬の誕生」
研究手法と成果
がん細胞の表面には、一般的にセレクチン[4]と呼ばれる糖鎖末端のα(2,3)シアル酸部位を認識するレクチンが多く発現すると考えられています。そこで、国際共同研究グループは、理研クリック反応を用いて7種類の糖鎖クラスター(a、b、c、c’、d、e、f)を合成しました(図3)。これらの糖鎖クラスターは、2種類の異なるN-型糖鎖(タンパク質のアスパラギン残基のアミド窒素に結合している糖鎖)を10分子持っています。aを除いた全ての糖鎖クラスターにおいて、1種類は末端にα(2,3)シアル酸部位を含む糖鎖を5分子とし、もう1種類はこれとは異なる糖鎖を5分子となるように調整し、不均一な糖鎖クラスターとしました。
次に、蛍光標識したこれらの7種類の不均一な糖鎖クラスターを11種類のがん細胞に作用させ、その相互作用の強度を調べたところ、不均一な糖鎖クラスターの種類によって、相互作用の強度が著しく異なることが分かりました(図4)。特に、糖鎖クラスターcとc’は同じ2種類の糖鎖を持ち、アルブミン上の導入位置を変えただけの位置異性体であるにもかかわらず、さまざまながん細胞への相互作用が異なっていました。この結果は、不均一な糖鎖クラスターががん細胞表面の「顔」に対して、まさに「パターン」で認識していることを示しています。
さらに、これらのがん細胞に対するパターン認識が、マウス体内でも発揮されるかについて検討しました。ヒトのがん細胞(U87MG, HeLa229,DLD-1)を移植したヌードマウス[6]に、糖鎖クラスターeおよび糖鎖クラスターbを静脈注射して、がん部位への集積を非侵襲的な蛍光イメージング[7]で追跡しました。その結果、90分までのイメージング画像から、糖鎖クラスターbのみがHeLa229に選択的に集積することが分かりました(図5)。このように、糖鎖のパターン認識を使用することで、動物のレベルでも特定のがん細胞を高度に識別することに成功しました。
今後の期待
国際共同研究グループは、2種類の糖鎖を含む不均一な糖鎖クラスターを用いることで、マウスレベルでも糖鎖のパターン認識を発揮させ、特定のがん細胞を識別できることを明らかにしました。これは糖鎖のパターン認識を実験的に証明した初めての成果です。
今回、「糖鎖のパターン」を使って生体内のがん細胞の「顔」を高度に識別できることが実証されました。今後、理研クリック反応を使用するより、2種類の糖鎖を含むクラスターだけではなく、より高度な「パターン認識」を実現できる多種類の糖鎖を含むクラスターを効率的・迅速に調製することも可能です。本成果は、これまで汎用されてきた抗体に代わる次世代の革新的なドラッグデリバリーシステムとして、がんの診断や創薬研究に活用されると期待できます。
原論文情報
- Akihiro Ogura, Sayaka Urano, Tsuyoshi Tahara, Satoshi Nozaki, Regina Sibgatullina, Kenward Vong, Takehiro Suzuki, Naoshi Dohmae, Almira Kurbangalieva, Yasuyoshi Watanabe, and Katsunori Tanaka, "A Viable Strategy for Screening the Effects of Glycan Heterogeneity on Target Organ Adhesion and Biodistribution in Live Mice", Chemical Communications, 10.1039/C8CC01544A
発表者
理化学研究所
主任研究員研究室 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
特別研究員(研究当時) 小椋 章弘(おぐら あきひろ)
(現 慶應義塾大学理工学部助教)
テクニカルスタッフⅡ 浦野 清香(うらの さやか)
国際プログラム・アソシエイト レギーナ・シブガトウリナ (Regina Sibgatullina)
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
補足説明
- 1.糖鎖、糖鎖クラスター
糖鎖とは、最も単純な糖である単糖(ガラクトースなど)が数個、ときには数百個以上も枝分かれしながら連なったものである。本研究では、同一あるいは数種類の糖鎖がある基盤上に複数個並べられた構造を糖鎖クラスターと呼ぶ。 - 2.ドラッグデリバリーシステム
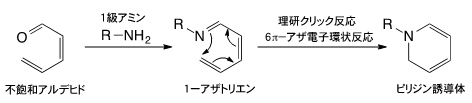
体内の薬物分布を量的・空間的・時間的に制御する薬物伝達システム。特定の組織への効果や副作用の軽減が期待でき、開発が進められている。 - 3.理研クリック反応(6π-アザ電子環状反応)
不飽和アルデヒドとリジン残基のような1級アミンが反応すると、1-アザトリエンが生成する。1-アザトリエンは、末端炭素原子と窒素原子が結合してピリジン誘導体を与える(アザ電子環状反応)。この反応は古くから良く知られていたものの、長い反応時間と高い反応温度が必要とされ、さらに収率も良くなかったことから積極的に有機合成に利用されることはなかった。しかし1998年に、田中克典主任研究員らがアザ電子環状反応を強力に促進させる置換基効果を発見して以来、有機合成に限らず生体分子や細胞の標識、あるいは複合化のための反応として利用されている。現在、「理研クリック反応」として、国際共同研究グループが中心となり診断や放射線治療に向けた研究を展開している。
- 4.レクチン、セレクチン
糖鎖を認識するタンパク質をレクチンと呼ぶ。さらにこの中で、シアル酸を含む糖鎖を認識するタンパク質をセレクチンと呼ぶ。 - 5.アルブミン
血清中の大部分を占め、分子量が6万程度の極めて安定な可溶性タンパク質。さまざまな薬物と配位する疎水性ポケットが存在し、血中内を運搬する。表面に反応性の高いリジン残基が30個程度存在するため、機能性低分子を付着させる生体高分子としても良く使用される。生体内に静脈注射すると、皮下の毛細血管を通り、体全体に広く分布する。血流の状態を良く反映するため、MRIなどを用いた疾患の診断薬として利用される。 - 6.ヌードマウス
先天的に胸腺を欠くマウス。胸腺を欠損するためにT細胞が作られず、免疫不全を起こす。他の動物種の細胞を拒絶する力も弱いので、ヒトの組織やがん細胞の移植実験によく用いられる。 - 7.非侵襲的なイメージング
動物を生きたままで動態や集積をイメージングにより可視化する方法の一つ。本研究で実施した近赤外線領域に吸収を持つ蛍光イメージングや、PET(Positron Emission Tomography)、SPECT(Single Photon Emission Computed Tomography)、あるいはMRIが代表例である。

図1 パターン認識による「顔」認証
口を見るだけでは全く特定できないが、顔全体を見ると発表者の田中主任研究員、浦野テクニカルスタッフ、シブガトウリナ国際プログラム・アソシエイトがすぐに識別できる
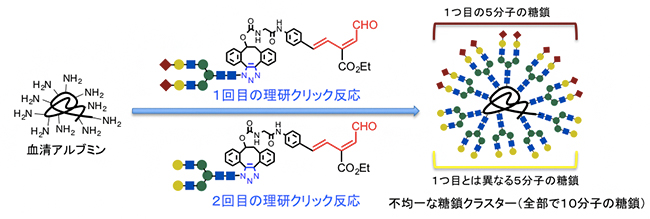
図2 理研クリック反応による不均一糖鎖クラスターの効率的な合成
血清アルブミンの表面のリジン残基に対して、2種類の異なるN-型糖鎖を持つ理研クリック試薬を作用させることにより、それぞれの糖鎖を5分子ずつ持つ不均一な糖鎖クラスターを迅速に合成できる。
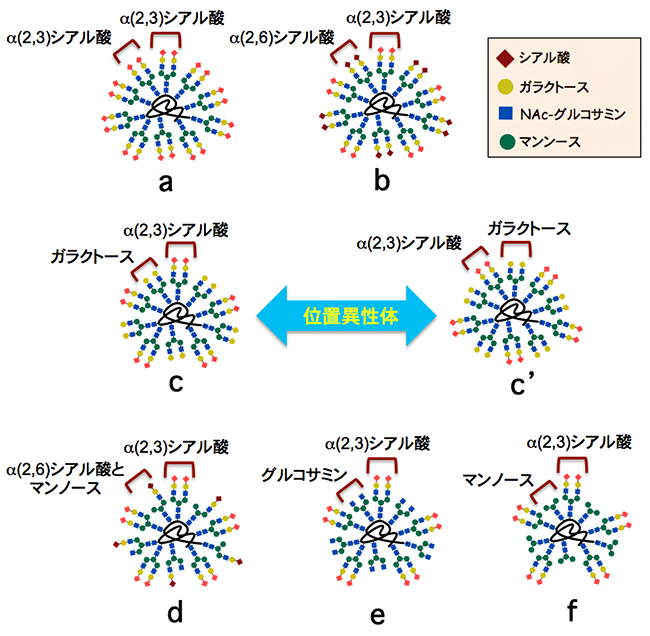
図3 理研クリック反応で合成した7種類の不均一な糖鎖クラスター
基本的に、α(2,3)シアル酸部位を末端に含むN-型糖鎖を5分子と、これとは別の1種類のN-型糖鎖を5分子導入した不均一な糖鎖クラスターを合成した。図中では、糖鎖クラスターの2種類の糖鎖のうち、末端に位置する糖を示している。糖鎖クラスターaは2種類とも同じ糖鎖を使用したため、10分子全てが同じ糖鎖である。糖鎖クラスターcとc’は、使用した二つの糖鎖の種類は同じであるが、アルブミンへの導入位置が異なる。これは「位置異性体」と呼ばれる。
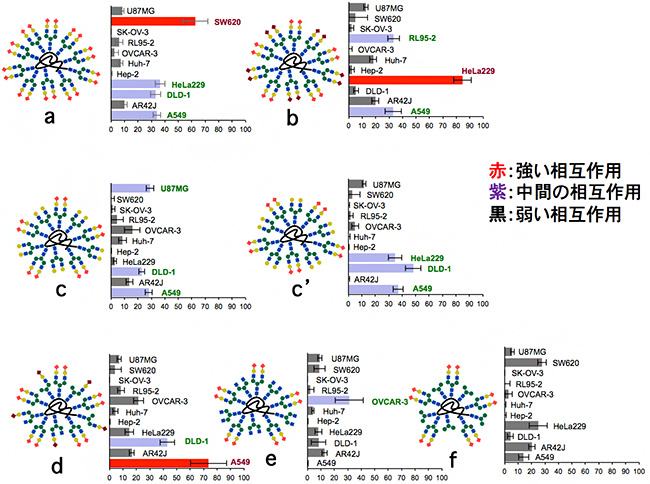
図4 不均一糖鎖クラスターと様々ながん細胞との相互作用
糖鎖クラスター(a-f)の隣の表は、各々のクラスターと11種類のがん細胞との相互作用を示す。各表において棒グラフが右に行くほど強い相互作用であることを示す。各糖鎖クラスターによって、相互作用が著しく異なることが分かる。各がん細胞は上から、ヒト脳がん細胞(U87MG)、ヒト大腸がん細胞(SW620)、ヒト卵巣がん細胞(SK-OV-3)、ヒト子宮がん細胞(RL95-2)、ヒト卵巣がん細胞(OVCAR-3)、ヒト肝臓がん細胞(Huh-7)、ヒト咽頭がん細胞(Hep-2)、ヒト子宮頸がん細胞(HeLa229)、ヒト結腸腺がん細胞(DLD-1)、ラット膵臓がん細胞(AR42J)、ヒト肺がん細胞(A549)。
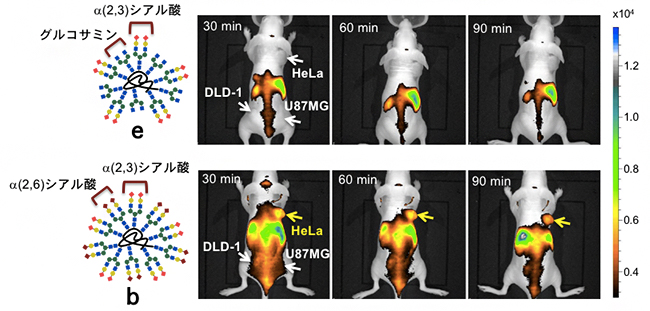
図5 糖鎖クラスターの「パターン認識」によるマウス内でのがんの識別
ヌードマウスの肩と足の付け根に、それぞれHeLa229(ヒト子宮頸がん細胞)、DLD-1(ヒト結腸腺がん細胞)、およびU87MG(ヒト脳がん細胞)を移植した後、糖鎖クラスターeとbを静脈注射した。がん細胞との相互作用実験で得られた結果と同様に、糖鎖クラスターbのみがHeLa229(下段で黄色の矢印で示した部分)を選択的に識別したことが分かる。
