理化学研究所(理研)開拓研究本部袖岡有機合成化学研究室の菅原真純特別研究員(研究当時)、五月女宜裕専任研究員(理研環境資源科学研究センター触媒・融合研究グループ専任研究員)、袖岡幹子主任研究員(同グループディレクター)らの研究グループは、位置多様性・脱水素型クロスカップリング反応の開発に成功しました。
本研究成果は、脱水素型クロスカップリング反応による位置異性体[1]の選択的供給に貢献すると期待できます。
酸化反応は、化学産業プロセスの30%以上を占める重要な反応です。しかし、酸素分子を酸化剤として用い、異なる二つの炭素-水素結合を切断し、新たに炭素-炭素結合を形成する脱水素型(酸化的)クロスカップリング反応は、反応性や選択性の制御が難しく、その成功例は限定的でした。
今回、研究グループは、オキシインドールあるいはベンゾフラノン二量体のホモリシス[2]により生じる持続性ラジカル[3]を鍵活性種として用い、カテコール類[4]との位置多様性・脱水素型クロスカップリング反応を実現しました。この反応では、触媒を用いないとカテコールの6位に炭素-炭素結合が形成されたC(6)生成物が合成され、袖岡研究室で開発したパラジウム(Pd)錯体触媒を用いるとカテコールの5位に炭素-炭素結合が形成されたC(5)生成物が合成されます。さらに、有機合成化学、分光学、計算科学を用いた一連の解析により、Pd錯体触媒がどのようにC(5)生成物を選択的に与えるのか実験的・理論的に明らかにしました。新たに見いだしたラジカル・酸/塩基の協奏的反応では、従来エネルギー的に不利と考えられてきた吸熱反応が進行した後に、酸化的芳香族化を経てより安定な最終生成物へと変換されることが明らかとなりました。今後、新しい反応および触媒を開発するための有用な設計指針になります。
本研究は、科学雑誌『ACS Catalysis』に近日掲載予定です。
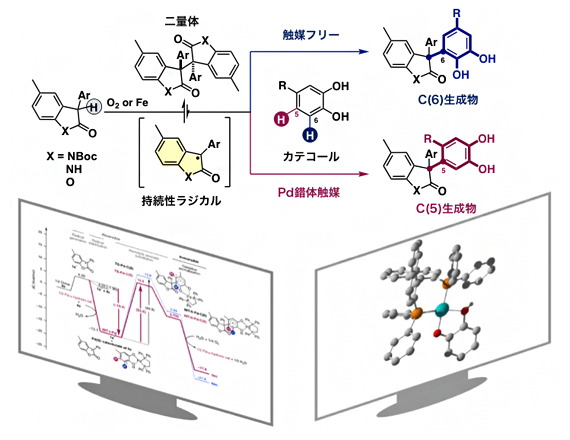
位置多様性・脱水素型クロスカップリング反応
背景
2010年ノーベル化学賞の受賞対象になった「クロスカップリング反応」は、触媒を用いて炭素-金属(C-M)結合と炭素-ハロゲン(C-X)結合を切断し、新たな炭素-炭素(C-C)結合を形成させる反応です(図1-i)。
近年では、工程数や副生成物の抑制を目指し、異なる二つの炭素-水素(C-H)結合を切断し、新たなC-C結合を形成させる「脱水素型クロスカップリング反応」の開発が活発に行われています。一般的に、この反応では酸化剤が必要であり、酸化剤として酸素分子を用いるフェノール類の脱水素型クロスカップリング反応では水のみが排出されるため、クリーンな反応として注目を集めています(図1-ii)。しかし、フェノール類同士のホモカップリングの抑制や、フェノール類の位置選択性の制御に課題が残されていました。フェノール類の所望の位置で自在に脱水素型クロスカップリング反応を進行させることができれば、得られる位置異性体は医薬や農薬を開発するための有用なビルディングブロック[5]となります。
一方、これまで袖岡幹子主任研究員らは、オキシインドールあるいはベンゾフラノン二量体のホモリシスにより生じる持続性ラジカルを鍵活性種として用いる「ラジカル-ラジカルクロスカップリング反応」の研究を行ってきました注1,2)。今回、この持続性ラジカルを用いることで、カテコール類との位置多様性・脱水素型クロスカップリング反応を試みました(図1-iii)。
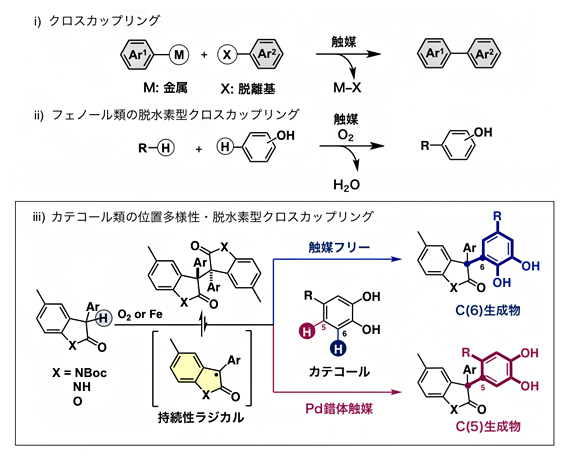
図1 クロスカップリング反応
- i)一般的なクロスカップリング。C-M結合とC-X結合を切断し、新たなC-C結合を形成させる。
- ii)フェノール類の脱水素型クロスカップリング。異なる二つのC-H結合を切断し、新たなC-C結合を形成させる。酸化剤としてO2を用いると、水のみが排出されるクリーンな反応である。
- iii)カテコール類の位置多様性・脱水素型クロスカップリング。オキシインドール(X=NBoc、X=NH)あるいはベンゾフラノン(X=O)二量体のホモリシスにより生じる持続性ラジカルを鍵活性種として用いる。
- 注1)Yoshihiro Sohtome, Masumi Sugawara, Daisuke Hashizume, Daiki Hojo, Miki Sawamura, Atsuya Muranaka, Masanobu Uchiyama, Mikiko Sodeoka, Heterocycles, doi: 10.3987/COM-16-S(S)75
- 注2)Rikako Ohnishi, Masumi Sugawara, Mai Akakabe, Tetsuya Ezawa, Hiroyuki Koshino, Yoshihiro Sohtome, Mikiko Sodeoka, Asian J. Org. Chem. doi: 10.1002/ajoc.201900300
研究手法と成果
研究グループは、2017年にN-Boc-2-オキシインドール二量体(以下、オキシインドール二量体)が取り扱いやすい持続性ラジカル前駆体であることを見いだしていました(図2)注1)。
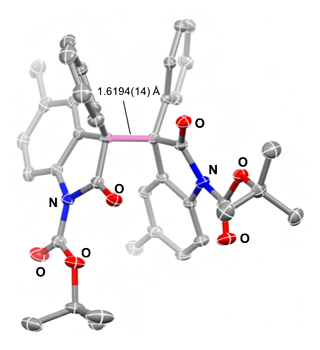
図2 持続性ラジカル前駆体N-Boc-2-オキシインドール二量体のX線結晶構造解析
この化合物の単量体同士を結び付けている、ピンク線で示したC(sp3)-C(sp3)結合の長さ(1.6194Å)は、標準的なC(sp3)-C(sp3)結合の長さ(1.53Å)よりも著しく長い。そのため、反応溶媒を加熱するだけで持続性ラジカルが発生する。なお、N-Bocは、インドールのNにtert-ブトキシカルボニル基(CH3)3C-O-C(=O)-が結合していることを意味する。
研究グループは、このオキシインドール(あるいはベンゾフラノン)持続性ラジカル前駆体をフェノール類と選択的に反応させることができれば、フェノール類同士のホモカップリングが抑制され、また、フェノールと相互作用する適切な触媒を添加することで、フェノールの反応位置を制御できるのではないかと考えました。酸素分子を酸化剤として用いる酸化反応では、フラスコ内で酸素が変換されて生じる活性酸素[6]や水により、触媒の活性が失われることが問題となります。そこで、袖岡研究室が開発した、水や酸素に対しても安定な性質を持つ「パラジウム(Pd)錯体触媒」注3,4)を用いました。
まず、持続性ラジカルの前駆体であるオキシインドール二量体と4位に置換基を持つカテコールを反応させました。すると、触媒を用いない反応条件では、カテコールの6位にC-C結合が形成されたC(6)生成物が選択的に合成されるのに対し、Pd錯体触媒を用いるとカテコールの5位にC-C結合が形成されたC(5)生成物が合成されることが分かりました(図3)。
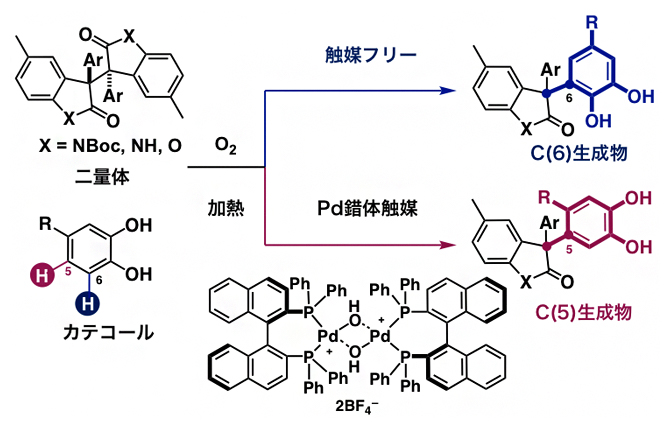
図3 二量体と4位置換型カテコールとの位置多様性・脱水素型クロスカップリング反応
オキシインドール(X=NBoc、X=NH)あるいはベンゾフラノン(X=O)二量体を持続性ラジカル前駆体として用い、カテコールとのクロスカップリング反応を試みた。触媒を用いない反応条件では、カテコールの6位にC-C結合が形成されたC(6)生成物が選択的に合成されるのに対し、Pd錯体触媒を用いるとカテコールの5位にC-C結合が形成されたC(5)生成物が合成されることが分かった。
- 注3)Akio Fujii, Emiko Hagiwara, Mikiko Sodeoka, J. Am. Chem. Soc. doi:10.1021/ja9902827.
- 注4)Mikiko Sodeoka, Yoshitaka Hamashima, Chem. Commun. doi:10.1039/B911015A.
もともと持続性ラジカルの前駆体として用いたオキシインドールあるいはベンゾフラノン二量体は、対応する単量体からフェリシアン化カリウム(K3[Fe(CN)6])を酸化剤として用いて合成していました。ところが、さらなる検討の結果、二量体でなく単量体を出発原料として用いても、位置多様性・脱水素型クロスカップリング反応が進行することが分かりました。つまり、触媒を用いない反応条件では、酸素分子の代わりにK3[Fe(CN)6]を酸化剤として用いることで、単量体からC(6)生成物を得られます。また、Pd錯体触媒を添加した反応条件では、酸素分子を酸化剤として用い、二量体を用いた場合と同じように単量体からC(5)生成物を選択的に合成できました(図4)。
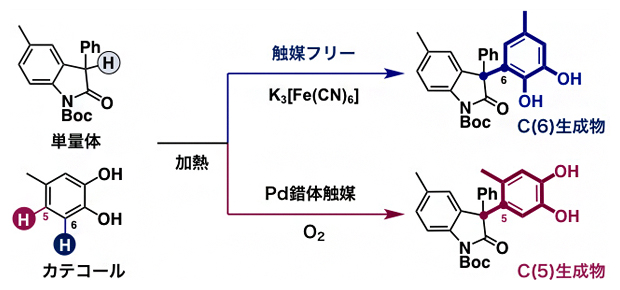
図4 単量体と4位置換型カテコールとの位置多様性・脱水素型クロスカップリング反応
単量体(図ではオキシインドール単量体)を持続性ラジカル前駆体として用い、カテコールとのクロスカップリング反応を試みた。触媒を用いない反応条件では、酸素分子の代わりにフェリシアン化カリウム(K3[Fe(CN)6])を酸化剤として用いることで、C(6)生成物を得ることができる。また、Pd錯体触媒を添加した反応条件では、酸素分子を酸化剤として用い、二量体を用いた場合と遜色のなく単量体からC(5)生成物を選択的に合成できる。
次に、Pd錯体触媒がどのように位置選択性を制御するのか、その仕組みについて理解するために紫外・可視吸収スペクトルの測定を行いました(図5)。その結果、Pd錯体触媒とカテコールを混合させた場合の吸収スペクトルは、Pd錯体触媒単独の吸収スペクトルと比べて大きく変化しました。一方、Pd錯体触媒と二量体の混合溶液や、Pd錯体触媒と単量体の混合溶液では、この変化は観察されませんでした。このことから、Pd錯体触媒はカテコールと相互作用しやすいことが明らかになりました。
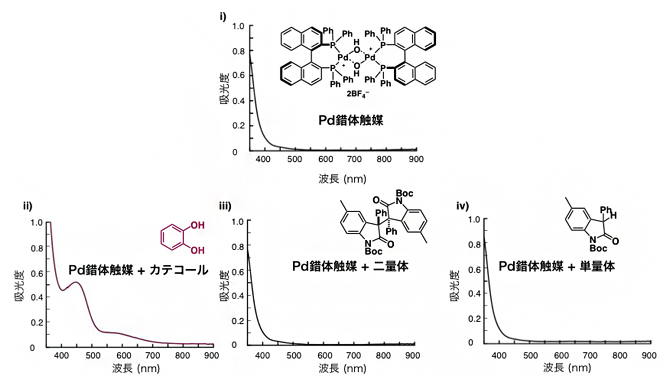
図5 紫外可視吸収スペクトル測定の結果
i)はPd錯体触媒の吸収スペクトル。ii)はPd錯体触媒とカテコールを1:40、iii)はPd錯体触媒とオキシインドール二量体を1:10、iv)はPd錯体触媒とオキシインドール単量体を1:10で混合させた場合の吸収スペクトル。混合比は、最適化された反応条件に準じている。ii)がi)に比べて大きく変化したことから、Pd錯体触媒はカテコールと相互作用しやすいことが分かった。
以上の実験的知見をもとに、Pd錯体触媒の役割を明らかにするため、密度汎関数計算[7]による解析を行いました(図6)。開発した脱水素型クロスカップリング反応は、次のような多段階反応を経て進行すると考えられます。
まず、二量体がホモリシスにより持続性ラジカルとなります(ラジカル化反応)。一方、Pd錯体触媒はカテコールのプロトン(水素イオン)を引き抜き、「Pd-カテコレート錯体」が形成されます(酸/塩基反応)。このPd-カテコレート錯体は、持続性ラジカルを安定化する役割を果たします(中間体I)。次の反応位置が決定される芳香族ラジカル置換反応の活性化エネルギー[7]は、中間体II-C(5)生成物を与える遷移状態[7]-C(5)(23.6kcal/mol)の方が、中間体II-C(6)生成物を与える遷移状態-C(6)(26.9kcal/mol)よりも小さいことが分かりました。これは前者の方が後者よりも反応速度が速く、選択的に起こることを意味しています。また、中間体IIのエネルギーの方が中間体Iのエネルギーよりも大きいことから、芳香族ラジカル置換反応は吸熱反応であることも分かりました。通常の発熱反応と異なり、吸熱反応では逆反応が進行してしまうため、実現が難しいと考えられており、これまで吸熱反応を含む反応の開発は見逃されてきました。一方、開発した反応では、中間体IIは酸素分子と反応し芳香族化されること(酸化的芳香族化)で、より安定な最終生成物のC(5)生成物およびC(6)生成物へと変換されることが明らかになりました。
この結果は、ラジカル・酸/塩基反応の協奏により、脱水素型クロスカップリング反応において反応位置を制御できることを示しています。また、吸熱反応と酸化反応を連続的に進行させることで、新しい反応が開発できる可能性が示されました。
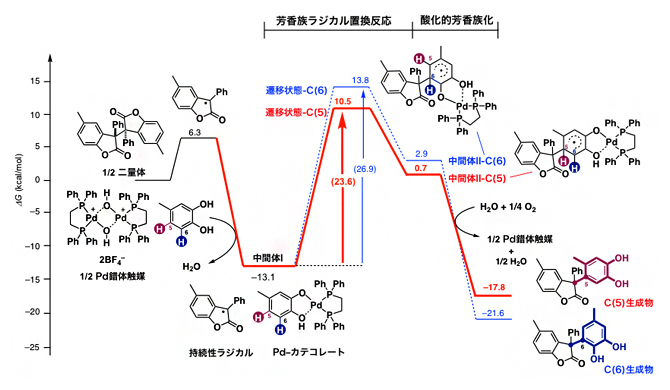
図6 密度汎関数計算による反応機構解析
密度汎関数計算により、Pd錯体触媒がどのようにC(5)生成物を選択的に与えるのか反応機構を解析した。図では、ベンゾフラノン二量体を用いた場合を示している。C(5)生成物を与える遷移状態-C(5)の活性化エネルギー(赤矢印)方が、C(6)生成物を与える遷移状態-C(6)の活性化エネルギー(青矢印)よりも小さいことから、遷移状態-C(5)を与える反応の方が選択的に起こる。中間体Ⅱよりも中間体Ⅰのエネルギーが大きいことから、この芳香族ラジカル置換反応が吸熱反応であることが分かる。その後、酸化的芳香族化により、赤で示した反応経路を経て、C(5)生成物が生成する。
今後の期待
今回研究グループは、カテコールの反応位置を制御可能な位置多様性・脱水素型クロスカップリング反応を開発しました。また有機合成化学、分光学、計算科学の三つのアプローチを組み合わせることで、Pd錯体触媒がどのようにC(5)生成物を選択的に与えるのかについてその仕組みを明らかとしました。新たに見いだしたラジカル・酸/塩基の協奏的反応機構は、今後、新しい反応および触媒を開発するための有用な設計指針になることが期待できます。
補足説明
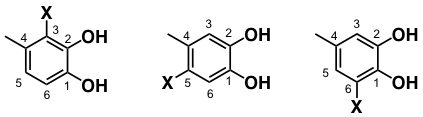
- 1.位置異性体
構造異性体の一種。本研究では、ベンゼン環上の置換様式が異なる異性体を指す。4位置換型カテコール類の場合、置換基Xの置換される位置の違いにより、3種の異性体の生成が考えられる。
- 2.ホモリシス
二つの電子で構成される共有結合の開裂の様式の一つで、生じる二つのフラグメント(AおよびB)に電子が一つずつ分配される。

- 3.持続性ラジカル
ラジカルは不対電子を持つ化学種のこと。持続性ラジカルは、共役による非局在化や立体効果により速度論的安定化を受けるため、半減期が0.001秒より著しく長いラジカルの総称。持続性ラジカルよりも室温で長寿命のために単離できる安定ラジカル(長寿命ラジカル)や、半減期が0.001秒より短く反応性が極めて高い反応性ラジカル(短寿命ラジカル)と区別される場合が多い。 - 4.カテコール類
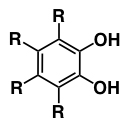
フェノール類の一種で、ベンゼン環上のオルト位に2個のヒドロキシ基を持つ有機化合物の総称。
- 5.ビルディングブロック
医薬や農薬の多くは複雑な構造の有機化合物であり、通常はプラモデルのように複数の部品を組み立てて作られる。この部品に相当する化学変換しやすい小さな分子をビルディングブロックと呼ぶ。 - 6.活性酸素
酸素がより反応性の高い化合物に変化したものの総称。一般的にスーパーオキシドアニオンラジカル(スーパーオキシド)、ヒドロキシルラジカル、過酸化水素、一重項酸素の4種類とされる。 - 7.密度汎関数計算、遷移状態、活性化エネルギー
「密度汎関数計算」は、原子や分子などの物性を明らかにする量子化学計算手法の一つ。反応が進行する際に最もエネルギーが高い状態を「遷移状態」と呼び、基底状態とのエネルギー差が「活性化エネルギー」である。遷移状態は、エネルギーが高く不安定なため実験的には観測は困難であるが、量子化学計算によりその構造を見ることができる。
研究グループ
理化学研究所
開拓研究本部 袖岡有機合成化学研究室
特別研究員(研究当時) 菅原 真純(すがわら ますみ)
研修生(研究当時) 大西 理華子(おおにし りかこ)
テクニカルスタッフⅠ 赤壁 麻依(あかかべ まい)
研修生(研究当時) 澤村 美紀(さわむら みき)
特別研究員(研究当時) 北條 大樹(ほうじょう だいき)
(理研 環境資源科学研究センター 触媒・融合研究グループ 特別研究員)
専任研究員 五月女 宜裕(そうとめ よしひろ)
(理研 環境資源科学研究センター 触媒・融合研究グループ 専任研究員)
主任研究員 袖岡 幹子(そでおか みきこ)
(理研 環境資源科学研究センター 触媒・融合研究グループ グループディレクター)
環境資源科学研究センター 触媒・融合研究グループ
特別研究員 江澤 哲也(えざわ てつや)
創発物性科学研究センター 物資評価支援チーム
チームリーダー 橋爪 大輔(はしづめ だいすけ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金新学術領域研究(研究領域提案型)「金属中心キラリティー内包型錯体が構築する多点不斉反応場の理解と制御(研究代表者:五月女宜裕)」、同挑戦的研究(萌芽)「触媒反応を駆使した生物活性シード創出への挑戦 (研究代表者:五月女宜裕)」、同基盤(B)「有機合成化学が切り拓くケミカルメチロームの新展開(研究代表者:五月女宜裕)」による支援を受けて行われました。
原論文情報
- Masumi Sugawara, Rikako Ohnishi, Tetsuya Ezawa, Mai Akakabe, Miki Sawamura, Daiki Hojo, Daisuke Hashizume, Yoshihiro Sohtome, Mikiko Sodeoka, "Regiodivergent Oxidative Cross-Coupling of Catechols with Persistent tert-Carbon Radicals", ACS Catalysis, 10.1021/acscatal.0c03986
発表者
理化学研究所
開拓研究本部 袖岡有機合成化学研究室
特別研究員(研究当時) 菅原 真純(すがわら ますみ)
専任研究員 五月女 宜裕(そうとめ よしひろ)
(理研 環境資源科学研究センター 触媒・融合研究グループ 専任研究員)
主任研究員 袖岡 幹子(そでおか みきこ)
(理研 環境資源科学研究センター 触媒・融合研究グループ グループディレクター)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
