理化学研究所(理研)生命医科学研究センター融合領域リーダー育成プログラムの井上梓上級研究員らの研究グループは、マウスを用いて、卵のエピジェネティック修飾[1]が次世代の胎盤へと伝承される新しい機構を発見しました。
本研究成果は、受精卵に遺伝子異常がなくても発生に異常が生じる新たな仕組みを解明したものであり、将来的に不妊症の原因解明に繋がることが期待されます。
これまで井上上級研究員らは、卵巣内の卵母細胞(親世代)に存在するヒストン[2]H3の27番目リジン(K)のトリメチル化修飾(H3K27me3)が、受精後の胚(次世代)に伝承されること[3]を明らかにしていました。しかし、卵母細胞においてH3K27me3がどのように確立され、受精後にどのように伝承されるのかはよく分かっていませんでした。
今回、研究グループは、ヒストンH2Aのモノユビキチン化修飾(H2Aub)がH3K27me3の確立と伝承に重要な役割を果たすことを見いだしました。つまり、卵においてH2Aubが減少すると、一部の遺伝子におけるH3K27me3が消失し、その消失状態が不可逆的に次世代に伝承されて、胎生期の部分致死と胎盤の過形成が引き起こされることを示しました。
本研究は、科学雑誌『Nature Genetics』の掲載に先立ち、オンライン版(4月5日付:日本時間4月6日)に掲載されます。
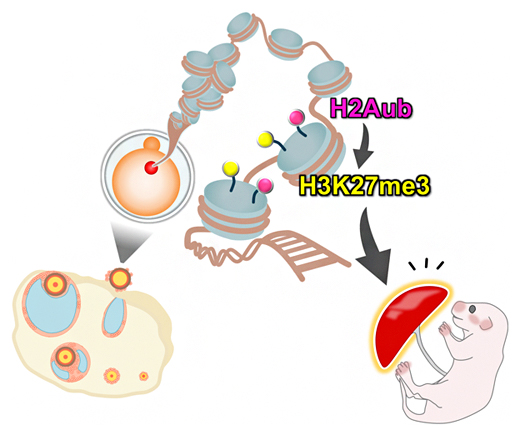
卵から胎盤に母性伝承されるヒストン修飾H3K27me3の確立と維持にはH2Aubが必要である
背景
ゲノムは、細胞分裂時に母細胞から娘細胞に受け継がれます。このとき、娘細胞でも母細胞の性質が保たれるように、ゲノムに上書きされた"記憶"も一緒に受け継がれます。この記憶を担う生体機構が「エピジェネティック修飾」です。
親世代の卵や精子(配偶子)から子世代の受精胚へと世代が切り替わるときには、親の"記憶"は消去されると考えられてきました。しかし近年、この記憶の一部が次世代に受け継がれることが分かってきています。これを「エピジェネティック修飾の世代間伝承」といいます。
このような伝承能力を持つエピジェネティック修飾として、DNAのメチル化修飾[4]が以前から知られていましたが、井上梓上級研究員らは近年、卵に存在するヒストン修飾の一つであるH3の27番目リジン(K)のトリメチル化修飾(H3K27me3)も伝承能力を持つことを明らかにしました注1)。しかし、H3K27me3が卵においてどのように確立されてどのように伝承されるのか、そして何のために伝承されるのかはよく分かっていませんでした。
- 注1)Inoue A, Jiang L, Lu F, Suzuki T, Zhang Y. (2017) Maternal H3K27me3 controls DNA methylation-independent imprinting. Nature .2017; 547(7664), 419-24.
研究手法と成果
これらの疑問に答えるため、研究グループはES細胞[5]においてH3K27me3と相互作用することが知られているヒストンH2Aの119番目リジンのモノユビキチン化修飾(H2Aub)に注目しました。まず、ごく少数の細胞からエピジェネティック修飾の分布を調べることができる最新の技術を用いて、マウスの卵と初期胚におけるH2Aubの動態を詳しく調べました。その結果、卵巣内の卵形成過程から受精後の胚盤胞期まで、伝承能力のあるH3K27me3にはH2Aubが常に共局在することが分かりました(図1)。
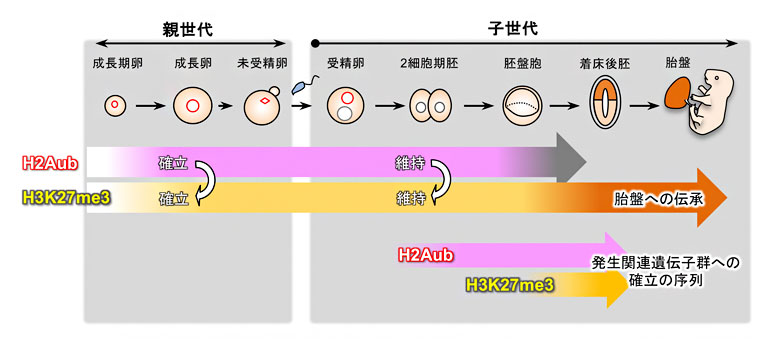
図1 卵形成(親世代)から胚発生(子世代)のH2AubとH3K27me3の動態の概要
H2AubとH3K27me3は卵巣内での卵形成過程で確立され、受精後も胚盤胞期まで維持される。H3K27me3は着床後に胎盤に伝承される(正確にいえば、胎盤ではDNAメチル化に転換されるが、ここでは説明を省く)。H2Aubは一部の伝承性H3K27me3の確立と維持に必須である。また、発生関連遺伝子群においては、2細胞期胚でH2Aubが付加され、H3K27me3は胚盤胞期以降に付加される。
続いて、卵形成過程におけるH3K27me3の確立にH2Aubが必要かどうかを調べるために、H2Aub修飾に必要なタンパク質Pcgf1/6[6]を欠損させた卵を作製しました。Pcgf1/6欠損卵のH3K27me3の分布を調べたところ、一部の遺伝子においてH3K27me3が確立されなくなっていました。この卵を受精させて、着床前胚におけるH3K27me3の分布を調べたところ、この胚ではH3K27me3が欠落したまま発生していくことが分かりました(図2A)。その結果、母性H3K27me3依存的なゲノム刷り込み[7]が破綻し、着床後には約半数の胚が胎生致死になること(胎生部分致死)、そして残りの半分は生誕するものの胎盤が過形成することなどを見いだしました(図2B, C)。
これらの結果から、H2Aubは伝承性H3K27me3の確立に重要であり、それが破綻すると着床後の胚発生と胎盤形成に異常が生じることが示されました。
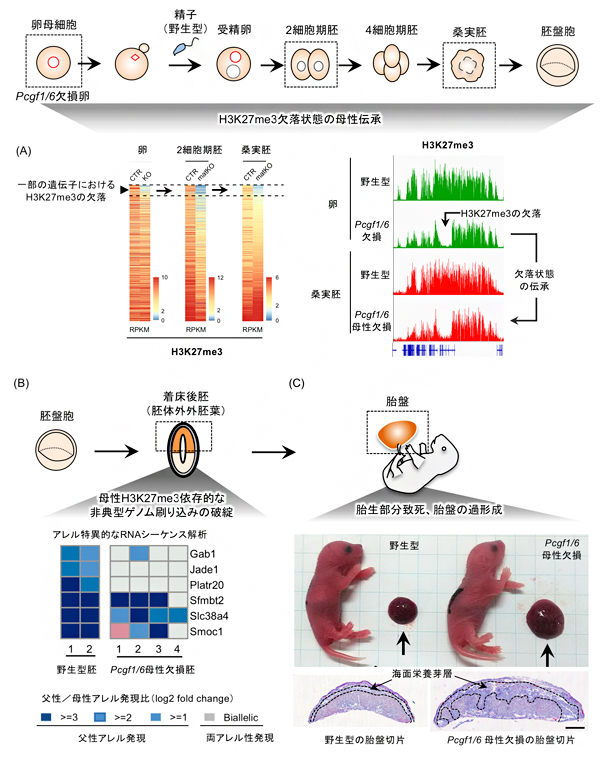
図2 Pcgf1/6母性欠損胚(Pcgf1/6欠損卵と野生型の精子を受精させた胚)の表現型の一部
- (A)左のヒートマップは、野生型胚(CTR)とPcgf1/6母性欠損胚(matKO)における母性アレルのH3K27me3修飾の相対量を示す。右は、欠落したH3K27me3が母性伝承される遺伝子の例を示す。
- (B)着床後の胚体外外胚葉における非典型ゲノム刷り込み遺伝子の父母アレル発現比を示す。野生型胚(CTR)では父性アレル発現(青)する遺伝子の一部が、Pcgf1/6母性欠損胚においては両アレル性発現する(灰色)。
- (C)出生時点での胎児と胎盤の写真。下は胎盤の組織学的解析。過形成胎盤では海面栄養芽層の増大が認められる。
なお本研究に付随して、発生学的に重要な別の知見が得られました。器官形成などに関わる数千個の発生関連遺伝子群にはH2AubとH3K27me3が共局在して、その発現を制御するというのが通説です。しかし今回、着床前胚においてはH2Aubが単独でこの遺伝子群に存在し、着床期にようやくH3K27me3が付与されることが分かりました(図1)。
エピジェネティック修飾が適切なゲノム位置に付与される機構については、世界中で活発に研究が行われています。なかでも、ポリコーム抑制複合体[6]がどのような序列で発生関連遺伝子群にH2AubとH3K27me3を付与するのかについては、当該分野においても見解が別れるところでした。今回、最先端の技術を用いて初期発生過程におけるH2Aubの動態を世界で初めて観察できたことで、生体内ではH2AubがH3K27me3に先立って確立されることを示せました。着床前胚においてH2Aubだけが存在することにどのような意味があるのか、今後の研究が待たれます。
今後の期待
卵や精子(配偶子)から胚へと伝承されるエピジェネティック修飾は、生物学的にも医学的にも重要であり、注目されています。なぜなら、ゲノムと違いエピジェネティック修飾は環境によって変化し得ることが知られており、個体の環境により配偶子のエピジェネティック修飾が変化する可能性があるためです。
今回、卵のエピジェネティックな変化が伝承されて、それが着床後の胚発生や胎盤形成に長期的な影響を及ぼすことが明らかになりました。このようなエピジェネティクス伝承機構を介して(ゲノム配列の変化を伴わずに)、親の生活習慣が将来生まれてくる子供の疾患素因に寄与するようなことがあるかもしれません。今後は、伝承機構のさらなる理解を進めるとともに、同様の機構がヒトを含む他の種でも保存されているかどうかの解明が待たれます。
補足説明
- 1.エピジェネティック修飾
細胞には、自身の膨大なゲノム情報から必要な情報だけを取り出すための「ゲノムの取扱説明書」のような機構が備わっている。エピジェネティック修飾はその主要な機構の一つである。エピジェネティック修飾の分子実体は、DNAメチル化などのDNA自体への化学修飾と、DNAを収納するタンパク質であるヒストンへの化学修飾が主である。これらのエピジェネティック修飾がゲノム内の適切な場所に配置することで、必要に応じた遺伝子を発現させることができる。エピジェネティック修飾が適切に配置される機構については、現在世界中で活発に研究が行われている最中であり、本研究もその一つと位置付けられる。 - 2.ヒストン、ヒストン修飾
ヒストンには、H2A, H2B, H3, H4の4種類がある。それらが複合体を形成して、その周囲をDNAが巻き付く形ようにして核内に収納される。ヒストンタンパク質のアミノ酸残基にはさまざまな化学修飾が付加され、これをヒストン修飾という。H3K27me3はヒストンH3の27番目のリジン残基(K)に三つのメチル基(トリメチル化)が付加したものである。H2Aubは、ヒストンH2Aの119番目のリジン残基に一つのユビキチン分子が付加したものである。ヒストン修飾はそれ自身の化学的、物理的作用により機能を発揮する場合と、別のタンパク質が結合することにより機能を発揮する場合がある。 - 3.H3K27me3の伝承
卵や精子のヒストン修飾の多くは受精直後に消失する。しかし、卵のH3K27me3は受精後も着床前発生を通じて維持される。そのため、着床前胚においては母性染色体(卵由来の染色体)だけが遺伝子発現の抑制に働くH3K27me3を持つ状態になる。その結果、H3K27me3を持たない父性染色体から遺伝子発現が許容されて、片アレル性の遺伝子発現(ゲノム刷り込み)が起こる。このような母性H3K27me3依存的なゲノム刷り込みは、着床後には胎盤や卵黄嚢などの胚体外組織で維持される。この刷り込み機構はDNAメチル化による典型刷り込みと区別されて、非典型刷り込みと呼ばれる。 - 4.DNAのメチル化修飾
DNAはアデニン、グアニン、シトシン、チミンの四つの塩基から構成され、シトシンにはメチル基が付加される。これをDNAメチル化修飾といい、遺伝子発現の制御に寄与する。配偶子の一部のゲノム領域のDNAメチル化修飾は、次世代に伝承されてゲノム刷り込みを制御する。DNAメチル化による典型ゲノム刷り込みは胚体組織でも維持される。 - 5.ES細胞
脊椎動物の初期胚が持つ、全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。ES細胞は、哺乳類の着床前胚(胚盤胞)に存在する内部細胞塊から作製された多能性幹細胞のこと。 - 6.Pcgf1/6、ポリコーム抑制複合体
ヒストンH2Aには1つのユビキチン分子が付加される(H2Aub)。プロテアソームで分解される多分子のユビキチン化(ポリユビキチン化)とは異なり、モノユビキチン化は分解されずにエピジェネティック修飾として機能し、遺伝子発現の制御に中心的な役割を果たす。H2Aubの付加にはポリコーム抑制複合体1(PRC1)が必須である。polycomb group ring finger 1 (Pcgf1) とpolycomb group ring finger 6 (Pcgf6)は、PRC1の構成タンパク質の一種である。H3K27me3の付加はポリコーム抑制複合体2(PRC2)が担う。 - 7.ゲノム刷り込み
卵と精子にそれぞれ異なるゲノム領域に刻まれたエピジェネティック修飾が受精後も受け継がれることで、父由来の染色体と母由来の染色体のどちらか一方のみが機能を発揮する遺伝子発現の制御機構。DNAメチル化依存的な典型刷り込みとH3K27me3依存的な非典型刷り込みの2種類の機構がある。H3K27me3とDNAメチル化はそれぞれ異なる刷り込み遺伝子群を制御する。
研究グループ
理化学研究所 生命医科学研究センター
融合領域リーダー育成プログラム
上級研究員 井上 梓(いのうえ あずさ)
特別研究員 メイ・ハイリャン(Mei Hailiang)
テクニカルスタッフⅡ 公文 麻美(くもん まみ)
免疫器官形成研究チーム
基礎科学特別研究員 小塚 智沙代(こづか ちさよ)
チームリーダー 古関 明彦(こせき はるひこ)
疾患遺伝研究チーム
研修生 林 凌也(はやし りょうや)
研究支援
本研究は、文部科学省科学研究費補助金新学術領域研究(研究領域提案型)「全能性プログラム:デコーディングからデザインへ(領域代表:小倉淳郎)」における「全能性消失時のエピゲノム制御機構の解明(研究代表者:井上梓)」、「多様かつ堅牢な細胞形質を支える非ゲノム情報複製機構(領域代表:中西真)」における「ポリコム群による抑制ドメインの複製機構の解明(研究代表者:古関明彦)」、日本学術振興会(JSPS)卓越研究員事業「Dissecting the molecular basis of oocyte-mediated transgenerational inheritance(研究代表者:井上梓)」、JSPS科学研究費補助金基盤研究B「母性ヒストンによるゲノムインプリンティングの生理的意義の解明(研究代表者:井上梓)」、基盤研究A「DNMT1によるポリコム抑制ドメインの形成及びその生物学的な意義の解明(研究代表者:古関明彦)」、日本医療研究開発機構(AMED)革新的先端研究開発支援事業「全ライフコースを対象とした個体の機能低下機構の解明(研究開発総括:西田栄介)」PRIME「代謝疾患の母子間エピゲノム遺伝機構の解明(研究代表者:井上梓)」、「エピゲノム研究に基づく診断・治療へ向けた新技術の創出(研究開発総括:山本雅之)」AMED-CREST「エピジェネティクスによるエンハンサー動態制御メカニズムの解明と細胞機能制御への応用(研究代表者:古関明彦)」、上原財団助成金「胎盤を介した肥満体質の遺伝機構の解明(研究代表者:井上梓)」、理研横断エピゲノム操作プロジェクト(研究代表者:井上梓、古関明彦)による支援を受けて行われました。
原論文情報
- Hailiang Mei, Chisayo Kozuka, Ryoya Hayashi, Mami Kumon, Haruhiko Koseki, and Azusa Inoue, "H2AK119ub1 guides maternal inheritance and zygotic deposition of H3K27me3 in mouse embryos", Nature Genetics, 10.1038/s41588-021-00820-3
発表者
理化学研究所
生命医科学研究センター 融合領域リーダー育成プログラム
理化学研究所 生命医科学研究センター 融合領域リーダー育成プログラム
上級研究員 井上 梓(いのうえ あずさ)
 井上 梓
井上 梓
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
