理化学研究所(理研)の間陽子客員研究員(科技ハブ産連本部バトンゾーン研究推進プログラム辨野特別研究室(研究当時)、現 東京大学大学院農学生命科学研究科農学国際専攻特任教授)、日本大学医学部内科学系血液膠原病内科分野・総合科学研究所の武井正美教授、中川優助教、飯村一樹客員研究員、東京大学大学院農学生命科学研究科農学国際専攻のロー・チェ・ウェン博士課程大学院生(3年)、松浦遼介特任助教、光量子工学研究センター光量子制御技術開発チームの和田智之チームリーダーらの共同研究グループは、紫外線[1]照射による新型コロナウイルス(SARS-CoV-2)の不活化はウイルスRNA[2]の損傷が原因であることを初めて明らかにしました。
本研究成果は、SARS-CoV-2およびその変異株のみならず、新たな社会的脅威となり得る未知のウイルス感染症の克服に貢献するものと期待できます。
これまで、多様な空間、物体表面、液体に応用できる紫外線を用いたSARS-CoV-2の不活化が注目され、222ナノメートル(nm、1nmは10億分の1メートル)や254nmおよび280~310nmの波長の紫外線の有効性が報告されています。しかし、紫外線がSARS-CoV-2を不活化するメカニズムは明らかになっていませんでした。
今回、共同研究グループは、波長253.7nmの紫外線を液体培地中のSARS-CoV-2に照射し、ウイルスの感染性が99.99%減少することを実証しました。さらに、このSARS-CoV-2の不活化の仕組みはウイルスRNAの損傷にあり、ウイルスタンパク質やウイルス粒子の形状には変化がないこと突き止めました。
本研究は、科学雑誌『Scientific Reports』オンライン版(7月5日付)に掲載されます。
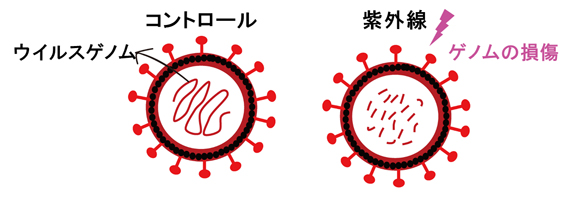
波長253.7nmの紫外線照射によるウイルスRNA損傷を示す概念図
背景
2019年に発生した新型コロナウイルス(SARS-CoV-2)は、新型コロナウイルス感染症(COVID-19)として、パンデミックと呼ばれる世界的大流行を引き起こし、人間の生命と社会・経済に大きな打撃を与えています。SARS-CoV-2の感染経路は多岐にわたり、飛沫やエアロゾル[3]に含まれるウイルスだけでなく、机や壁あるいは携帯電話など物体表面に付着したウイルスが体内に侵入することでも感染が成立し得ると考えられています。
そこで、多様な空間、物体表面、液体に応用できる「紫外線」を用いたSARS-CoV-2の不活化が注目され、222ナノメートル(nm、1nmは10億分の1メートル)や254nmおよび280~310nmの波長の紫外線の有効性が報告されています。しかし、紫外線がSARS-CoV-2を不活化するメカニズムは明らかになっていませんでした。
研究手法と成果
共同研究グループは、日本大学医学部内のBSL3施設において、SARS-CoV-2を含む液体培地に30センチメートルの距離から、抗ウイルス効果を持つことが知られており、既存の最も安価かつ容易に得られ実用化されている253.7nmの紫外線を500μW/cm2の放射照度で、30秒間照射する実験を行いました(図1A)。すると、時間依存的な感染性(ウイルス力価[4])の減少が確認され、30秒間の照射でSARS-CoV-2の感染性が99.99%減少することが分かりました(図1B)。
しかし、99.99%感染性が減少したSARS-CoV-2を電子顕微鏡で観察したところ、紫外線の照射前後で形態の変化は全く見られませんでした(図1C)。また、ウェスタンブロッティング法[5]でSARS-CoV-2の構造タンパク質であるスパイクタンパク質(Sタンパク質)[6]とヌクレオカプシドタンパク質(Nタンパク質)[7]の量を測定した結果、紫外線の照射の有無でウイルスタンパク質の量に顕著な差異は認められませんでした(図1D)。
また、SARS-CoV-2の持つウイルスRNAの量を現行の医療現場でウイルスの検出のために汎用されているqPCR法(定量PCR法)[8]で測定しても、紫外線の照射の有無で顕著な差異は確認されませんでした。そこで、ウイルスRNA損傷の計測により適したqPCR法を独自に開発し、紫外線照射前後でのウイルスRNA量を測定したところ、30秒間の紫外線の照射によって、有意なウイルスRNA量の減少(ウイルスゲノムの損傷)が確認されました(図1E)。
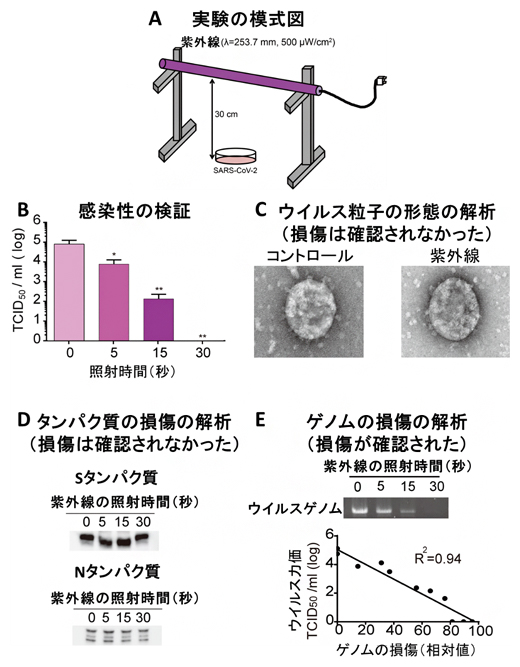
図1 紫外線によるSARS-CoV-2の不活化の検証実験
- A)紫外線の照射方法の模式図。
- B)縦軸は感染性(ウイルス力価)を示す。紫外線を照射することで、時間依存的にSARS-CoV-2のウイルス力価が有意に減少した。30秒間の照射で感染性が99.99%減少した。
- C)紫外線を60秒間照射したSARS-CoV-2の形態を電子顕微鏡で観察したが、紫外線照射の有無で顕著な差異は認められなかった。
- D)ウェスタンブロッティング法によって、ウイルスタンパク質(Sタンパク質とNタンパク質)量を比較したが、紫外線照射前後で変化は見られなかった。
- E)新しく開発したqPCR法により、紫外線の照射時間依存的にウイルスゲノムの損傷が確認された。また、このゲノムの損傷はウイルス力価の減少と高い相関性を示した。
さらに、現行のqPCR法に用いられているNタンパク質をコードする遺伝子領域だけでなく、ウイルスゲノムの全領域をカバーする6種類(図2A:領域1~4、S遺伝子、N遺伝子)のRNA量を測定するqPCR法を新たに開発し、ウイルスRNA量を測定したところ、ウイルスゲノムの全ての領域において、照射時間に依存したウイルスRNA量の減少が見られました(図2A-C)。そして、ウイルスRNA量の減少はウイルス力価の減少と非常に高い相関性を示しました(図2D)。
これらの結果から、紫外線照射によるSARS-CoV-2の不活化はウイルスRNAの損傷によるものであることが示されました。また、紫外線はウイルスゲノムの全領域に損傷を与え、速やかに不活化することが分かりました。
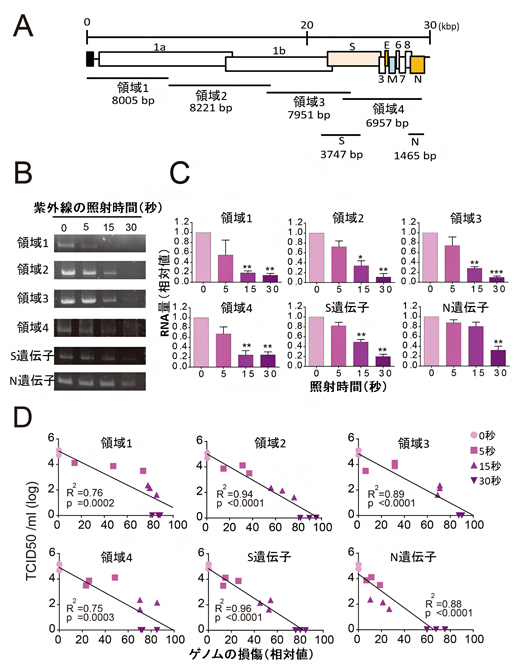
図2 紫外線による全領域にわたるウイルスゲノムの損傷の測定
- A)6種類のウイルスRNA量(領域1~4、N遺伝子、S遺伝子)を測定するqPCR法を開発した。
- B)開発したqPCR法を用いて、紫外線を照射したSARS-CoV-2から抽出したRNAをDNAに逆転写し、増幅した。その結果、照射時間依存的なDNA量の減少が見られた。
- C)Bの各バンド濃度を測定した結果、全ての領域において、有意なDNA量の減少が確認された。
- D)縦軸は感染性(ウイルス力価)を示す。ウイルスゲノムの損傷とSARS-CoV-2の感染性(ウイルス力価)について線形解析を行った結果、両者の間に高い相関性が見られた。
今後の期待
本研究により、紫外線によるSARS-CoV-2の不活化のメカニズムがウイルスRNAへの損傷であることが世界で初めて立証されました。
紫外線によるSARS-CoV-2の除去は、さまざまな空間への応用が期待できます(図3)。特に、無人環境における壁面や床面、机やイスなどの効率的な紫外線殺菌、紫外線搭載ロボットによるウイルス除去などのクリーンな環境空間の構築に有効なツールであると考えられます。
また、薬剤やワクチンなどは、ウイルスへの作用部位や抗体の標的部位に変異が加わることで、ウイルスが抵抗性を獲得し、効果がなくなることがあります(図3)。しかし、紫外線はウイルスRNA全体を損傷させることから、現在、猛威を振るっている感染性の強い変異株や、今後発生し得る変異株にも有効であると考えられます。また、紫外線はポリオウイルスやノロウイルス、インフルエンザウイルスなどに効果があることが知られており、また新興感染症であるエボラウイルスやMERSウイルスを不活化することも報告されています。そのため、今後新たに発生する未知の新興感染症への応用も期待できます(図3)。
このように本研究成果は、「Withコロナ」あるいは「ポストコロナ」の社会を実現する安全・安心なクリーン空間の構築に貢献すると同時に、現在世界を震撼させている変異株や今後新たな社会的問題となり得る未知のウイルスの克服にもつながると期待できます。
![]() 左右にスクロールできます
左右にスクロールできます
| 紫外線 | ワクチン | |
|---|---|---|
| SARS-CoV-2への作用 | ウイルスタンパク質の損傷やウイルス粒子の形態の変化を伴わない ウイルスRNAの損傷による環境中のウイルスの不活性 |
獲得免疫の活性化 |
| 変異株への効果 | 同様の効果が期待される | 変異によって、免疫を回避されることがある |
| 新規ウイルスへの効果 | 同様の効果が期待される | ウイルスごとに開発が必要 |
| 利用 | 物体の表面上や水中、エアロゾル中のウイルスを不活性化できる | ウイルスの感染を直接防げる また、感染時の重症化を抑える |
| 欠点 | 生体に有害である | 開発期間が長く、ウイルスの変異によって効果がなくなることがある |
| 使用方法 | 物体の表面や水中、空気等の環境に照射する | 注射によって、接種する |
図3 紫外線とワクチンのSARS-CoV-2に対する効果の比較
補足説明
- 1.紫外線
波長が可視光よりも短い10nm~400nmの光。
本研究に用いた253.7nmの波長の紫外線は抗ウイルス効果を持つことが知られており、既存の最も安価かつ容易に得られる波長であるため、実用化に重要である。 - 2.ウイルスRNA
RNAをゲノムとするウイルス(RNAウイルス)が持つ遺伝子の総称。本研究に用いたSARS-CoV-2はRNAウイルスであり、ゲノムとして持つウイルスRNAをもとに感染をした細胞内で増殖する。 - 3.エアロゾル
気体中に浮遊する微小な液体または個体の粒子と気体の混合体の総称。SARS-CoV-2は、飛沫として放出された後に、エアロゾルとして空気中を漂い、このエアロゾルからも感染することが知られている。 - 4.ウイルス力価
感染性を持つウイルス量を表し、この値が高いほど感染性が高い。ウイルス感染価ともいう。本研究では、ウイルスを希釈し、どの希釈倍率まで細胞への感染性を持つかを測定するTCID50(50%培養細胞感染価)法を用いて、ウイルス力価を測定した。 - 5.ウェスタンブロッティング法
タンパク質検出法の一つであり、抗原抗体反応を利用して、目的のタンパク質を特異的に検出する。本研究では、SARS-CoV-2のSタンパク質およびNタンパク質を検出し、その量を測定した。 - 6.スパイクタタンパク質(Sタンパク質)
SARS-CoV-2の構造タンパク質の一種であり、ウイルス粒子の表面にスパイク状に存在する。細胞表面に存在するレセプター(ACE2)に結合し、ウイルス粒子の細胞内への侵入を調節する。 - 7.ヌクレオカプシドタンパク質(Nタンパク質)
SARS-CoV-2の構造タンパク質の一種であり、ウイルスRNAと結合し、ヌクレオカプシド(RNAを包む殻)を形成する。高い保存性と強い免疫原性(免疫応答を引き起こす能力)を持ち、コロナウイルスの診断の標的として使用されている。 - 8.qPCR法(定量PCR法)
ポリメラーゼ連鎖反応(PCR)を用いて、サンプル中の特定配列のDNAを増幅し、そのDNA量を測定する手法。本研究では、6種類のSARS-CoV-2のRNA量を測定するqPCR法を開発した。
共同研究グループ
理化学研究所
客員研究員 間 陽子(あいだ ようこ)
(科技ハブ産連本部 バトンゾーン研究推進プログラム 辨野特別研究室(研究当時)、現 東京大学大学院農学生命科学研究科農学国際専攻 特任教授)
光量子工学研究センター 光量子制御技術開発チーム
チームリーダー 和田 智之(わだ さとし)
客員主管研究員 神成 淳司(しんじょう あつし)
科技ハブ産連本部 バトンゾーン研究推進プログラム 辨野特別研究室
特別招聘研究員(研究当時) 辨野 義巳(べんの よしみ)
東京大学大学院農学生命科学研究科農学国際専攻
博士課程3年 ロー・チェ・ウェン(Chieh-Wen Lo)
特任助教 松浦 遼介(まつうら りょうすけ)
日本大学 医学部 内科学系血液膠原病内科学分野
総合科学研究所 教授 武井 正美(たけい まさみ)
助教 中川 優(なかがわ まさる)
客員研究員 飯村 一樹(いいむら かずき)
(株式会社ファームロイド 代表取締役)
日本大学医学部・医学部附属板橋病院と株式会社ファームロイド(住所:東京都板橋区)は、東京都板橋区と連携し、新型コロナウイルスの感染拡大対策や医療崩壊を防ぐための取り組みを行っています。
原論文情報
- Chieh-Wen Lo, Ryosuke Matsuura, Kazuki Iimura, Satoshi Wada, Atsushi Shinjo, Yoshimi Benno, Masaru Nakagawa, Masami Takei and Yoko Aida※, "UVC disinfects SARS-CoV-2 by induction of viral genome damage without apparent effects on viral morphology and proteins", Scientific Reports, 10.1038/s41598-021-93231-7(※責任著者)
発表者
理化学研究所
客員研究員 間 陽子(あいだ ようこ)
(東京大学大学院農学生命科学研究科農学国際専攻 特任教授)
光量子工学研究センター 光量子制御技術開発チーム
チームリーダー 和田 智之(わだ さとし)
 間 陽子
間 陽子
 和田 智之
和田 智之
日本大学 医学部内科学系血液膠原病内科分野
総合科学研究所 教授 武井 正美(たけい まさみ)
助教 中川 優(なかがわ まさる)
客員研究員 飯村 一樹(いいむら かずき)
(株式会社ファームロイド 代表取締役)
 武井 正美
武井 正美
 中川 優
中川 優
 飯村 一樹
飯村 一樹
東京大学大学院農学生命科学研究科農学国際専攻
博士課程3年 ロー・チェ・ウェン(Chieh-Wen Lo)
特任助教 松浦 遼介(まつうら りょうすけ)
 ロー・チェ・ウェン
ロー・チェ・ウェン
 松浦 遼介
松浦 遼介
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
日本大学医学部 内科学系血液膠原病内科分野
武井 正美
Email: takei.masami [at] nihon-u.ac.jp
東京大学大学院農学生命科学研究科
事務部 総務課 総務チーム 総務・広報情報担当
Tel: 03-5841-8179
Email: koho.a [at] gs.mail.u-tokyo.ac.jp
※上記の[at]は@に置き換えてください。
