理化学研究所(理研)脳神経科学研究センター神経老化制御研究チームの綿村直人研究員、西道隆臣チームリーダーらの国際共同研究グループは、アルツハイマー病(AD)[1]の初期病因因子アミロイドβペプチド(Aβ)[2]の分解酵素である「ネプリライシン[3]」の新しい活性制御メカニズムを発見しました。
本研究成果は、ADの予防・治療法の開発に貢献すると期待できます。
これまでに西道隆臣チームリーダーらは、脳内のAβの責任分解酵素としてネプリライシンを、その活性制御因子として脳内ペプチドであるソマトスタチン[4]を同定していました。しかし、ソマトスタチンがネプリライシン活性をどのように制御しているのかは明らかになっていませんでした。
今回、国際共同研究グループは培養細胞を用いたスクリーニングにより、ソマトスタチンの下流因子として、内因性のATP感受性Kチャネル[5](KATPチャネル)のリガンドとして働くα-endosulfine(ENSA)を同定しました。 次に、ネプリライシンの活性調節に関わるKATPチャネルのサブタイプの特定を試み、SUR1/Kir6.2[5]のサブタイプを同定しました。同定したサブタイプがADの治療標的となり得るのかを調べるために、KATPチャネルの開口薬であり、高インスリン血性低血糖症[6]治療薬の「ジアゾキシド[7]」をADモデルマウス[8]に投与したところ、ネプリライシンの活性が高まり、Aβ蓄積が減少し、認知機能の異常が回復しました。このことから、ジアゾキシドはドラッグリポジショニング[9]として、有望なAD治療薬となる可能性があることが分かりました。
本研究は、科学雑誌『Molecular Psychiatry』オンライン版(11月4日付)に掲載されました。
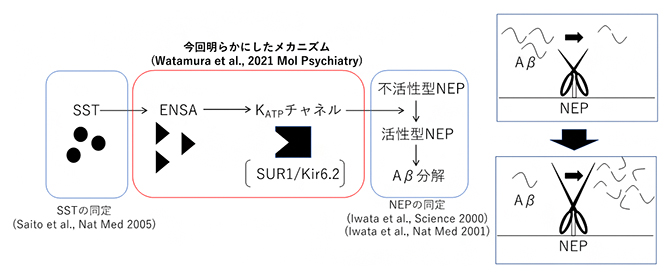
これまでに明らかにしたネプリライシンの活性制御メカニズム
背景
高齢化社会を迎えた日本では、加齢が主原因であるアルツハイマー病(AD)の患者数は年々増加する一方、いまだ予防法および治療法は確立されていません。介護などの社会的コストも膨大になり、医療経済的な圧迫も大きな社会問題となっています。
AD患者の脳では、初期病理として脳内にアミロイドβペプチド(Aβ)の凝集体である「老人斑」が形成され(アミロイド病理)、最終的に神経細胞死を引き起こす仮説が強く支持されています。家族性ADでは、Aβを作る前駆体および酵素群の遺伝子変異によってAβ量が増えるのに対し、全AD患者の99%を占める弧発性ADでは「なぜ脳内にAβが蓄積するのか」、その原因は特定されていません。
国際共同研究グループは、脳内Aβの蓄積はAβ分解システムの異常によるという仮説を立て、その全容を明らかにすることを目指しました。西道隆臣チームリーダーらは、これまでに脳内の主要なAβ分解として「ネプリライシン」を注1-2)、さらにネプリライシンの活性制御因子として、脳内ペプチドである「ソマトスタチン」を同定しています注3)。しかし、ソマトスタチンがどのようにしてネプリライシンの活性を調節しているのかはよく分かっていませんでした。
- 注1)2000年2月1日プレスリリース「脳内のβアミロイド分解系路を解明」
- 注2)2001年5月21日プレスリリース「孤発性アルツハイマー病の原因解明に大きく前進」
- 注3)Saito et al., Somatostatin regulates brain amyloid beta peptide Abeta42 through modulation of proteolytic degradation.Nat Med (2005)
研究手法と成果
国際共同研究グループはまず、培養細胞を用いてプロテオミクス[10]を行った結果、ソマトスタチンシグナルの下流において、ATP感受性Kチャネル(KATPチャネル)のリガンドとして機能するα-endosulfine(ENSA)を新たな内因性ネプリライシンの活性制御因子として同定しました。
次に、ENSAがマウス個体内でネプリライシンの活性調節に関与するのかを調べるために、ゲノム編集技術[11]を用いて、ENSAのノックアウトマウスを作製しました。作製したマウス脳内ではネプリライシンの活性が上昇しており、ADモデルマウス(App-KIマウス)と交配すると、Aβの蓄積量が低下しました(図1)。
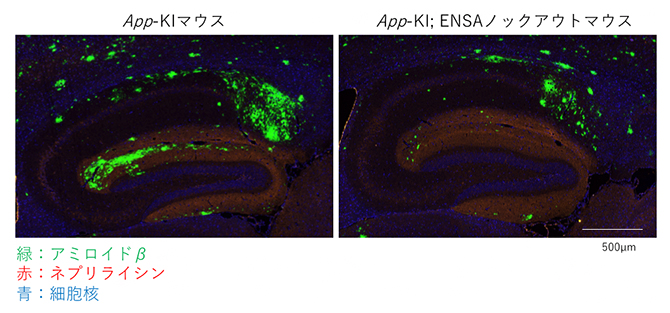
図1 ADモデルマウスとENSAノックアウトマウスを交配したマウスのアミロイド病理
- 左図:ADモデルマウス(App-KIマウス)の海馬におけるアミロイド病理。緑色のシグナルはアミロイドβ、赤色のシグナルはネプリライシン、青色は細胞核を示す。
- 右図:App-KIとENSAノックアウトマウスを交配させたマウスの海馬におけるアミロイド病理。左図に比べアミロイドβの蓄積量が著しく低いことが分かる。
次に、複数のサブタイプが存在するKATPチャネルの中で、どのサブタイプがネプリライシンを調節しているのか特定を試みました。各サブタイプのノックアウトマウスを解析した結果、SUR1/Kir6.2のサブタイプがネプリライシンの活性を調節していることが明らかになりました。従って、SUR1/Kir6.2サブタイプが新たな創薬標的となる可能性が示されました。
最後に、SUR1/Kir6.2へ高い親和性を示し、高インスリン血性低血糖症の治療薬として臨床で使用されている「ジアゾキシド」をApp-KIマウスへ長期投与し、治療効果を検討しました。その結果、投与群においてネプリライシンの活性上昇を介して、Aβの蓄積量が減少し、異常だった認知機能が野生型マウスのレベルまで回復しました(図2)。
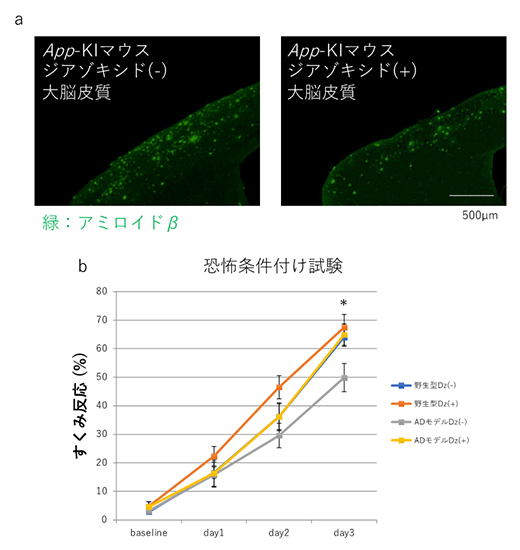
図2 ジアゾキシドによる治療効果の検討
- a:ジアゾキシド非治療と治療後App-KIマウスのアミロイド病理。緑色のシグナルはアミロイドβを示す。ジアゾキシド治療後ではアミロイドβの蓄積が減少している。
- b:認知機能に対するジアゾキシドの治療効果。恐怖条件付け試験により、ジアゾキシドの治療効果を解析したところ、投与したApp-KIマウスの認知機能は野生型マウスのレベルまで回復した。Dz:ジアゾキシド
今後の期待
本研究では、ネプリライシンの活性メカニズムに基づいた新しい薬剤作用点を発見したことにより、ADの根本的な予防や治療法に結びつく可能性があります。特に、この研究で示した高インスリン血性低血糖症の治療薬として臨床で使用されているジアゾキシドは、アミロイド病理に対する治療効果を認めたことから、ドラッグリポジショニングとして臨床応用されることが期待できます。
今年、米国食品医薬局(FDA)に承認されたAβ病理に対する抗体医薬のアデュカヌマブ[12]は、コスト面で大きな課題があります。ジアゾキシドはより安価で、既に臨床応用されている薬剤であるために、迅速に臨床試験を進められるメリットがあります。
今後は、どのようにしてSUR1/Kir6.2のサブタイプがネプリライシンの活性を調節しているのか、さらに下流のメカニズムを調査していきます。同時に、この一連のメカニズム以外にもネプリライシン活性制御作用を持つ因子が存在する可能性があるため、その探索も続けていきたいと考えています。
補足説明
- 1.アルツハイマー病(AD)
ドイツの精神科医、アルツハイマー博士により1905年に報告された進行性の記憶障害を伴う認知症。主に中高年で発症し、徐々に進行して生活に支障を来すようになり、最終的には意思疎通ができなくなる。日本を含む先進国では、高齢期発症の認知症のうち最も多いタイプの疾患となっている。家族歴を伴うものを家族性AD、伴わないものを孤発性ADと呼ぶ。 - 2.アミロイドβペプチド(Aβ)
アミロイド前駆体タンパク(APP)から、タンパク分解酵素によって切断されて精製される40アミノ酸ほどの長さのペプチド。アルツハイマー病患者の脳に出現する老人斑と呼ばれる凝集体の主要な構成成分であり、アルツハイマー病発症に関与する重要な分子と考えられている。 - 3.ネプリライシン
疎水性アミノ酸残基のアミノ末端側でタンパク質のペプチド結合を切断する細胞膜結合型のタンパク質分解酵素。エンケファリナーゼ、中性エンドペプチダーゼ24.11とも呼ばれる。理研では、ネプリライシンが脳内でアミロイドβを分解する主要酵素であることを発表している。 - 4.ソマトスタチン
成長ホルモンの分泌抑制因子として古く知られている神経ペプチドの一つ。最近では記憶学習などへの関与も報告されており、その生理作用は多岐にわたる。AD患者の脳内では、ソマトスタチンレベルが著しく低下していることが報告されている。このことから、弧発性ADの発症原因は、Aβ分解系の低下によるというシナリオを描くことができる。 - 5.ATP感受性Kチャネル、SUR1/Kir6.2
ATP感受性Kチャネルは、細胞内のATP濃度依存性に開閉が調節されるカリウムチャネルである。その一つであるSUR1/Kir6.2は、スルフォニルウレア受容体(SUR)と内向き整流性K+チャネル(Kir)の二つのサブユニットから構成されるヘテロ八量体のチャネル。SURはSUR1、SUR2AおよびSUR2Bのサブユニット、KirはKir6.1およびKir6.2のサブユニットが存在する。膵島β細胞や心筋、骨格筋、中枢および末梢神経細胞などに発現している。 - 6.高インスリン血性低血糖症
膵臓からのインスリンが過剰に分泌され、低血糖を来す疾患。多くは新生児期または乳児期に発症する。 - 7.ジアゾキシド
高インスリン血性低血糖症の治療薬として臨床応用されている薬。膵島β細胞の細胞膜ATP感受性Kチャネルを活性化させることで、インスリン分泌抑制作用がある。 - 8.ADモデルマウス
AD病態を示す遺伝子改変マウス。通常、家族性ADの原因と考えられる特定の遺伝子を過剰発現させ、作製される。しかし、理研では、これまでに過剰発現に依存しない次世代型ADモデルマウスの作製に成功している(Saito et al., 2014 Nat Neurosci; Sato et al., 2021 J Biol Chem)。 - 9.ドラッグリポジショニング
別の疾患の既存薬や開発中または開発中止となった医薬品化合物を新たな疾患の治療薬として転用する方法。ヒトでの安全性や体内動態が確認されており、既存の臨床データを利用できるため、新たな安全性試験などを行う必要がなく、新薬開発に要する期間・コストが縮小できる。 - 10.プロテオミクス
細胞や組織に発現する全タンパク質を網羅的に解析する手法。タンパク質の同定、定量、翻訳後修飾や相互作用などを解析できる。 - 11.ゲノム編集技術
生物が持つゲノムDNA上の特定の塩基配列をねらって変化させる技術。 - 12.アデュカヌマブ
Biogen社とエーザイ社の共同開発によって作製された、Aβを標的とするモノクローナル抗体。
国際共同研究グループ
理化学研究所 脳神経科学研究センター 神経老化制御研究チーム
研究員 綿村 直人(わたむら なおと)
研究員(研究当時) 垣矢 直雅(かきや なおまさ)
研究員 橋本 翔子(はしもと しょうこ)
専門職研究員 津吹 聡(つぶき さとし)
テクニカルスタッフⅠ 釜野 直子(かまの なおこ)
テクニカルスタッフⅠ 髙橋 美華(たかはし みか)
副チームリーダー 笹栗 弘貴(ささぐり ひろき)
チームリーダー 西道 隆臣(さいどう たかおみ)
カロリンスカ研究所 Center for Alzheimer Research, Dept.of Neurobiology, Care and Society, Division for Neurogeriatrics
Associate Professor ニルソン・パー(Nilsson Per)
名古屋市立大学大学院 医学系研究科
教授 斉藤 貴志(さいとう たかし)
研究支援
本研究は、日本医療研究開発機構(AMED)「脳科学研究戦略推進プログラム(プロジェクトリーダー:岩田修永)」、「革新的技術による脳機能ネットワークの全容解明プロジェクト(西道隆臣)」、日本学術振興会(JSPS)科学研究費助成事業若手研究「α-endosulfineによる脳内ネプリライシン活性制御機構の解明(研究代表者:綿村直人)」による支援を受けて行われました。
原論文情報
- Naoto Watamura, Naomasa Kakiya, Per Nilsson, Satoshi Tsubuki, Naoko Kamano, Mika Takahashi, Shoko Hashimoto, Hiroki Sasaguri, Takashi Saito, Takaomi Saido, "Somatostatin-evoked Aβ catabolism in the brain: Mechanistic involvement of α-endosulfine-KATP channel pathway.", Molecular Psychiatry, 10.1038/s41380-021-01368-8
発表者
理化学研究所
脳神経科学研究センター 神経老化制御研究チーム
研究員 綿村 直人(わたむら なおと)
チームリーダー 西道 隆臣(さいどう たかおみ)
 綿村 直人
綿村 直人
 西道 隆臣
西道 隆臣
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
