理化学研究所(理研)脳神経科学研究センタータンパク質構造疾患研究チームの中川幸姫大学院生リサーチ・アソシエイト(東京工業大学大学院生、ともに研究当時)、田中元雅チームリーダー、東京工業大学科学技術創成研究院の田口英樹教授らの共同研究グループは、in vitro(試験管内)再構成系におけるアミロイド[1]の脱凝集反応の確立に成功しました。
本研究成果は、これまで治療困難であった神経変性疾患[2]の創薬開発に貢献するものと期待できます。
プリオンタンパク質[3]のアミロイドの脱凝集機構には、タンパク質の恒常性の維持に関わるシャペロンタンパク質[4]が関与していることが示唆されていますが、脱凝集の詳しい分子メカニズムは不明のままでした。
今回、共同研究グループは全反射照明蛍光顕微鏡[5]を用いて、酵母のSup35プリオンタンパク質のアミロイド(Sc4アミロイド)に蛍光ラベルしたシャペロンタンパク質を加え、Sc4アミロイドが脱凝集する過程を調べました。その結果、脱凝集にはHsp104、Ssa1、Sis1の三つのシャペロンタンパク質が必要であることが分かりました。また、アミロイドにはSsa1とSis1が先に結合し、そこにHsp104が結合・解離を繰り返すことで、アミロイドが分断されることが分かりました。さらに、別の構造を持つSup35のSc37アミロイドでは、アミロイドが一様に脱凝集(溶解)されたため、脱凝集の様式が分断とは異なることも明らかになりました。
本研究は、科学雑誌『Nature Chemical Biology』(3月号)の掲載に先立ち、オンライン版(2月17日付:日本時間2月18日)に掲載されました。
背景
アルツハイマー病やハンチントン病など多くの脳の神経変性疾患には、原因タンパク質の凝集に伴って線維状の凝集体(アミロイド)が形成されるという特徴があります。神経変性疾患の発症や進行には、アミロイドが脳内にある細胞から周りの細胞へ伝播することが深く関わっています。これまで、田中元雅チームリーダーらはアミロイドの伝播機構を明らかにするため、その解析に優れた「酵母プリオンの系」を用いてきました。
酵母のSup35プリオンタンパク質は、酵母細胞内でアミロイド線維状のプリオン凝集体を形成しますが、それは細胞内で脱凝集されて小さなシード(たね)となり、細胞分裂後の娘細胞に伝播されることが分かっています。このアミロイドの脱凝集機構にはシャペロンタンパク質の関与が示唆されていますが、脱凝集の詳しい分子メカニズムは不明のままでした。
研究手法と成果
共同研究グループは高度に精製したシャペロンタンパク質を用いて、in vitro(試験管内)再構成系を新たに開発し、アミロイドの脱凝集反応系を確立させました。まず、シャペロンタンパク質のHsp104、Hsp70(Ssa1)、Hsp40(Sis1)と酵母プリオンタンパク質Sup35から形成したSc4アミロイド注1)を用いて、Sc4アミロイドの脱凝集を試験管内で再現できるか調べました。アミロイドに特異的に結合する蛍光分子チオフラビンTを使って脱凝集を試みたところ、Sc4アミロイドはHsp104/Ssa1/Sis1を添加したときのみ蛍光強度が減少し、脱凝集されたことが分かりました(図1赤線)。一方、Hsp104はアデノシン三リン酸(ATP)を加水分解して働く(ATPase活性のある)タンパク質ですが、その活性のない変異体(Hsp104KT)とSsa1、Sis1を用いた場合は、脱凝集は見られませんでした(図1緑線)。従って、Hsp104のATPase活性がアミロイドの脱凝集に必須であることが分かりました。
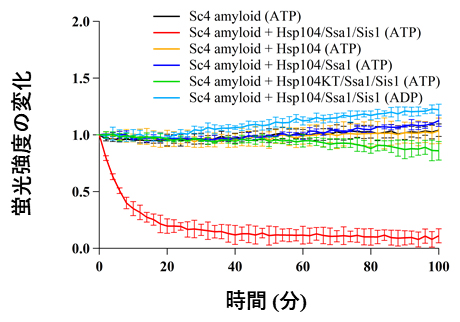
図1 再構成系を用いたSc4アミロイドの脱凝集反応
アミロイドに特異的に結合するチオフラビンTの蛍光がHsp104/Ssa1/Sis1(ATP)の条件(赤線)でのみ減少し、アミロイドが脱凝集したことを表している。ATPase活性のない変異体Hsp104KT(緑線)では、脱凝集しなかった。
また、アミロイドが脱凝集するときに、端からアミロイドの線維が短くなっていくか、あるいは全体が一様に脱凝集されるかは上記の手法では分かりません。そこで、アミロイドが脱凝集される様子をリアルタイムで解析するために、蛍光ラベルしたアミロイドを基板上に固定して、全反射照明蛍光顕微鏡(TIRF)で観察しました。TIRFでは、基板上に固定したアミロイドに結合した蛍光ラベルしたシャペロンタンパク質の動きを観察できます。
Sc4アミロイドにシャペロンタンパク質をさまざまな組み合わせで添加したところ、Hsp104/Ssa1/Sis1を添加したときのみ、Sc4アミロイドが時間とともに消えていく様子が観察されました。このとき、Sc4アミロイドは線維の真ん中から複数箇所で分断されました(図2上から4段目)。一方、変異体Hsp104KTを用いた場合は脱凝集しませんでした(図2上から5段目)。

図2 全反射照明蛍光顕微鏡(TIRF)によるアミロイドの脱凝集過程の解析
蛍光ラベルしたSc4アミロイド(赤色)にHsp104、Ssa1、Sis1をさまざまな組み合わせで添加した後、全反射照明蛍光顕微鏡で観察したところ、Hsp104/Ssa1/dSis1の組み合わせの場合のみ脱凝集が観測された(上から4段目)。その際、白矢頭で示すように、アミロイドは線維の真ん中の複数箇所から分断された。
次に、三つのシャペロンタンパク質がどのような順序でSc4アミロイドに結合するかを調べるため、蛍光ラベルした複数のシャペロンタンパク質をさまざまな組み合わせで観察しました。その結果、Ssa1とSis1の複合体がまずアミロイドに結合し、その約60~100秒後にHsp104が同じ部位に結合することが分かりました。さらに、アミロイドが実際に分断される部位において、Hsp104が繰り返し同じ位置に結合と解離を頻繁に繰り返しており、この繰り返し結合することがアミロイドの分断に重要であることが分かりました(図3上段)。
さらに、Sc4とは異なる構造を持つSup35のアミロイド(Sc37アミロイド)を使って、同じようにシャペロンの結合や脱凝集過程に違いがあるかどうか解析しました。これまで田中元雅チームリーダーらは、Sc37のアミロイドのコアを形成するアミノ酸領域がより長く、Sc4アミロイドに比べて硬い構造であることを明らかにしてきました注2-3)。そのため、天然変性した領域が少ないため、シャペロンが結合しにくいと考えられました。
そこで、Sc37アミロイドにHsp104/Ssa1/Sis1を添加しTIRFで観察したところ、予想に反して、Hsp104とSsa1のSc37アミロイドへの結合量が著しく高いことが分かりました。また、Sc37アミロイド全体の蛍光強度が時間の経過とともに一様に下がっていき、Sc4アミロイドのように断片化されるのではなく、一様に脱凝集(溶解)することが分かりました(図3下段)。また、Hsp104が繰り返し同じ位置に結合する頻度は低いことが分かり、Sc37アミロイドではHsp104とSsa1が強く結合するために繰り返し結合の数が減り、そのため分断が起こりにくいと考えられます。
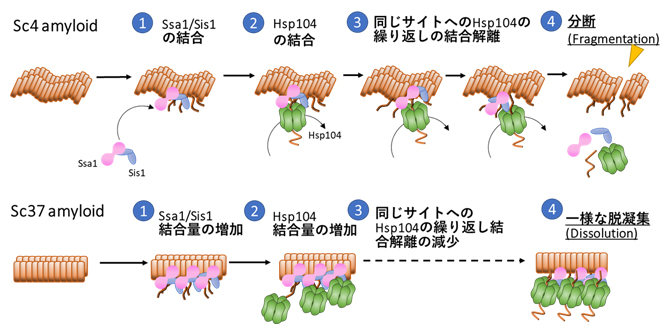
図3 異なる構造を持つSup35アミロイドの脱凝集機構のモデル図
Sc4アミロイドに対してSsa1とSis1が先に結合し、その後に同じ部位にHsp104が結合する。Hsp104は結合・解離を繰り返し、それによってSc4アミロイドを「分断」する。一方で、構造の異なるSc37アミロイドに対してはSsa1, Ssi1の結合量が増大し、それに伴いHsp104の結合量も増大する。そのため、結合・解離の頻度は減少し、一様に「溶解」されることで脱凝集されていく。
- 注1)2018年3月22日プレスリリース「アミロイド構造の多様性の原因解明」
- 注2)2010年1月18日プレスリリース「酵母プリオンタンパク質のオリゴマー形成過程が感染強度を決定」
- 注3)理研ニュース2019年12月号「研究最前線「タンパク質の凝集体から脳疾患を解明する」」
今後の期待
本研究は、酵母プリオンSup35アミロイドの脱凝集機構の分子機構を明らかにすることで、酵母内で効率的にアミロイドが伝播する現象を説明することができました。
本研究成果は、酵母プリオンの伝播機構だけでなく、哺乳類の神経変性疾患の原因となりうるアミロイドを脱凝集する研究への展開につながり、シャペロンタンパク質による脱凝集は、将来的に創薬に向けた新たな治療戦略として期待できます。
補足説明
- 1.アミロイド
βシート構造に富んだ線維状のタンパク質の凝集体。界面活性剤やタンパク質分解酵素に抵抗性があるため、組織に蓄積しやすく、アルツハイマー病やプリオン病などのヒト疾患の原因となる。 - 2.神経変性疾患
神経組織の変性を伴う病気で、異常なタンパク質の凝集などを伴い、神経細胞が損傷するために起こると考えられている。アルツハイマー病やパーキンソン病、筋萎縮性側索硬化症(ALS)およびプリオン病などが知られている。 - 3.プリオンタンパク質
プリオンとはタンパク質からなる遺伝因子であり、プリオンを構成するタンパク質のことをプリオンタンパク質と呼ぶ。哺乳類では、狂牛病などの原因となる哺乳類のプリオンタンパク質(PrP)が知られている。出芽酵母では、Sup35やUre2などのプリオンタンパク質が知られている。 - 4.シャペロンタンパク質
タンパク質の正しいフォールディング(折り畳み)を助けたり、凝集を解きほぐす機能を持つタンパク質の総称であり、原核生物から真核生物まで保存されているものも多い。 - 5.全反射照明蛍光顕微鏡
観察試料の基板表面近傍のみを照らすエバネッセント光を局所的な励起光として用いることで、基板表面におけるタンパク質1分子などの蛍光観察を行うための蛍光顕微鏡の一つである。
共同研究グループ
理化学研究所
脳神経科学研究センター タンパク質構造疾患研究チーム
チームリーダー 田中 元雅(たなか もとまさ)
大学院生リサーチ・アソシエイト(研究当時) 中川 幸姫(なかがわ よしこ)
(東京工業大学生命理工学院大学院生(研究当時))
国際プログラム・アソシエイト(研究当時) ハワード・チ・ハオ・シェン(Howard C.-H.Shen)
研究員 小見 悠介(こみ ゆうすけ)
日本学術振興会特別研究員(研究当時) 杉山 伸樹(すぎやま しんじゅ)
生命機能科学研究センター タンパク質機能・構造研究チーム
チームリーダー 白水 美香子(しろうず みかこ)
研究員 横山 武司(よこやま たけし)
技師 苫米地 由里(とまべち ゆり)
佐甲細胞情報研究室
主任研究員 佐甲 靖志(さこう やすし)
専任研究員 岡本 憲二(おかもと けんじ)
東京工業大学
科学技術創成研究院 細胞制御工学研究センター
教授 田口 英樹(たぐち ひでき)
助教 丹羽 達也(にわ たつや)
生命理工学院
大学院生(修士課程2年(研究当時)) 稲場 愛(いなば あい)
大阪大学大学院工学研究科生物工学専攻
教授 内山 進(うちやま すすむ)
株式会社ユー・メディコ
研究員 栗之丸 孝章(くりのまる たかあき)
研究員(研究当時) クラユヒナ・エレナ(Elena Krayukhina)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(A)「再構成系を用いたアミロイド伝播の統合的理解(研究代表者:田中元雅)」、同新学術領域研究(研究領域提案型)「分子夾雑系におけるタンパク質凝集の制御(研究代表者:田中元雅))、武田振興科学財団研究費(研究代表者:田中元雅)などによる支援を受けて行われました。
原論文情報
- Yoshiko Nakagawa, Howard C.-H. Shen, Yusuke Kom, Shinju Sugiyama, Takaaki Kurinomaru, Yuri Tomabechi, Elena Krayukhina, Kenji Okamoto, Takeshi Yokoyama, Mikako Shirouzu, Susumu Uchiyama, Megumi Inaba, Tatsuya Niwa, Yasushi Sako, Hideki Taguchi, Motomasa Tanaka, "Amyloid conformation-dependent disaggregation in a reconstituted yeast prion system", Nature Chemical Biology, 10.1038/s41589-021-00951-y
発表者
理化学研究所
脳神経科学研究センター タンパク質構造疾患研究チーム
チームリーダー 田中 元雅(たなか もとまさ)
大学院生リサーチ・アソシエイト(研究当時)
中川 幸姫(なかがわ よしこ)
(東京工業大学生命理工学院大学院生(研究当時))
東京工業大学 科学技術創成研究院 細胞制御工学研究センター
教授 田口 英樹(たぐち ひでき)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
東京工業大学 総務部広報課
Email: media [at] jim.titech.ac.jp
※[at]は@に置き換えてください。
