2022年3月29日
理化学研究所
京都大学iPS細胞研究所
京都大学大学院医学研究科
ヒトiPS細胞からの視細胞直接誘導法
-視細胞を迅速かつ簡便に分化誘導することが可能に-
理化学研究所(理研)バイオリソース研究センターiPS創薬基盤開発チーム大塚悠生研修生(京都大学大学院医学研究科眼科学講座 大学院生)、今村恵子客員研究員(京都大学iPS細胞研究所特定拠点講師)、井上治久チームリーダー(京都大学iPS細胞研究所教授)、京都大学大学院医学研究科眼科学講座辻川明孝教授らの共同研究チームは、特定の転写因子[1]を発現させることで、人工多能性幹細胞(iPS細胞)[2]から網膜の構成細胞である視細胞[3]を短期間で分化誘導できることを発見しました。
本研究成果は、網膜変性疾患[4]をはじめとする視細胞関連研究の疾患モデリングや治療薬の探索に貢献すると期待できます。
これまで、iPS細胞から網膜を構成する細胞を分化誘導する研究が行われてきましたが、時間がかかること、複数のステップを経る必要があることが課題となっていました。
今回、共同研究チームは、ヒトiPS細胞へ転写因子CRXとNEUROD1を導入して一過性に過剰発現させることで、従来の分化誘導方法よりも短期間で、さらに1ステップで視細胞に特異的な遺伝子を発現する誘導型視細胞様細胞(以下、誘導視細胞)を作製する方法を構築しました。シングルセルRNA解析[5]により、誘導視細胞のトランスクリプトーム[6]を解析したところ、種々の光伝達関連遺伝子が発現していることが判明しました。作製された誘導視細胞は、カルシウムイメージング[7]においてその機能的特性を示しました。さらに、誘導視細胞を使用した光傷害モデル[8]において、光誘導性の細胞死が抗酸化物質の投与によって抑制されました。
本研究は、オンライン科学雑誌『iScience』に3月8日付で掲載されました。
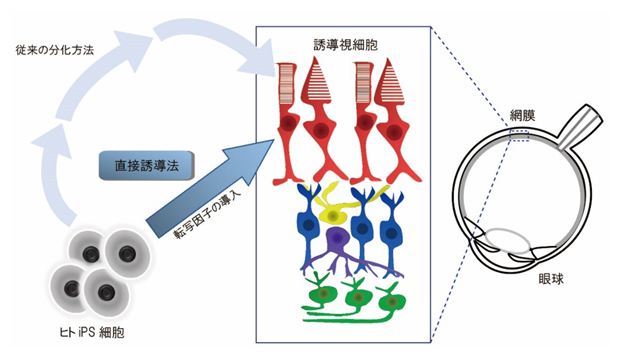
ヒトiPS細胞から誘導視細胞を作製する方法の概略図
背景
眼球内で光を感受する網膜の中で、視細胞は光を感じる主要な構成細胞です。網膜変性疾患は視細胞が変性する進行性の疾患群であり、不可逆的な視力低下を引き起こします。網膜変性疾患は病態が明らかでないケースも多く、根本的な治療法はまだ存在していません。
これらの疾患を研究する際に、iPS細胞の技術は視細胞の産生、試験管内での疾患モデルの作製に有用です。これまでに、視細胞を作製する分化誘導法がいくつか報告されています。また、近年では、生体に近い構造を持つ3次元網膜オルガノイド[9]の誘導に関する研究も進んでいます。しかしこれらの方法では、視細胞作製のために長期間の培養と複数のステップを要するという課題がありました。
研究手法と成果
共同研究チームは、より短期間で、ステップ数を極力削減して視細胞を分化誘導し、作製することを目標として「直接誘導法」という技術に注目しました。この方法は、細胞の系統決定に重要な遺伝子を体細胞に強制発現させることで、目的とする系統の細胞へ転換させる技術です。実際、この手法により、全身の種々の細胞が体細胞から作製可能なことが報告されてきました。しかし、体細胞は皮膚や血液からの採取が必要で、細胞分裂の回数も限られているため、使用できる細胞数に限界がありました。一方で、iPS細胞はさまざまな組織や臓器の細胞に分化する能力に加え、ほぼ無限に増殖する能力を持っています。そこで、ヒトiPS細胞へ転写因子を導入して直接分化誘導し、視細胞を作製する方法の構築を試みました。
結果として、視細胞の発生過程に重要とされるCRXとNEUROD1という二つの転写因子をヒトiPS細胞に導入し培養することで、14日以内という短期間で視細胞に特異的な遺伝子を発現する誘導型視細胞様細胞(以下、誘導視細胞)を作製できることを発見しました。さらに、28日目まで培養期間を延長することで、他の視細胞のマーカーとなる遺伝子が発現し、より生体内の視細胞に近くなることが分かりました(図1)。
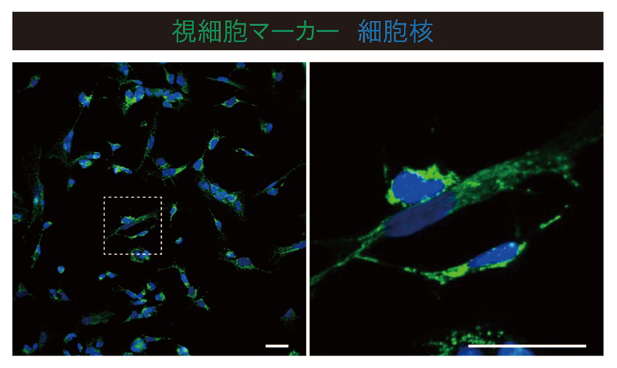
図1 ヒトiPS細胞からの誘導視細胞の免疫染色画像
- 左)転写因子CRXとNEUROD1を導入したヒトiPS細胞からの分化誘導後、28日目の細胞を視細胞に特異的なマーカー(緑)で染色した画像。スケールバーは50マイクロメートル(μm、1μmは1,000分の1mm)。
- 右)左図の点線で囲んだ部分を拡大化したもの。特徴的な細長い形態が誘導された細胞が見られる。スケールバーは50μm。
また、シングルセルRNA解析を行い、誘導視細胞のトランスクリプトームを詳しく調べてみると、視細胞の発生に関与している種々の遺伝子や光シグナル伝達に関与する遺伝子が数多く活性化されていることが分かりました。そこで、誘導視細胞が実際に機能的特性を保持しているかを調べるために、光刺激を模倣できる試薬(膜透過性cGMPアナログ)を投与し、その応答をカルシウムイメージングで観察しました。その結果、誘導視細胞はこの試薬に反応を示し、特にいくつかの細胞ではベースラインから30%以上の大きな変化を起こすことが分かりました(図2)。
これらの結果は、分化開始から28日間という従来の方法より短い期間内に、視細胞特異的なタンパク質群を発現した機能的な細胞を作製できたことを示しています。
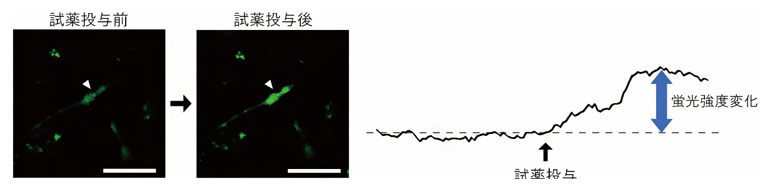
図2 誘導視細胞の機能評価
- 左)分化誘導後28日目の誘導視細胞をカルシウム指示薬で標識。光刺激を模倣する試薬の投与により、細胞の蛍光強度が増しているのが確認できる。スケールバーは50μm。
- 右)左図矢印の誘導視細胞の蛍光強度変化をグラフ化した図。横軸は時間、縦軸は蛍光強度変化を表す。試薬投与後に約30%程度蛍光強度が増加した。
さらに、この誘導視細胞を疾患研究に応用可能か確認するために、「光傷害モデル」を構築しました。誘導視細胞に白色LED光を照射しながら24時間培養すると、光受容タンパク質であるロドプシンを発現している誘導視細胞の数が、光照射によって有意に減少しました(図3)。一方で、光照射前に抗酸化剤であるN-アセチルシステインを培地に添加しておくと、ロドプシン陽性の誘導細胞の数の減少は抑制されました。つまり、光誘導性の細胞死が抗酸化物質の投与によって抑制されることが分かりました。
これらの結果から、本研究で作製された誘導視細胞が視細胞疾患の疾患モデルや治療薬探索に有用である可能性が示されました。
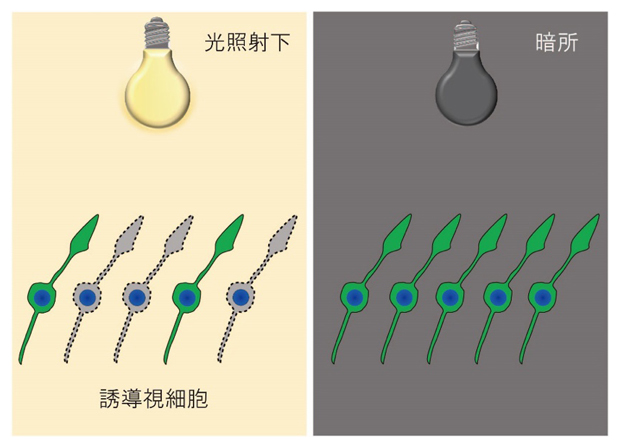
図3 光傷害モデルの概略図
28日間培養した誘導視細胞に白色LED光を24時間照射すると、ロドプシンを発現している細胞(緑)の数が、暗所で培養していたものと比較して減少した。
今後の期待
本研究では、直接誘導法をヒトiPS細胞からの視細胞誘導に応用することで、従来の分化誘導法よりも短期間でヒトの視細胞を作製できることを示しました。
今後、より高効率で視細胞を作製できる培養条件の検討や、目的細胞の選別による純化方法を組み合わせることで、誘導視細胞を利用した網膜変性疾患の疾患モデルの確立や治療薬探索が可能になると期待できます。
補足説明
- 1.転写因子
遺伝子(DNA)に書き込まれた遺伝情報のRNAへの転写の促進または抑制に関与するタンパク質群。約2,000種以上ものタンパク質が同定されている。 - 2.人工多能性幹細胞(iPS細胞)
脊椎動物の初期胚などが持つ、全ての種類の体細胞へ分化する能力を多能性という。多能性を持ち、試験管内で培養して無限に増やすことができる細胞を多能性幹細胞という。iPS細胞は、成人の血液や皮膚の細胞にOct3、Sox2、Klf4遺伝子などを導入して人工的に作製した多能性を持つ幹細胞である。 - 3.視細胞
網膜を構成する細胞の一種で、光を受容し、その信号を網膜内の別の神経細胞へ伝達する重要な役割を担っている。視細胞は大きく分けて、錐体視細胞と杆体(かんたい)視細胞の2種類が存在する。錐体視細胞は明るいところ、杆体視細胞は暗いところで物を見るときにそれぞれ使われる。 - 4.網膜変性疾患
失明を含む強度の視力障害に至る重篤な疾患で、網膜を構成する細胞のうち、光受容体である視細胞が加齢や遺伝的原因などで変性し脱落するために起こる。代表的なものに網膜色素変性がある。 - 5.シングルセルRNA解析
次世代シーケンサーを用いることで、個々の細胞が保持しているmRNA全体を質的、量的に網羅的に調べる方法。次元圧縮などの数理的な解析と組み合わせることで、遺伝子発現の状態に基づいた細胞の分類が可能であり、従来の組織学的、あるいは細胞生物学的手法では知ることができなかった新規の細胞種の同定や細胞状態の推定が可能になった。 - 6.トランスクリプトーム
細胞中に存在する全ての転写産物(タンパク質をコードするmRNA、タンパク質をコードしないノンコーディングRNA、マイクロRNAなど)の総体。トランスクリプトームはゲノムとは異なり、同一の個体でも組織ごとに、さらには発生段階や細胞外環境、刺激によっても変化する。 - 7.カルシウムイメージング
細胞内カルシウムイオンの流動を測定し、活動中の細胞内のカルシウムイオン濃度変化を直接観察する手法。脳細胞の研究などで広く利用されている。 - 8.光傷害モデル
マウスなどの動物モデルや、網膜から樹立された株化細胞は、一定光量の光を当て続けると細胞死が生じるとされる。それを基に網膜変性疾患の病態追究や治療薬の探索を行う手法のこと。 - 9.オルガノイド
試験管の中で幹細胞から作るミニチュアの臓器。幹細胞の持つ自己複製能と分化能を利用して、自己組織化させることで3次元的な組織様構造として形成される。
研究支援
本研究は、日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム「iPS細胞研究中核拠点(研究開発分担者:井上治久)」、およびiPS細胞基金の支援を受けて行われました。
原論文情報
- Yuki Otsuka, Keiko Imamura, Akio Oishi, Takayuki Kondo, Mika Suga, Yuichiro Yada, Ran Shibukawa, Yasue Okanishi, Yukako Sagara, Kayoko Tsukita, Akitaka Tsujikawa, Haruhisa Inoue, "One-step induction of photoreceptor-like cells from human iPSCs by delivering transcription factors", iScience, 10.1016/j.isci.2022.103987
発表者
理化学研究所
バイオリソース研究センター iPS創薬基盤開発チーム
チームリーダー 井上 治久(いのうえ はるひさ)
(京都大学iPS細胞研究所 教授)
客員研究員 今村 恵子(いまむら けいこ)
(京都大学iPS細胞研究所 特定拠点講師)
研修生 大塚 悠生(おおつか ゆうき)
(京都大学大学院医学研究科眼科学講座 大学院生)
京都大学大学院 医学研究科 眼科学講座
教授 辻川 明孝(つじかわ あきたか)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
京都大学iPS細胞研究所(CiRA)国際広報室
Tel: 075-366-7005
Email: media [at] cira.kyoto-u.ac.jp
京都大学大学院 医学研究科
Email: 060k-kouhou [at] mail2.adm.kyoto-u.ac.jp
※上記の[at]は@に置き換えてください。
