2022年6月17日
理化学研究所
東北大学
大阪公立大学
熊本大学
豊橋技術科学大学
科学技術振興機構
藻類の太陽光エネルギーを吸収する仕組みを解明
-高効率な光エネルギー伝達デバイスへの応用に期待-
理化学研究所(理研)放射光科学研究センター利用技術開拓研究部門生体機構研究グループの川上恵典研究員、米倉功治グループディレクター(東北大学多元物質科学研究所教授)、東北大学多元物質科学研究所生物分子機能計測研究分野の浜口祐准教授、大阪公立大学人工光合成研究センターの神谷信夫特別招へい教授(大阪市立大学名誉教授)、大阪公立大学大学院理学研究科生物学専攻の宮田真人教授、熊本大学産業ナノマテリアル研究所の小澄大輔准教授、豊橋技術科学大学応用化学・生命工学系の広瀬侑准教授の共同研究グループは、太陽光エネルギーを高効率に吸収する藻類の光捕集タンパク質複合体「フィコビリソーム[1]」の中心およびアンテナ部位の立体構造を明らかにすることに成功しました。
本研究成果は、光合成の初期過程である光エネルギーを吸収する仕組みを解明したものです。藻類の光捕集の仕組みを理解し、この知見を人工光合成研究[2]に取り入れることで、高効率光エネルギー伝達デバイスの開発に貢献することができると期待されます。
今回、共同研究グループは、好熱性シアノバクテリアThermosynechococcus vulcanus(T. vulcanus)[3]から単離したフィコビリソームの中心部位であるコアとアンテナ部位である棒状のフィコシアニン[4]ロッドのそれぞれについて、クライオ電子顕微鏡[5]を用いた単粒子解析[6]を行いました。複雑で巨大な複合体の観察には、クライオ電子顕微鏡測定に適した試料調整と国産クライオ電子顕微鏡の運用技術開発が必要でした。本研究で解析されたフィコビリソームは発色団としてフィコシアノビリン[7]のみを持ち、タンパク質環境の違いによって各発色団の吸収波長を変化させ、単一の発色団を用いた一方向性の超高速光エネルギー伝達システムを構築しています。フィコビリソームの立体構造を解析することで各フィコシアノビリンの周辺環境の詳細が明らかとなり、そのエネルギー伝達システムが明らかにされました。
本研究は、科学雑誌『Nature Communications』オンライン版(6月17日付:日本時間6月17日)に掲載されました。
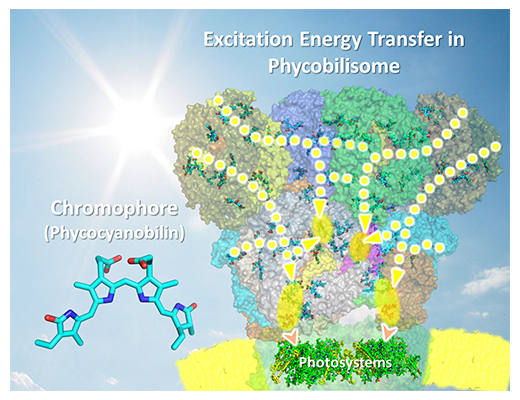
T. vulcanusフィコビリソームの光エネルギー伝達システムの概念図
背景
シアノバクテリアや紅藻、灰色藻といった藻類は、光合成初期反応に関与する光捕集タンパク質複合体「フィコビリソーム」を用いて、太陽光エネルギーを高効率に吸収し、生命活動に利用しています。フィコビリソームの機能の特徴として、光化学系タンパク質である光化学系Ⅰ[8]と光化学系Ⅱ[9]が吸収しにくい光の波長を吸収することができ、そのエネルギーを光化学系タンパク質へと伝達できることです(図1)。
好熱性シアノバクテリアが持つフィコビリソームは非常に巨大なタンパク質複合体であり、光を吸収する発色団フィコシアノビリンを持つ「フィコシアニン」と「アロフィコシアニン[10]」、および内部構造を安定化させる「リンカータンパク質[11]」によって構成されています。藻類の細胞内には発色団を含むタンパク質が多く含まれているため、細胞の光の吸収特性(吸収スペクトル)は、発色団を含む各タンパク質の吸収スペクトルが重なった形状になります(図1a)。そこから各タンパク質をうまく単離することで、個々のタンパク質が持つ固有の吸収スペクトルを見ることができます(図1b-f)。好熱性シアノバクテリアのフィコビリソームの発色団はフィコシアノビリンのみですが、アロフィコシアニンやフィコシアニンといった「異なるタンパク質環境」にフィコシアノビリンが結合することで、吸収スペクトルが変化し(図1c、d)、フィコビリソーム内においてフィコシアニンからアロフィコシアニンへのエネルギー伝達が、高効率かつピコ秒[12]という超高速で行われます。このように、単一の発色団しかなくても、周りのタンパク質環境を変えることで吸収スペクトルを変化させ、光化学系タンパク質へと光エネルギーを伝達する一方向性のエネルギー伝達システムがフィコビリソームの特徴となり、このシステムを明らかにするためこれまで長らく好熱性シアノバクテリアのフィコビリソームの生化学・分光学解析が行われてきました。しかし、フィコビリソームの質量は約600万ダルトン[13]と非常に巨大で、かつ不安定なことから、これまでのタンパク質構造解析で用いられてきたX線結晶構造解析[14]では、その立体構造を解くことはできませんでした。フィコビリソームの立体構造を明らかにすることで単一の発色団で行われる超高速光エネルギー伝達の仕組みが明らかとなり、この知見を人工光合成研究に取り入れることができれば、高効率な光エネルギー伝達デバイスの開発に貢献できると期待されていました。
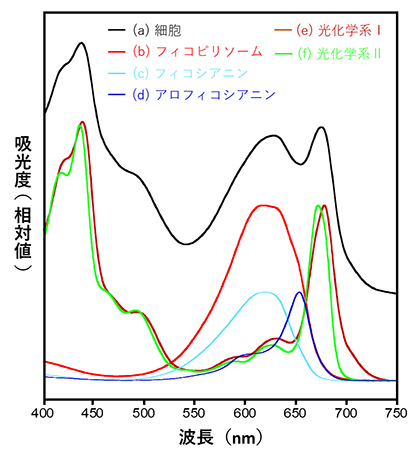
図1 T. vulcanus試料の吸収スペクトル
各試料の吸収スペクトル。(a) 細胞(黒色) (b) フィコビリソーム(赤色) (c) フィコシアニン(水色) (d) アロフィコシアニン(青色) (e) 光化学系Ⅰ(茶色) (f) 光化学系Ⅱ(緑色)
研究手法と成果
共同研究グループは、日本電子株式会社のクライオ電子顕微鏡CRYO ARM 300を用いて、和歌山県湯の峰温泉で採取された好熱性シアノバクテリアT. vulcanusから単離したフィコビリソームの電子顕微鏡測定を行いました。使用した装置は国産のクライオ電子顕微鏡の一号機でいろいろな初期問題を抱えていました。そこで、安定稼働させるため、独自ソフトウェアを作製する等、撮影を高度に制御する技術開発を行いました。その結果、4,600枚の高品質な画像を自動で取得できました。そして、得られたタンパク質の粒子像から単粒子解析によってその三次元構造を再構築し、T. vulcanusフィコビリソームの中心部位であるコアとアンテナ部位である棒状のフィコシアニンロッドの立体構造を調べました。
T. vulcanusフィコビリソームコアは、6種類のアロフィコシアニン(Apc)タンパク質(ApcA、ApcB、ApcC、ApcD、ApcE、ApcF)によって構成され、その周りに四つのフィコシアニンロッド(Rt、Rt'、Rb、Rb')が結合しています(図2a-c)。解析の結果、ApcAとApcBはフィコビリソームコアのシリンダー部位(A、A'、B、C、C')の構成に関与し、各シリンダーの「蓋」となるリンカータンパク質ApcCと、さらに光化学系Ⅰと光化学系Ⅱへのエネルギー伝達に寄与するApcD、ApcE、ApcFが複雑に相互作用することで、フィコビリソームコアの構造を構築していることが分かりました。特に、ApcEは非常に複雑な構造を持ち、ApcAに類似した構造の部位(αLCM)と四つの繰り返し部位(Rep1-4)がつながって、フィコビリソームコア構造の維持に関わっています(図2d、e)。さらに、ApcEのαLCMとApcFの内部にある二つのフィコシアノビリンが相互作用することで、これら発色団から光化学系Ⅱへと効率よく光エネルギーを伝達していることも明らかになりました(図2f)。
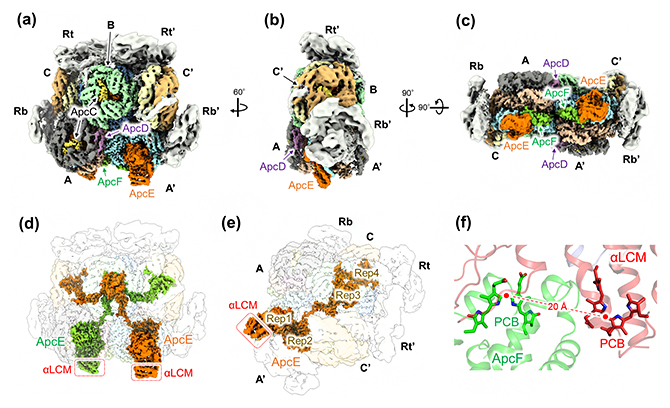
図2 T. vulcanus フィコビリソームコアの全体構造
- (a)フィコビリソームコアとその周りに結合する一部のフィコシアニンロッド(Rt、Rt'、Rb、Rb')の構造。フィコビリソームコアは、アロフィコシアニンで構成されるシリンダー部位(A、A'、B、C、C')で構築されている。フィコビリソームから光化学系タンパク質へのエネルギー伝達には、ApcD、ApcE、ApcFが関与している。
- (b)図1aを60°回転させ、横側から見た図。
- (c)図1aを回転させ、下側から見た図。
- (d)フィコビリソームコア内に存在する二つのApcE。
- (e)ApcEの全体構造。ApcAに似た構造であるαLCMと、各シリンダー構造を維持する四つの繰り返し部位(Rep1-4)から構成されている。
- (f)αLCMとApcF内に存在する、二つの発色団フィコシアノビリン(PCB)の相互作用。20Å(1Åは100億分の1メートル)は距離を示している。
一方、フィコシアニンロッドでは、フィコシアニン(Cpc)タンパク質(CpcAとCpcB)から成る二つのリング構造(ディスクAとディスクB)が三つのリンカータンパク質(CpcC、CpcD、CpcG)によって維持されていることが分かりました(図3a)。CpcDはフィコシアニンロッドの最も外側に位置するため、フィコシアニンロッドが吸収した光エネルギーはディスクAからディスクBへと伝達されます。そして、リンカータンパク質を構成するアミノ酸の一部がフィコシアノビリンに近接しており、これらのアミノ酸がフィコシアニンロッド内の発色団の吸収波長を変化させ、ディスクAからディスクBへのエネルギー伝達を可能にしていることが分かりました(図3b)。
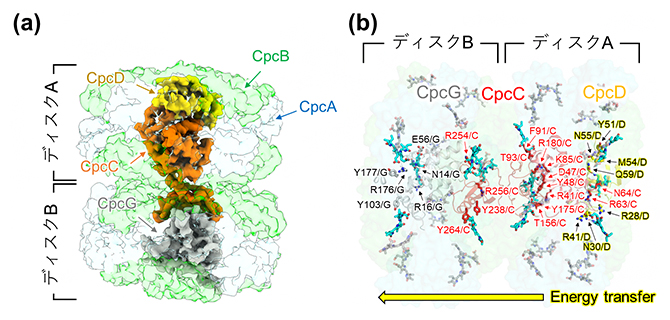
図3 フィコシアニンロッドの構造
- (a)フィコシアニンロッドの全体構造。CpcAとCpcBから成るリング状のディスクAとディスク Bは、リンカータンパク質(CpcC、CpcD、CpcG)がその内部に結合することで、ディスク間の相互作用を維持している。
- (b)フィコシアニンロッド内のエネルギー伝達経路。CpcDは最も外側に位置するため、フィコシアニンロッドが吸収した光エネルギーは、CpcDを含むディスクAからディスクBへと伝達される。リンカータンパク質を構成するアミノ酸の一部(赤や黒の矢印で示す)が近接する発色団フィコシアノビリン(水色のスティックモデル)の吸収波長を変化させ、ディスクAからディスクBへのエネルギー伝達に関与する。
今後の期待
本研究では、クライオ電子顕微鏡を用いた単粒子解析によって、T. vulcanusフィコビリソームの発色団がフィコシアノビリンだけで構成されていること、および周辺のタンパク質環境の違いによって個々のフィコシアノビリンの吸収波長が変化し、光エネルギーを光化学系タンパク質へと効率よく伝達するシステムを構築していることが明らかになりました。また、このタンパク質環境の違いは主にリンカータンパク質によって作られており、リンカータンパク質はフィコビリソームの構造を維持するだけでなく、発色団の吸収波長を変化させる役割を担っていることも明らかになりました。
本研究で得られた知見を人工光合成研究に取り入れることで、今後、可視光を利用した単一分子による一方向性の光エネルギー伝達デバイスの開発が進展するものと期待できます。そして、新たに開発されたデバイスを水素生産や二酸化炭素の還元を可能にする触媒と連結させることで、太陽光エネルギーを利用した物質変換デバイスの開発が可能となり、カーボンニュートラルの実現に向けた取り組みが進展すると期待されます。
補足説明
- 1.フィコビリソーム
シアノバクテリアや紅藻、灰色藻といった多くの藻類が持ち、太陽の光を捕集する機能を持つタンパク質複合体。 - 2.人工光合成研究
植物や藻類が行う天然光合成とは異なり、光合成を人工的に行う技術を開発する研究。化石燃料や原子力の代替エネルギーの開発として注目されている。 - 3.Thermosynechococcus vulcanus(T. vulcanus)
生育至適温度が50~60˚C程度の中度好熱性のシアノバクテリアの一種であり、温泉源に多く生息している。得られるタンパク質は耐熱性であるため、植物や藻類が行う天然光合成を調べるための生化学・分光学・構造解析に適している。 - 4.フィコシアニン
フィコビリソームを構成するタンパク質の一つで、光を吸収・伝達する色素フィコシアノビリンを持つ。三つのフィコシアニンでリング状の三量体を形成し、それが積み重なることでフィコビリソームのロッドを構築している。 - 5.クライオ電子顕微鏡
タンパク質などの生体分子を、水溶液中の生理的な環境に近い状態で、電子顕微鏡で観察するために開発された手法。まず、試料を含む溶液を液体エタン(約-170℃)中に落下させ急速凍結し、アモルファス(非晶質、ガラス状)な薄い氷に包埋する。これを液体窒素(-196℃)冷却下で、電子顕微鏡観察する。電子顕微鏡内の真空中で試料は氷中に保持でき、また、冷却することで電子線の照射による損傷を減らせる。リチャード・ヘンダーソンはグルコースを用いることで電子顕微鏡測定での試料の乾燥を防ぎ、そしてジャック・ドゥボシェは氷包埋の手順を作り、2017年のノーベル化学賞の受賞者に選ばれた。 - 6.単粒子解析
電子顕微鏡で撮影した多数の生体分子の画像から、その立体構造を決定する構造解析手法。目的試料の結晶を作製しなくても、立体構造情報を得ることができる。2017年のノーベル化学賞受賞者の1人であるヨアヒム・フランクらにより、単粒子解析の基礎が作られた。 - 7.フィコシアノビリン
青色の発色団(色素)で、シアノバクテリアや紅藻、灰色藻といった多くの藻類が持つ。太陽光エネルギーを吸収・伝達できる。 - 8.光化学系Ⅰ
植物や藻類の中に存在し、太陽光エネルギーを吸収して電子伝達を行い、二酸化炭素の還元に必要な還元力を形成する膜タンパク質複合体。クロロフィルやカロテノイドといった多数の色素を持ち、フィコビリソームから光エネルギーを受け取ることができる。 - 9.光化学系Ⅱ
植物や藻類の中に存在し、太陽光エネルギーを吸収して電子伝達を行うとともに、水を分解して酸素を発生させることができる膜タンパク質複合体。光化学系Ⅰと同様にクロロフィルやカロテノイドといった多数の色素を持ち、フィコビリソームから光エネルギーを受け取ることができる。 - 10.アロフィコシアニン
フィコビリソームを構成するタンパク質の一つで、光を吸収・伝達する色素フィコシアノビリンを持つ。三つのアロフィコシアニンでリング状の三量体を形成し、それが積み重なってシリンダーを形成することで、フィコビリソームの中心部分を構築している。 - 11.リンカータンパク質
フィコビリソームは、フィコシアニンやアロフィコシアニンといったタンパク質がディスク状の構造を構築してそれらが積み重なった超複合体であり、リンカータンパク質はフィコビリソームの超複合体構造を維持するためのタンパク質である。また、リンカータンパク質はフィコビリソーム内の発色団の吸収波長に変化を与え、吸収した光エネルギーを一方向に伝達する役割も持つ。 - 12.ピコ秒
時間の単位の一つで、1兆分の1秒。 - 13.ダルトン
原子や分子の質量を表す単位。炭素12(12C)の質量の12分の1が1ダルトン(1Da)と定義される。 - 14.X線結晶構造解析
対象とする物質の結晶を作製し、その結晶にX線を照射して回折強度データを収集・解析することで、対象とする物質の立体構造を調べるための手法。タンパク質の立体構造を調べるために広く用いられているが試料を結晶化する必要があり、フィコビリソームのような巨大かつ不安定な試料は結晶を作製することが不可能であるため、この手法で詳細な立体構造を解析できない。
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(C)「好熱性シアノバクテリア由来光合成超複合体の機能・構造解明(20K06528、研究代表者:川上恵典)」、新学術領域研究「光合成分子機構の学理解明と時空間制御による革新的光-物質変換系の創製(20H05109、研究代表者:川上恵典)、同新学術領域研究「高分解能・時間分解構造解析による水分解反応の機構解明(17H06434、研究代表者:沈建仁、研究分担者:神谷信夫)、科学技術振興機構(JST)未来社会創造事業探索加速型「微小結晶構造の自動・高精度電子線解析(JPMJMI20G5、研究代表者:米倉 功治)」、日本医療研究開発機構(AMED)医療研究開発革新基盤創成事業(CiCLE)、熊本大学パルスパワー科学研究所(現産業ナノマテリアル研究所)共同研究(2017~2019年度、研究代表者:川上恵典)などによる支援を受けて行われました。
原論文情報
- Keisuke Kawakami, Tasuku Hamaguchi, Yuu Hirose, Daisuke Kosumi, Makoto Miyata, Nobuo Kamiya, Koji Yonekura, "Core and rod structures of a thermophilic cyanobacterial light-harvesting phycobilisome", Nature Communications, 10.1038/s41467-022-30962-9
発表者
理化学研究所
放射光科学研究センター 利用技術開拓研究部門 生体機構研究グループ
研究員 川上 恵典(カワカミ・ケイスケ)
グループディレクター 米倉 功治(ヨネクラ・コウジ)
(東北大学 多元物質科学研究所 教授)
東北大学 多元物質科学研究所 生物分子機能計測研究分野
准教授 浜口 祐(ハマグチ・タスク)
大阪公立大学
人工光合成研究センター
特別招へい教授 神谷 信夫(カミヤ・ノブオ)
(大阪市立大学 名誉教授)
大学院理学研究科 生物学専攻
教授 宮田 真人(ミヤタ・マコト)
熊本大学 産業ナノマテリアル研究所
准教授 小澄 大輔(コスミ・ダイスケ)
豊橋技術科学大学 応用化学・生命工学系
准教授 広瀬 侑(ヒロセ・ユウ)
 川上 恵典
川上 恵典
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
東北大学 多元物質科学研究所 広報情報室
Tel: 022-217-5198
Email: press.tagen [at] grp.tohoku.ac.jp
大阪公立大学 広報課
Tel: 06-6605-3411 / Fax: 06-6605-3572
Email: t-koho [at] ado.osaka-cu.ac.jp
熊本大学 総務部 総務課 広報戦略室
Tel: 096-342-3269 / Fax: 096-342-3110
Email: sos-koho [at] jimu.kumamoto-u.ac.jp
豊橋技術科学大学 総務課企画・広報係
Tel: 0532-44-6506 / Fax: 0532-44-6509
Email: kouho [at] office.tut.ac.jp
科学技術振興機構 総務部広報課
Tel: 03-5214-8404 / Fax: 03-5214-8432
Email: jstkoho [at] jst.go.jp
JST事業に関すること
科学技術振興機構 未来創造研究開発推進部
小泉 輝武(コイズミ・テルタケ)
Tel: 03-6272-4004 / Fax: 03-6268-9412
Email: kaikaku_mirai [at] jst.go.jp
※上記の[at]は@に置き換えてください。
