理化学研究所(理研)環境資源科学研究センターケミカルゲノミクス研究グループの吉田稔グループディレクター、佐々木和樹上級研究員、ティルマン・シュナイダー・ポッチュ研究員、創薬シード化合物探索基盤ユニットの園田健テクニカルスタッフⅠ、開拓研究本部袖岡有機合成化学研究室の五月女宜裕専任研究員、どど孝介専任研究員、袖岡幹子主任研究員、生命機能科学研究センターエピジェネティクス制御研究チームの梅原崇史チームリーダーらの共同研究グループは、ヒストン[1]H3のメチル化とそれに伴うヘテロクロマチン[2]タンパク質HP1α[2]の相互作用を検出できる蛍光プローブの開発に成功しました。
本研究成果は、生細胞内におけるヒストンメチル化[1]の動態の追跡を可能にし、細胞内で作用するヒストンメチル基転移酵素(HMTase)[3]阻害剤の開発に貢献すると期待できます。
エピジェネティクス[4]の中心的な役割を担っているヒストン修飾は、環境の変化に応じてダイナミックに変化します。しかし、細胞を固定もしくは多数の細胞を同調させた従来の実験では、いつ、どのようにヒストン修飾が変化しているかを詳しく解析することは困難でした。
今回、共同研究グループは、ヒストンH3の9番目のリジン(H3K9)のトリメチル化(H3K9me3)を可視化する蛍光プローブ「Hismet-HP1αCD」を作製し、このプローブを用いて、細胞分裂期[5]におけるヒストンH3の翻訳後修飾[4]のダイナミックな変動を明らかにしました。
本研究は、科学雑誌『Cell Chemical Biology』(7月21日号)の掲載に先立ち、オンライン版(6月20日付:日本時間6月21日)に掲載されました。
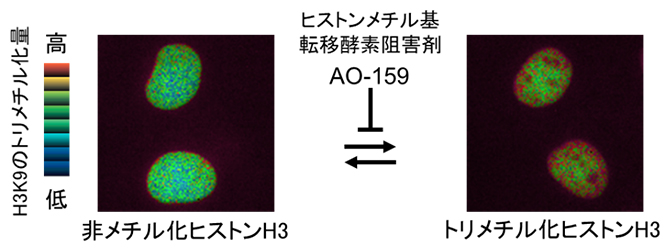
ヒストンメチル化蛍光プローブHismet-HP1αCDを発現させた細胞の核
背景
「エピジェネティクス」と呼ばれる遺伝子の塩基配列によらない発現制御機構は、クロマチン[2]の翻訳後修飾によって制御されており、DNAのメチル化やヒストンN末端のアセチル化、メチル化、リン酸化などがその役割の中心を担っていると考えられています。本研究では、これらのヒストン修飾のうち、凝縮したクロマチン領域である「ヘテロクロマチン」の構造形成や転写抑制に関与している「ヒストンH3の9番目のリジン(H3K9)のメチル化」に着目しました。
ヒストンH3K9は、ヒストンメチル基転移酵素(HMTase)であるG9a/GLPによってモノメチル化(H3K9me)、ジメチル化(H3K9me2)され、Suv39H1/2とSETDB1/2によってトリメチル化(H3K9me3)されます(図1上段)。「ヘテロクロマチンタンパク質HP1α」は、H3K9me3を認識するクロモドメイン(CD)と二量体化に関わるクロモシャドウドメイン(CSD)からなり、高次ヘテロクロマチン構造の形成および細胞分裂の際の染色体分配に関わっています。
ヒストンH3K9の隣に位置する10番目のセリン(H3S10)のリン酸化は、細胞分裂のマーカーとして知られています。しかし、ヒストンH3のメチル化とリン酸化の相互作用など、複数の翻訳後修飾が細胞分裂の際にどのように変化し、それに伴うHP1αCDの結合がどのように変化しているかは、高い時間分解能での解析が不可能だったことから分かっていませんでした。
これまで佐々木和樹上級研究員らは、生きた1細胞内でのヒストンアセチル化修飾の動態を観察するための蛍光プローブ「Histac」を開発し、時間・空間分解能の高いレベルでのヒストンアセチル化の解析が可能になりました注)。今回、共同研究グループは、このHistacのコンセプトを基に、ヒストンメチル化の蛍光プローブの開発を行い、細胞分裂過程におけるヒストンメチル化の変化を追跡することを目指しました。
- 注)2009年9月7日プレスリリース「遺伝子の働きを決めるヒストンアセチル化をリアルタイムで観察」
研究手法と成果
生細胞内のヒストンアセチル化の動態を観察できる「Histac」は、全長のヒストンとヒストン修飾結合タンパク質を柔軟なリンカーで結び、その両端に蛍光共鳴エネルギー移動(FRET)[6]を起こす蛍光タンパク質のペアであるCFP(青色蛍光タンパク質)とYFP(黄色蛍光タンパク質)をつないだものです。共同研究グループは、これを基本構造としてヒストン修飾結合タンパク質にHP1αCDを用いることで、プローブ内のヒストンH3K9がトリメチル化されると構造変化が起こり、FRET変化を起こす蛍光プローブを作製しました。
蛍光プローブがヒストンH3K9me3に応答することを検証するには、ヒストンH3のHMTaseを阻害する化合物が必要です。産業技術総合研究所の化合物ライブラリーから蛍光発生基質を用いた検出法[7]でスクリーニングを行った結果、モノメチル化・ジメチル化のHMTaseであるG9aとトリメチル化のHMTaseであるSuv39H1の両方を阻害する化合物AO-159がヒットしました(図1上段)。AO-159の特異性を、精製HMTaseを用いたAlphaLISA[8]で調べた結果、AO-159は選択性の低い汎HMTase阻害剤であることが分かりました。しかし、細胞毒性が低く、細胞内のH3K9me3を速やかに減少させられる性質を持つ化合物であったため、このAO-159を用いて蛍光プローブのH3K9me3への応答を検証しました。
蛍光プローブの候補の中からAO-159に対する応答が最も大きいものを選び、それを「Hismet-HP1αCD」と名付けました(図1下段)。このHismet-HP1αCDがクロマチンに取り込まれていることを分画実験および光褪色後蛍光回復(FRAP)解析[9]によって確認し、さらにH3K9のメチル化特異的に応答していることを部位特異的に変異させたプローブの応答の有無によって確認しました。
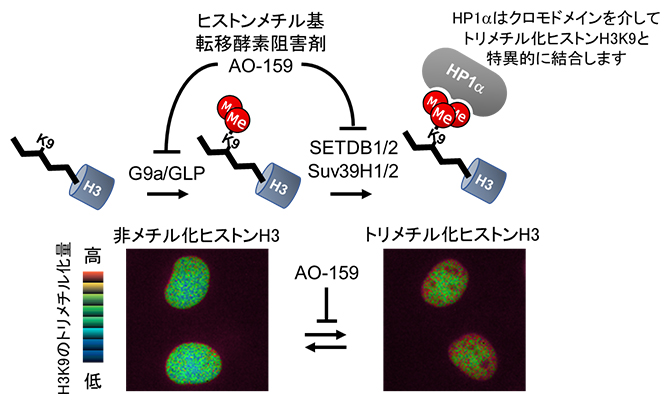
図1 ヒストンメチル化反応とHismet-HP1αCDを発現させたCOS7細胞の核
- 上段:ヒストンH3K9(左)は、ヒストンメチル基転移酵素(HMTase)であるG9a/GLPによってモノメチル化、ジメチル化され(中)、Suv39H1/2とSETDB1/2によってトリメチル化される(右)。トリメチル化されたヒストンH3はHP1αのCDと結合する。HMTase阻害剤のAO-159はG9aとSuv39H1の両方を阻害する。
- 下段:Hismet-HP1αCDをCOS7細胞(サル腎臓由来細胞)に発現させると、細胞核に局在する。CFPの蛍光(480nm)を蛍光共鳴エネルギー移動(FRET)により発生させたYFPの蛍光(波長535nm)で割った蛍光強度比を擬似カラーで表示している。AO-159によってヒストンH3K9のトリメチル化が減少するにつれて、赤から青に変わる。
次に、Hismet-HP1 αCDを生きた細胞に発現させ、細胞分裂の際のヒストンH3とHP1αCDの結合状態を蛍光顕微鏡で観察したところ、細胞分裂前期[5]に急激な結合が始まり、分裂前中期[5]に進むにつれて解離が見られ、分裂中期[5]でこの解離が止まった後、分裂後期[5]で再び解離するというダイナミックな変化が見られました(図2)。一方、CDの代わりに全長HP1αを用いた蛍光プローブでは、分裂前期で蛍光強度比(CFP/YFP)が上昇し、分裂後期で減少しました。
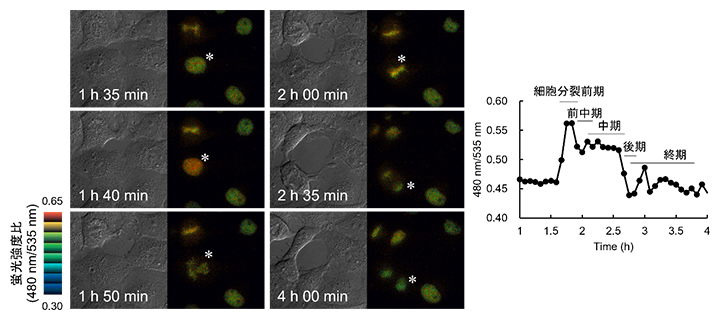
図2 Hismet-HP1αCD発現細胞が細胞分裂する際の微分干渉像と蛍光強度比
- 左:Hismet-HP1αCDをCOS7細胞に発現させ、その細胞周期を蛍光顕微鏡下で観察した。間期(1h 35min)、前期(1h 40min)、前中期(1h 50min)、中期(2h 00min)、後期(2h 35min)、終期(4h 00min)の細胞を微分干渉像(各左側)と蛍光強度比の擬似カラー表示(各右側)で示した。
- 右:左図の*で表示した細胞の核の蛍光強度比をグラフ化したもの。細胞分裂前期で蛍光強度比の急激な上昇と分裂前中期と後期での減少を観察した。
この応答の違いを検証するために、表面プラズモン共鳴(SPR)[10]を用いてヒストンH3の修飾ペプチドとHP1αの各ドメインとの結合を調べた結果、HP1αCDはH3K9me3に強く結合するものの、同時にヒストンH3の10番目のセリン(H3S10)のリン酸化が起こると、結合活性が著しく減少することが分かりました。一方、全長HP1αはH3K9me3が存在すれば、セリンのリン酸化の有無にかかわらず結合し続けました。この違いが蛍光プローブの応答性の違いを反映していると考えられます。
つまり、Hismet-HP1αCDを使うことで、細胞分裂前期のH3K9me3の急速な上昇、それに続いて細胞分裂中期で起こる隣接するH3S10のリン酸化、それに伴うHP1αCDとの相互作用の低下が順次細胞内で起こっていることを初めて明らかにしました。
今後の期待
エピジェネティクスの中心的な役割を担っているヒストン修飾は、環境の変化に応じてダイナミックに変化していますが、細胞を固定もしくは多数の細胞を同調させた従来の実験では、いつ、どのようにヒストン修飾が変化しているかを詳細に解析することは困難でした。
本研究で開発した蛍光プローブは、生きた細胞内のヒストンH3K9me3の動態をリアルタイムで解析することを可能にしました。この蛍光プローブを用いた試みは、細胞分裂のみならず細胞の分化[11]誘導などを含むさまざまなイベントにおけるエピジェネティックな作用機序の解明に貢献すると期待できます。
また近年、動物実験は縮小の傾向にありますが、細胞を生かしたまま検出する方法は有力な代替法の候補になり得るため、本研究成果は2016年に国際連合によって提唱された「持続可能な開発目標(SDGs)[12]」のうち、「12.つくる責任・つかう責任」への貢献も期待できます。
将来的に、細胞を生かしたまま生命現象のダイナミズムを可視化できる蛍光可視化技術は、基礎研究だけでなく、創薬から医療技術の応用に至るまで大きく発展していくものと考えています。
補足説明
- 1.ヒストン、ヒストンメチル化
ヒストンはH1、H2A、H2B、H3、H4の5種類からなり、DNAを巻き付かせて核内に高密度にパッキングさせる役割を担っている。ヒストンのN末端のリジン残基またはアルギニン残基のメチル化は、遺伝子発現制御やクロマチンの高次構造の形成に関わっていると考えられている。 - 2.ヘテロクロマチン、HP1α、クロマチン
ヒストンH2A、H2B、H3、H4の4種類8個のヒストンの周囲を147塩基対のDNAが巻き付いたヌクレオソームを基本単位として、複雑な高次構造を形成したものをクロマチンと呼ぶ。クロマチンは、凝縮したヘテロクロマチン領域と弛緩したユークロマチン領域に分かれており、ヘテロクロマチン領域では遺伝子の転写活性が低いことが知られている。HP1αはヘテロクロマチンの主要な構成因子であり、トリメチル化されたヒストンH3の9番目のリジン残基と結合するクロモドメインと2量体化ドメインであるクロモシャドウドメインからなる。HP1はHeterochromatin protein 1の略。 - 3.ヒストンメチル基転移酵素(HMTase)
ヒストンの特定のリジンもしくはアルギニン残基にメチル基を付加する酵素。HMTaseはHistone methyltransferaseの略。 - 4.エピジェネティクス、翻訳後修飾
エピジェネティクスとはDNA配列の変化を伴わない遺伝子発現を制御する機構で、細胞分裂後もその状態は継承される。その制御機構の中心的な役割を担っているのが、DNAメチル化およびヒストンメチル化、アセチル化、リン酸化などの翻訳後修飾である。 - 5.細胞分裂期、前期、前中期、中期、後期
1個の細胞が分裂して2個の細胞になることを細胞分裂という。細胞分裂は、間期、前期、前中期、中期、後期、終期に分類される。前期では、核の染色質が凝集し始め染色体となり核膜が見えなくなる。前中期では、凝集した染色体が細胞の中央に集まっていき、中期には染色体が細胞の赤道面に直線に並ぶ。後期になると染色体が分離し、それぞれ反対側の方向に移動し、終期では核膜が再生され細胞質分裂が起こる。細胞分裂後、次の分裂が始まるまでの期間を間期という。 - 6.蛍光共鳴エネルギー移動(FRET)
励起状態のドナー分子から近接するアクセプター分子にエネルギーが遷移する現象で、励起スペクトルと蛍光スペクトルの重なりを持つ二つの蛍光色素間で起こる。本蛍光プローブでは、その条件を満たす緑色蛍光タンパク質(GFP)の変異体であるCFP(青色蛍光タンパク質)とYFP(黄色蛍光タンパク質)を用いた。FRETはFörster/fluorescent resonance energy transferの略。 - 7.蛍光発生基質を用いた検出法
ヒストンメチル化基質ペプチド付き蛍光色素メチルクマリンアミド(λex: 330nm、λem: 380nm)は、タンパク質分解酵素であるトリプシン処理により分解反応が起こり、7-アミノ-4-メチルクマリン(AMC、λex: 390nm、λem: 460nm)が遊離する。ヒストンメチル基転移酵素(HM Tase)によってこの蛍光色素の付いたヒストン基質がメチル化されるとトリプシンの分解が抑制されるため、AMCの遊離が起こらなくなる。これを指標にHM Tase阻害剤の評価が可能になる。 - 8.AlphaLISA
ドナー・アクセプター2種類のビーズを用いて、分子間の相互作用を検出する手法。ドナービーズに結合した基質タンパク質が酵素によって修飾されると、アクセプタービーズに結合した修飾タンパク質を認識する抗体と結合し、二つのビーズが近接し、発光シグナルが検出される。ドナービーズはレーザーによって一重項酸素を発生させ、近接するアクセプタービーズ内の化学発光反応を誘導し発光する。 - 9.光褪色後蛍光回復(FRAP)解析
細胞の中の一部分に強いレーザーを当てて褪色させ、その部分の蛍光の回復を観察する方法。蛍光分子の流動性が低いほど、蛍光の回復が遅くなる。FRAPはFluorescence recovery after photobleachingの略。 - 10.表面プラズモン共鳴(SPR)
センサーチップ上の質量変化を表面プラズモン共鳴により生じる全反射角度の変化として検出する方法。分子間相互作用をラベルフリーで検出でき、結合速度定数、解離定数を算出できる。SPRはSurface plasmon resonanceの略。 - 11.細胞の分化
細胞が特定の機能を持つ細胞になることを細胞の分化という。 - 12.持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴール、169のターゲットから構成され、発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる。(外務省ホームページから一部改変して転載)
共同研究グループ
理化学研究所
環境資源科学研究センター
ケミカルゲノミクス研究グループ
上級研究員 佐々木 和樹(ささき かずき)
研修生(研究当時) 鈴木 律裕(すずき みちひろ)
研究員 ティルマン・シュナイダー・ポッシュ(Tilman Schneider-Poetsch)
専任研究員(研究当時) 伊藤 昭博(いとう あきひろ)
(現 東京薬科大学 生命科学部 教授、理研 同客員主管研究員)
グループディレクター 吉 田稔(よしだ みのる)
(創薬シード化合物探索基盤ユニット 基盤ユニットリーダー)
創薬シード化合物探索基盤ユニット
テクニカルスタッフⅠ 園田 健(そのだ たけし)
開拓研究本部 袖岡有機合成化学研究室
専任研究員 五月女 宜裕(そうとめ よしひろ)
(環境資源科学研究センター 触媒・融合研究グループ 専任研究員)
専任研究員 どど 孝介(どど こうすけ)
(環境資源科学研究センタ ー触媒・融合研究グループ 専任研究員)
研修生(研究当時) 藤城 信哉(ふじしろ しんや)
主任研究員 袖岡 幹子(そでおか みきこ)
(環境資源科学研究センター 触媒・融合研究グループ グループディレクター)
生命機能科学研究センター エピジェネティクス制御研究チーム
チームリーダー 梅原 崇史(うめはら たかし)
産業技術総合研究所 生命工学領域
グループ長 新家 一男(しんや かずお)
福島県立医科大学 ふくしま国際医療科学センター 医療-産業TRセンター
教授 高木 基樹(たかぎ もとき)
早稲田大学 先進理工学部
教授 中尾 洋一(なかお よういち)
東京大学 先端科学技術研究センター
シニアリサーチフェロー 油谷 浩幸(あぶらたに ひろゆき)
研究支援
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業(さきがけ)「エピジェネティクスの制御と生命機能(研究代表者:佐々木和樹)」、日本学術振興会(JSPS)科学研究費補助金基盤研究(S)「革新的化学遺伝学による内在性代謝物の新機能の解明と応用(研究代表者:吉田稔)」、同新学術領域研究(研究領域提案型)「ケモテクノロジーが拓くユビキチンニューフロンティア(領域代表者:佐伯泰)」による支援を受けて行われました。
原論文情報
- Kazuki Sasaki, Michihiro Suzuki, Takeshi Sonoda, Tilman Schneider-Poetsch, Akihiro Ito, Motoki Takagi, Shinya Fujishiro, Yoshihiro Sohtome, Kosuke Dodo, Takashi Umehara, Hiroyuki Aburatani, Kazuo Shin-ya, Yoichi Nakao, Mikiko Sodeoka, Minoru Yoshida, "Visualization of the dynamic interaction between nucleosomal histone H3K9 trimethylation and HP1α chromodomain in living cells", Cell Chemical Biology, 10.1016/j.chembiol.2022.05.006
発表者
理化学研究所
環境資源科学研究センター ケミカルゲノミクス研究グループ
グループディレクター 吉田 稔(よしだ みのる)
上級研究員 佐々木 和樹(ささき かずき)
研究員 ティルマン・シュナイダー・ポッチュ(Tilman Schneider-Poetsch)
創薬シード化合物探索基盤ユニット
テクニカルスタッフⅠ 園田 健(そのだ たけし)
開拓研究本部 袖岡有機合成化学研究室
専任研究員 五月女 宜裕(そうとめ よしひろ)
専任研究員 どど 孝介(どど こうすけ)
主任研究員 袖岡 幹子(そでおか みきこ)
生命機能科学研究センター エピジェネティクス制御研究チーム
チームリーダー 梅原 崇史(うめはら たかし)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
