理化学研究所(理研)環境資源科学研究センターバイオ高分子研究チームの緑川景子特別研究員(研究当時、現宇都宮大学バイオサイエンス教育研究センター特任助教)、児玉豊客員主管研究員(宇都宮大学バイオサイエンス教育研究センター教授)、沼田圭司チームリーダー(京都大学大学院工学研究科教授)らの研究チームは、電子顕微鏡画像と3次元画像再構築技術[1]により、モデル植物であるシロイヌナズナの葉肉細胞を、高解像度で3次元画像に再現しました。
本研究成果は、光を受けた植物細胞内で細胞小器官(オルガネラ[2])がどのように変化するのか、その環境応答メカニズムを細胞レベルで解明するための新たな手段になると期待できます。
今回、研究チームは、電子顕微鏡による超薄連続切片技術と3次元画像再構築技術を組み合わせたアレイトモグラフィー法[3]を用いて、シロイヌナズナの葉肉細胞内のオルガネラの形態や配置を高解像度で解析しました。さらに、光を当てた細胞(明処理群)と光を当てなかった細胞(暗処理群)では、細胞内のオルガネラの形態やオルガネラ間の接触面積が異なることを初めて定量的に示しました。
本研究は、科学雑誌『PNAS Nexus』オンライン版(10月4日付)に掲載されました。
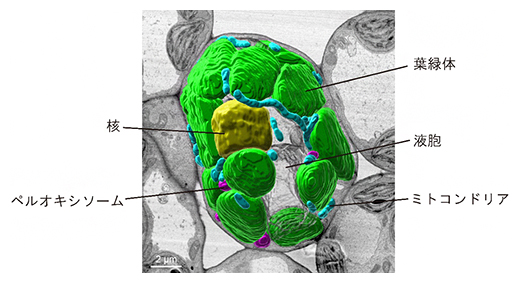
アレイトモグラフィー法により電顕画像から3次元再構築されたシロイヌナズナ葉肉細胞
背景
細胞内には多数の細胞小器官(オルガネラ)が存在し、それぞれが協調的に働くことによって、さまざまな生命活動を支えています。植物細胞内では、葉緑体、ペルオキシソーム[4]、ミトコンドリアの三つのオルガネラを介して、光合成反応に伴う光呼吸[5]が行われます。古くからペルオキシソームとミトコンドリアが葉緑体に物理的に接触している様子が観察されており、光呼吸との関連性が示唆されていました。
しかし、細胞内のオルガネラの形や位置関係が光に応答して、実際にどのように変化しているのかはよく分かっていませんでした。その理由として、植物細胞が他の生物の細胞に比べて大きいこと、そしてオルガネラの形態や配置が細胞内で不均一であることが挙げられます。そのため、一部のオルガネラの応答が捉えられても、細胞全体でどのように変化しているのか、細胞全体での応答は把握できていませんでした。特に、オルガネラの形態や位置を定量的に解析するためには、電子顕微鏡レベルの高解像度での解析が必要ですが、比較的大きな植物細胞では、細胞全体をナノメートル(nm、1nmは10億分の1メートル)の解像度で解析することは困難でした。
研究手法と成果
研究チームは、植物細胞内のオルガネラの形態や配置が光に応じてどのように変化するのかを調べるため、光呼吸に関わる葉緑体、ペルオキシソーム、ミトコンドリアの三つのオルガネラに着目し、その形態や配置を、光を当てた細胞(明処理群)と光を当てなかった細胞(暗処理群)で比較しました。
通常、細胞内部の微細構造の観察には、解像度の高い透過型電子顕微鏡[6]が用いられます。しかし、試料を100nm以下の非常に薄い切片にする必要があり、一辺が100nmの1,000倍に相当する、100マイクロメートル(μm、1μmは100万分の1メートル)程度もある植物細胞に適用することは困難でした。
一方、細胞内のオルガネラの観察に最も汎用される共焦点顕微鏡[7]では、オルガネラの形態や接触部位の詳細を得るための十分な解像度が得られません。そこで、電界放出型走査電子顕微鏡(FE-SEM)[8]を使用したアレイトモグラフィー法に着目しました。電子顕微鏡を使用したアレイトモグラフィー法は、高解像度を維持したまま、広い視野の観察を可能にします。研究チームはこの手法を使用して、シロイヌナズナの1個の葉肉細胞を丸ごと3次元画像に再構築することに成功しました(図1)。
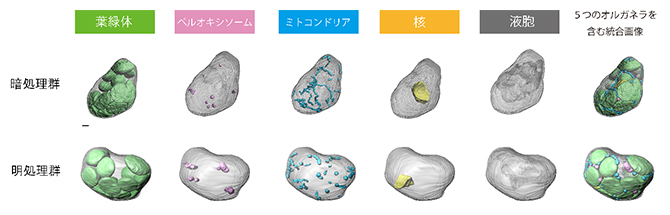
図1 3次元再構築したシロイヌナズナの葉肉細胞
電界放出型走査電子顕微鏡(FE-SEM)を用いたアレイトモグラフィー法により3次元再構築された、葉緑体(緑)、ペルオキシソーム(ピンク)、ミトコンドリア(水色)、核(黄色)、液胞(灰色)の五つのオルガネラを含むシロイヌナズナの葉肉細胞。暗所で処理した葉と明所で処理した葉からそれぞれ3細胞ずつ選び、計6細胞を解析した。図は、それぞれ解析された暗処理群または明処理群に属する細胞のうちの一つを示す。
構築した3次元画像を基に、まず、三つのオルガネラの体積や球形度を明処理群と暗処理群で比較しました。その結果、明処理群には、体積が大きいペルオキシソームが多く含まれていることが分かりました(図2A左)。一方、ミトコンドリアの体積は、2群間で違いはありませんでしたが、明処理群では高い球形度、つまり、より単純な形態のミトコンドリアが多いことが分かりました(図2A右、2B)。
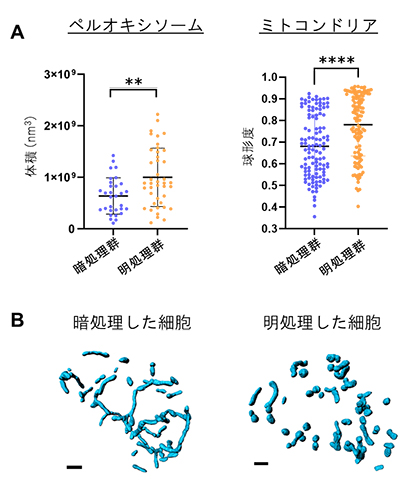
図2 明所と暗所におけるオルガネラの形態比較
- A)暗処理群・明処理群におけるペルオキシソームの体積およびミトコンドリアの球形度の比較。球形度は1に近いほど球形に近い形態、すなわち単純な形態であることを示す。
- B)暗処理した細胞および明処理した細胞のミトコンドリアの形態比較。暗処理した細胞では、ミトコンドリアが細長い形態をしている一方、明処理した細胞では、より単純な形態をしている。スケールバーは2μm。
続いて、葉緑体、ペルオキシソーム、ミトコンドリアの接触頻度(接触している箇所の数)および接触面積を分析しました(図3A)。接触部位の検出と接触面積は、画像解析用ソフトウェアImarisが提供するアルゴリズムによって決定しました。暗処理群と明処理群の接触頻度と細胞当たりの総接触面積、そして1接触当たりの面積を比較したところ、接触頻度は明処理群で多い傾向にはあったものの、それ以上に、1接触当たりの面積が顕著に大きくなっていることが明らかになりました(図3B)。これらの結果は、細胞の光受容は、オルガネラ間の新たな接触部位を増加させるよりも、既存の接触部位を拡張させるように促すことを示唆しています。
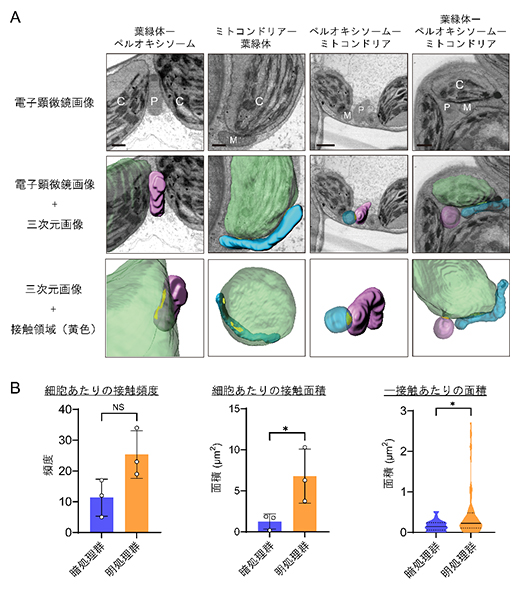
図3 葉緑体、ペルオキシソーム、ミトコンドリアの接触部位と定量的比較
- A)葉緑体(C、緑)、ペルオキシソーム(P、ピンク)、ミトコンドリア(M、水色)の接触部位。上段は電子顕微鏡画像、中段は電子顕微鏡画像と3次元画像の重ね合わせ、下段は3次元画像から計算された二つのオルガネラの接触領域(黄色)を表す。スケールバーは1μm。
- B)葉緑体とペルオキシソーム間の接触部位の定量解析。暗処理群・明処理群における細胞当たりの接触頻度および面積、1接触当たりの面積の比較。明処理群では、接触頻度(左)は暗処理群と有意な差がなかったものの、1接触当たりの面積(右)は有意に大きかった。
光を受けた細胞内では、光合成反応とともに光呼吸が活発になります。今回明らかになったペルオキシソームやミトコンドリアの形態変化、および葉緑体・ペルオキシソーム・ミトコンドリアの接触領域の拡張は、光呼吸の効率化を促すためのものだと考えられます。
今後の期待
本研究では、一つの植物細胞を丸ごと3次元に再構築することで、正確な形態解析や接触部位の詳細をナノメートルの解像度で得られ、細胞が光を受けた際のオルガネラの変化を細胞全体で定量的に捉えることができました。その結果、細胞外部の環境に応じてオルガネラの形態や配置を制御するメカニズムの存在も示唆されました。
今後、明暗だけではなく、植物がさらされるさまざまなストレス環境下におけるオルガネラの詳細が得られれば、細胞内の代謝効率を定量的に評価する手法の開発につながると期待できます。
補足説明
- 1.3次元画像再構築技術
連続した2次元画像を重ね合わせ、元の3次元の画像を再構築する手法。 - 2.オルガネラ(細胞小器官)
細胞内部に存在している膜で区切られた構造体。それぞれ特定の機能を持つ。 - 3.アレイトモグラフィー法
固定され樹脂包埋された生物試料から連続切片を作製し、各切片の同一箇所を電子顕微鏡で観察し、その連続画像を積み重ねることによって3次元観察を行う手法。 - 4.ペルオキシソーム
真核細胞に普遍的に存在する細胞小器官の一つ。植物細胞では、脂肪酸代謝のβ酸化や光呼吸におけるグリコール酸の酸化などを行う。 - 5.光呼吸
ペルオキシソーム、ミトコンドリア、葉緑体にまたがる代謝系で、Rubisco(ribulose 1,5-bisphosphate carboxylase/oxygenase)の酸化反応で生じたホスホグリコール酸をホスホグリセリンに変換する代謝経路。 - 6.透過型電子顕微鏡
電子線を利用して試料をナノメートルの解像度で詳細に観察できる顕微鏡の一種。 - 7.共焦点顕微鏡
観察したい焦点面以外で発生した蛍光を除去した画像を取得できる顕微鏡。高いコンストラクトで解像度の良い画像が得られる。 - 8.電界放出型走査電子顕微鏡(FE-SEM)
対象試料に電子線を照射した際に放出される二次電子や放射電子を用いて微小な物質を観察する顕微鏡。主に試料表面の微細構造の観察に用いられる。FE-SEMはField Emission Scanning Electron Microscopeの略。
研究チーム
理化学研究所環境資源科学研究センター
バイオ高分子研究チーム
チームリーダー沼田圭司(ヌマタ・ケイジ)
(京都大学大学院工学研究科教授)
特別研究員(研究当時)緑川景子(ミドリカワ・ケイコ)
(現宇都宮大学バイオサイエンス教育研究センター特任助教)
テクニカルスタッフⅠ立石綾香(タテイシ・アヤカ)
特別研究員(研究当時)今井拓人(イマイ・タクト)
客員主管研究員児玉豊(コダマ・ユタカ)
(宇都宮大学バイオサイエンス教育研究センター教授)
技術基盤部門質量分析・顕微鏡解析ユニット
上級技師豊岡公徳(トヨオカ・キミノリ)
技師佐藤繭子(サトウ・マユコ)
研究支援
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業 総括実施型研究(ERATO)「沼田オルガネラ反応クラスタープロジェクト(研究総括:沼田圭司)」による助成を受けて行われました。
原論文情報
- Keiko Midorikawa, Ayaka Tateishi, Kiminori Toyooka, Mayuko Sato, Takuto Imai, Yutaka Kodama, Keiji Numata., "Three-dimensional nanoscale analysis of light-dependent organelle changes in Arabidopsis mesophyll cells", PNAS Nexus, 10.1093/pnasnexus/pgac225
発表者
理化学研究所
環境資源科学研究センターバイオ高分子研究チーム
チームリーダー沼田圭司(ヌマタ・ケイジ)
(京都大学大学院工学研究科教授)
特別研究員(研究当時)緑川景子(ミドリカワ・ケイコ)
(現宇都宮大学バイオサイエンス教育研究センター特任助教)
客員主管研究員児玉豊(コダマ・ユタカ)
(宇都宮大学バイオサイエンス教育研究センター教授)
 緑川景子
緑川景子
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
宇都宮大学広報室(広報係)
Tel: 028-649-5201 / Fax: 028-649-5026
Email: kkouhou [at] miya.jm.utsunomiya-u.ac.jp
京都大学総務部広報課国際広報室
Tel: 075-753-5729 / Fax: 075-753-2094
Email: comms [at] mail2.adm.kyoto-u.ac.jp
※上記の[at]は@に置き換えてください。
