理化学研究所(理研)放射光科学研究センター 利用技術開拓研究部門 SACLA利用技術開拓グループの岩田 想 グループディレクター(京都大学大学院 医学研究科 教授)、分子動画研究チームの南後 恵理子 チームリーダー(東北大学 多元物質科学研究所 教授)、高輝度光科学研究センター XFEL利用研究推進室 実験技術開発チームの登野 健介 チームリーダーらの国際共同研究グループは、X線自由電子レーザー(XFEL)[1]を用いて、ロドプシン[2]という視覚に関わるタンパク質が光刺激によって1ピコ秒(1兆分の1秒)~100ピコ秒という超高速で変化する過程を、原子の動きまで克明に動画として捉えることに成功しました。
本研究成果は、ヒトの視覚のメカニズムの理解につながるだけでなく、創薬ターゲットとして重要なGタンパク質共役型受容体[3]の活性化機構を理解する上でも重要な知見になると期待できます。
ロドプシンは眼の網膜に存在する膜タンパク質であり、光をキャッチするためのレチナール[2]という共役アルデヒドを含んでいます。ロドプシンは、高感度で光を感受できることから、薄暗い環境において物を見る役割(暗所視)を果たします。光を受けたロドプシンは構造変化を引き起こし、それが細胞内へ信号として伝わり、最終的に"物を見る"ことができます。しかし、ロドプシン内部でのレチナールの変化の詳細は不明でした。
今回、国際共同研究グループは、ロドプシンが光で変化する様子の原子レベルでの動画撮影に成功し、視覚の初期段階におけるメカニズムを解明しました。
本研究は、科学雑誌『Nature』の掲載に先立ち、オンライン版(3月22日付:日本時間3月23日)に掲載されました。
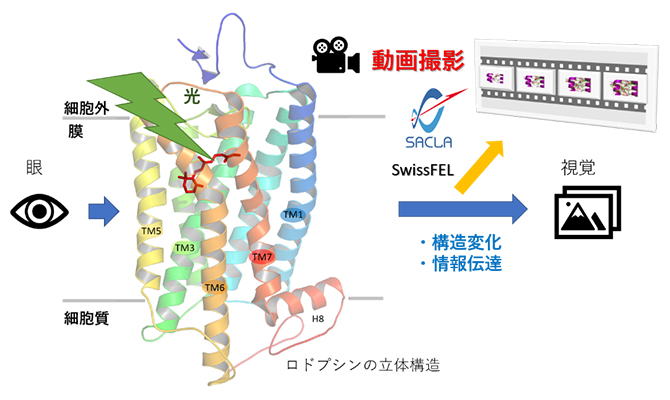
今回の研究成果の概略図
背景
視覚は、生物が外界の状態を認識するための重要な感覚の一つです。視覚に関わるロドプシンは眼の網膜に存在する膜タンパク質です。また、神経伝達物質などのさまざまなシグナルを受容するGタンパク質共役型受容体の一つとしても知られています。ロドプシンは、ビタミンAの誘導体であるレチナールという共役アルデヒドを発色団として含んでおり、高感度で光を感受できることから、薄暗い環境において物を見る役割(暗所視)を果たします。光を受けたロドプシンは、レチナールが立体選択的に異性化することで、タンパク質の構造変化を誘起し、それが細胞内へ信号として伝わって最終的に生物は"物を見る"ことができます。
ロドプシンが光によってどのように構造を変化させるのか、その視覚の詳細なメカニズムに興味が持たれてきましたが、試料の入手が難しく、微弱な光であっても結晶が損傷するなどのさまざまな困難が実験の障壁となっていました。
一般的に、タンパク質の立体構造を原子レベルで可視化するための強力な手段として、X線結晶構造解析[4]が用いられています。実際、2000年にロドプシンの立体構造が大型放射光施設「SPring-8」[5]のX線を用いて解析され、Gタンパク質共役型受容体として初の構造決定の快挙となりました。しかし、従来のX線で観察される構造は静止した状態のみであり、素早く変化する過程を捉えることは不可能でした。最近になって、X線自由電子レーザー(XFEL)の登場により、フェムト秒(1フェムト秒は1,000兆分の1秒)に至る時間分解能、かつ原子分解能でタンパク質の動きを捉えることが技術的に可能になりました。
岩田グループディレクターらはXFELを利用して、2016年にプロトン輸送に関与する光受容タンパク質(バクテリオロドプシン)が光を受けてからナノ秒(1ナノ秒は10億分の1秒)~ミリ秒(1ミリ秒は1,000分の1秒)後にプロトン(H+)を輸送し、構造変化する様子を動画として捉えることに初めて成功しました注1)。また、2018年には、同じタンパク質で、さらに早い段階である光照射後フェムト秒からピコ秒(1ピコ秒は1兆分の1秒)の動画撮影にも成功しました注2)。今回は、より難易度の高いタンパク質である視覚ロドプシンが超高速で変化する過程を捉えることに挑みました。
- 注1)2016年12月26日京都大学プレスリリース「タンパク質中の原子の動き、自由電子レーザーにより動画撮影に成功」
- 注2)2018年6月15日理化学研究所プレスリリース「フェムト秒スケールのタンパク質分子動画」
研究手法と成果
国際共同研究グループは、スイスのXFEL施設「SwissFEL」[6]と日本のXFEL施設「SACLA」[7]において、連続フェムト秒結晶構造解析(SFX)法[8]とポンプ・プローブ法[9]を組み合わせた手法を用いて実験を行いました(図1)。
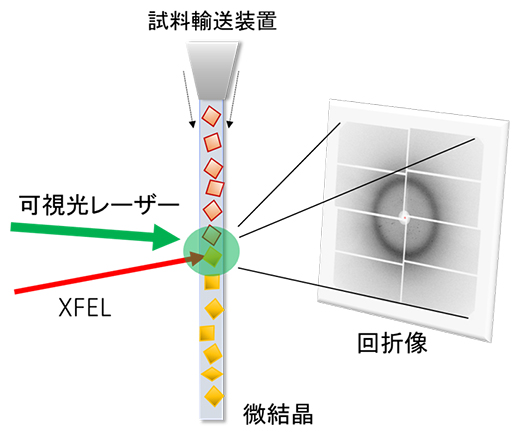
図1 連続フェムト秒結晶構造解析(SFX)法
タンパク質の微結晶をXFEL照射領域に連続的に送り、可視光レーザーを照射して、光によるタンパク質の反応を開始させる。光照射後のタンパク質の構造変化をXFELによる回折像を得ることで調べることができる。
ウシ由来のロドプシンの結晶に光を照射して反応を開始させた後、1ピコ秒から100ピコ秒にかけて測定を行い、時間ごとに変わっていくタンパク質の構造変化を動画撮影しました(図2)。撮影した中間体の構造は、1.8オングストローム(Å、1Åは100億分の1メートル)という高い空間分解能で決定することに成功しました。
光照射前のロドプシン構造においては、レチナールは11-シス型[10]を形成していますが、光照射1ピコ秒後の構造では全トランス型[10](四つの二重結合が全てトランス型)へと異性化し、レチナール中の20番目のメチル基が大きく回転して歪んだ形をとることが明らかになりました(図2右)。また、光照射前のレチナールとその周辺アミノ酸残基の間には、多くの相互作用が観察された一方で、レチナールが光照射により歪んだ全トランス型を形成すると、大半の相互作用が弱められた状態になることが分かりました(図2右)。特に、情報伝達に関わるGタンパク質の結合に重要な3番目のヘリックス(TM3)とレチナールとの相互作用が弱くなることが分かり、こうした構造変化が視覚のメカニズムに関与することが明らかになりました。
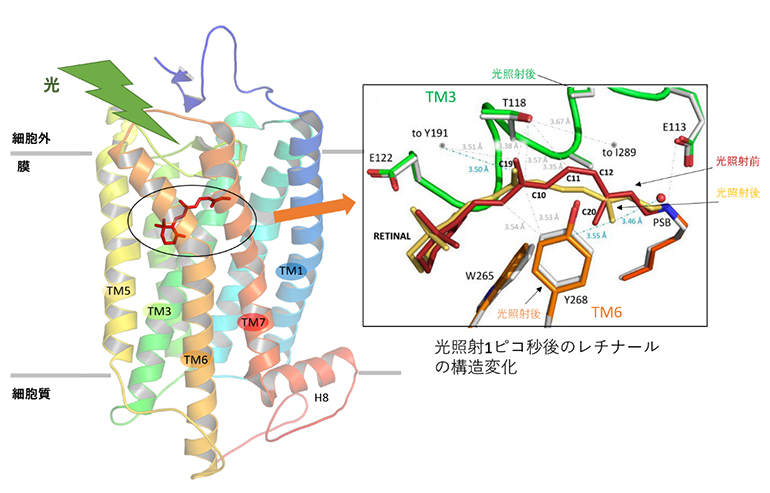
図2 光照射1ピコ秒後におけるレチナールの構造変化
- 左:眼の網膜の細胞膜に存在するロドプシンの構造。8種類のヘリックスから成る。黒丸で囲まれた部分がレチナール。
- 右:光照射前後のレチナール(中央)とロドプシンのヘリックスTM3およびTM6のアミノ酸残基との相互作用を示す。レチナールの構造が変化している。光照射前は11-シス型(C7=C8、C9=C10、C11=C12、C13=C14の四つの二重結合のうち、C11=C12のみがシス型)だが、光照射後は全トランス型(四つの二重結合が全てトランス型)に異性化するため、C13に結合しているメチル基(C20)が大きく回転し、歪んだ構造となる。その影響で、レチナールとヘリックスとの相互作用が弱まっている。(光照射前は赤、白で表示、1ピコ秒後:黄色、緑、オレンジで表示。)
一般的に、Gタンパク質共役型受容体は不活性型で存在し、外部から作動薬[11]を取り込み、結合することによって活性化して機能を発現することが知られています。一方、ロドプシンでは、逆作動薬[11]として働く11-シス型レチナールが共有結合し不活性化した状態から、光異性化によって作動薬(全トランス型)へと変化して活性化する違いがあります。しかし、今回観察された構造変化は、Gタンパク質共役型受容体の活性化に重要とされる多くの領域で起きていることが明らかになりました。
今後の期待
本研究成果は、視覚の初期段階やそのメカニズムを理解する上で重要な知見となります。本成果で用いられた手法は、光で反応するさまざまなタンパク質の構造変化を捉え、仕組みを明らかにすると期待できます。特に、創薬ターゲットとして重要なGタンパク質共役型受容体の活性化機構の解明に貢献することが今後期待できます。
補足説明
- 1.X線自由電子レーザー(XFEL)
X線領域におけるレーザーのこと。従来の半導体や気体を発振媒体とするレーザーとは異なり、真空中を高速で移動する電子ビームを媒体とするため、原理的には波長の制限はない。また、数フェムト秒(1フェムト秒は1,000兆分の1秒)の超短パルスを出力する。XFELはX-ray Free Electron Laserの略。 - 2.ロドプシン、レチナール
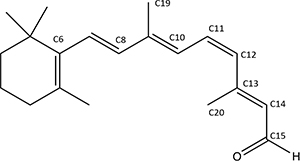
レチナールは、下図の構造をした共役アルデヒドである(図は11-シス型で、6員環のC6に四つの二重結合を持つアルデヒド基が結合している)。オプシン(視物質のタンパク質部分)を作っているアミノ酸のリジン残基と反応してロドプシンとなる。ロドプシンは、二重結合を巧みに異性化させることにより、視細胞で光を感知する鍵分子である。
- 3.Gタンパク質共役型受容体
細胞膜に存在する膜タンパク質で、神経伝達物質や生理活性物質などのシグナル分子を受容すると構造変化を起こし、細胞質側でGタンパク質などと相互作用することにより情報伝達を行う。 - 4.X線結晶構造解析
タンパク質が規則正しく並んだ結晶にX線を照射すると、回折像が得られる。その回折像を解析して、タンパク質の構造を解明する実験手法。タンパク質を構成する個々の原子の位置を決定できる。 - 5.大型放射光施設「SPring-8」
理研が所有する兵庫県の播磨科学公園都市にある世界でもトップクラスの放射光を生み出す大型放射光施設で、利用者支援などは高輝度光科学研究センターが行っている。SPring-8の名前はSuper Photon ring-8 GeVの略。放射光を用いてナノテクノロジー、バイオテクノロジーや産業利用まで幅広い研究が行われている。 - 6.XFEL施設「SwissFEL」
スイスのポール シェラー研究所にあるXFEL施設で、2016年に発足した。全長700m強とSACLAと同様にコンパクトなXFEL施設として知られる。 - 7.XFEL施設「SACLA」
理研と高輝度光科学研究センターが共同で建設した日本で初めてのXFEL施設。2011年3月に施設が完成し、SPring-8 Angstrom Compact free electron LAserの頭文字を取ってSACLAと命名された。コンパクトな施設の規模にもかかわらず、0.1nm以下という世界最短波長クラスのレーザーの生成能力を持つ。 - 8.連続フェムト秒結晶構造解析(SFX)法
多数の微結晶を含む液体などをインジェクター(試料輸送装置)から噴出しながら、X線レーザーを照射し結晶の構造を解析する手法。配向の異なる多数の微結晶からの回折イメージを連続的に収集する。SFXはSerial Femtosecond Crystallographyの略。 - 9.ポンプ・プローブ法
時間分解計測の中で最も広く使われている手法。ポンプ光とプローブ光の2種類の短パルス光を利用して、ポンプ光の照射によって誘起される物質内の過渡的な(超)高速現象をプローブ光で観察する。ポンプ光の照射からプローブ光の照射までの時間差を変化させながら試料の状態を観察することで、(超)高速現象の時間発展を調べることができる。 - 10.シス型、トランス型
同じ平面構造式を持ちながら、原子あるいは官能基が異なった立体配置をとる立体異性の一種。炭素・炭素原子間に二重結合を持つR1R2C=CR1R2の化合物などにおいて、同種の基(R1とR1、R2とR2)が二重結合について、同じ側にある配置をシス型、反対側にある配置をトランス型という。このシス型とトランス型が入れ替わることをシス-トランス異性化と呼ぶ。 - 11.作動薬、逆作動薬
作動薬は、受容体に結合して活性化し、細胞内情報伝達を開始させることにより特定の生理作用を起こす薬物。逆作動薬は、逆の作用を起こす薬物。
国際共同研究グループ
理化学研究所 放射光科学研究センター 利用技術開拓研究部門
SACLA利用技術開拓グループ
グループディレクター 岩田 想(イワタ・ソウ)
(京都大学大学院 医学研究科 教授)
分子動画研究チーム
チームリーダー 南後 恵理子(ナンゴ・エリコ)
(東北大学 多元物質科学研究所 教授)
高輝度光科学研究センター XFEL利用研究推進室 実験技術開発チーム
チームリーダー 登野 健介(トノ・ケンスケ)
ほか、ポール・シェラー研究所、ヨーテボリ大学、スイス連邦工科大学チューリッヒ校、ローザンヌ工科大学などの大学・研究機関が参加。
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業新学術領域研究「高速分子動画法によるタンパク質非平衡状態構造解析と分子制御への応用(領域代表:岩田想)」、同基盤研究(B)「X線自由電子レーザーによるGタンパク質共役型受容体の活性化機構の解明(研究代表者:南後恵理子)」「光駆動型イオンポンプの分子動画解析とその応用(研究代表者:南後恵理子)」、日本医療研究開発機構(AMED)創薬等ライフサイエンス研究支援基盤事業創薬等先端技術支援基盤プラットフォーム(BINDS)「創薬等ライフサイエンス研究のための相関構造解析プラットフォームによる支援と高度化(SPring-8/SACLAにおけるタンパク質立体構造解析の支援および高度化)(研究代表者:山本雅貴)」による助成を受けて行われました。
原論文情報
- Thomas Gruhl, Tobias Weinert, Matthew Rodrigues, Christopher J Milne, Giorgia Ortolani, Karol Nass, Eriko Nango, Saumik Sen, Philip J M Johnson, Claudio Cirelli, Antonia Furrer, Sandra Mous, Petr Skopintsev, Daniel James, Florian Dworkowski, Petra Båth, Demet Kekilli, Dmitry Ozerov, Rie Tanaka, Hannah Glover, Camila Bacellar, Steffen Brünle, Cecilia M Casadei, Azeglio D Diethelm, Dardan Gashi, Guillaume Gotthard, Ramon Guixà-González, Yasumasa Joti, Victoria Kabanova, Gregor Knopp, Elena Lesca, Pikyee Ma, Isabelle Martiel, Jonas Mühle, Shigeki Owada, Filip Pamula, Daniel Sarabi, Oliver Tejero, Ching-Ju Tsai, Niranjan Varma, Anna Wach, Sébastien Boutet, Kensuke Tono, Przemyslaw Nogly, Xavier Deupi, So Iwata, Richard Neutze, Jörg Standfuss, Gebhard Schertler, Valerie Panneels, "Ultrafast structural changes direct the first molecular events of vision", Nature, 10.1038/s41586-023-05863-6
発表者
理化学研究所
放射光科学研究センター 利用技術開拓研究部門 SACLA利用技術開拓グループ
グループディレクター 岩田 想(イワタ・ソウ)
(京都大学大学院 医学研究科 教授)
利用技術開拓研究部門 SACLA利用技術開拓グループ 分子動画研究チーム
チームリーダー 南後 恵理子(ナンゴ・エリコ)
(東北大学 多元物質科学研究所 教授)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
京都大学 総務部広報課国際広報室
Tel: 075-753-5729
Email: comms [at] mail2.adm.kyoto-u.ac.jp
東北大学 多元物質科学研究所 広報情報室
Tel: 022-217-5198
Email: press.tagen [at] grp.tohoku.ac.jp
(SPring-8/SACLAに関すること)
高輝度光科学研究センター 利用推進部 普及情報課
Tel: 0791-58-2785 / Fax: 0791-58-2786
Email: kouhou [at] spring8.or.jp
※上記の[at]は@に置き換えてください。
