2023年7月11日
理化学研究所
トロント大学
脂肪酸合成を阻害する新たな抗真菌化合物の発見
-世界的脅威である真菌感染症の新しい治療薬として期待-
理化学研究所(理研)環境資源科学研究センタ ー分子リガンド標的研究チームのチャールズ・ブーン チームリーダー、八代田 陽子 副チームリーダー、シーナ・リー 研究員(研究当時)、トロント大学のリア・コーウェン 教授、カリ・アイアー 大学院生(研究当時)らの国際共同研究グループは、脂肪酸合成酵素[1]に結合してその機能を阻害することで、真菌[2]に対して殺菌効果を示す新たな化合物を発見しました。
本研究成果は、世界的な脅威となっているカンジダ症やクリプトコックス症などの真菌感染症[3]に対抗する有望な薬剤開発に貢献すると期待できます。
真菌感染症は、とりわけ既存の薬剤に対する多剤耐性菌の増加により、世界の公衆衛生にとって深刻な問題となっているため、新たな抗真菌薬の開発が強く望まれています。
今回、国際共同研究グループは理研天然化合物バンク(NPDepo)[4]の化合物ライブラリーを用いて、世界保健機関(WHO)の真菌優先病原体リスト[5]に含まれる4種の病原性真菌に対して抗真菌活性を持つ化合物を探索した結果、化合物NPD6433を見つけました。遺伝学的および生化学的解析から、NPD6433が脂肪酸合成酵素Fas1に結合して酵素活性を阻害することが分かりました。さらに、NPD6433はカンジダ属真菌であるカンジダ・アルビカンス(Candida albicans)を死滅させること、カンジダ・アルビカンスに感染した線虫[6]はNPD6433で処理すると、処理していない個体と比較して生存期間が長くなることを明らかにしました。
本研究は、科学雑誌『Cell Chemical Biology』オンライン版(6月26日付)に掲載されました。
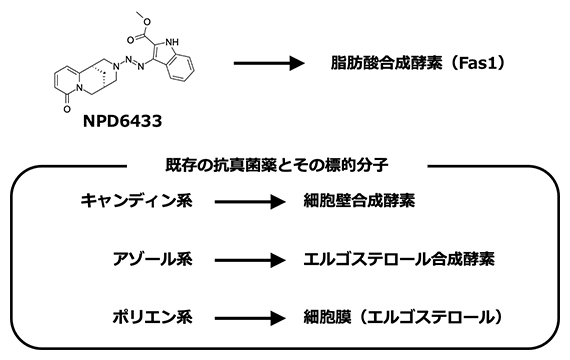
新たな抗真菌化合物NPD6433と既存の抗真菌薬の標的分子
背景
毎年世界中で10億人以上が真菌感染症に感染し、その死者数は年間160万人を超えています注1)。治療薬として使える抗真菌薬には限りがあり、さらに近年、これらの薬剤に対する耐性菌の出現率の増加が懸念されています。このように、真菌感染症は地球規模で人類の健康を脅かすことから、新たな抗真菌薬の開発が強く望まれています。
現在使われている真菌感染症の主な治療薬には、キャンディン系、アゾール系、ポリエン系の薬剤があります。これらの薬剤は、真菌に特異的な細胞壁の合成酵素、細胞膜成分のエルゴステロール[7]の合成酵素およびエルゴステロールそのものを標的として作用し、抗真菌性を発揮します。
本研究では、NPDepoの化合物ライブラリーの中から、病原性真菌の増殖を阻害する新しい化合物の探索を試みました。
- 注1)Rokas, A., Evolution of the human pathogenic lifestyle in fungi. Nature Microbiology 7, 607-619 (2022)
研究手法と成果
国際共同研究グループはまず、約2万化合物に上るNPDepoの化合物ライブラリーの中からカンジダ属真菌であるカンジダ・アルビカンス(Candida albicans)を含む4種の病原性真菌の増殖を阻害する化合物を探索しました。その結果、これまで抗真菌活性の報告されていない3化合物を選抜し、そのうち、コウジカビ近縁の真菌アスペルギルス・フミガーツス(Aspergillus fumigatus)に対する増殖阻害活性も示した化合物NPD6433に着目しました。
NPD6433の作用メカニズムを解明するために、真菌に属する実験室酵母サッカロミセス・セレビシエ(Saccharomyces cerevisiae)株を用いた、「化学遺伝学プロファイリング[8]」注2、3)という化合物の標的分子を特定する方法を導入しました。化学遺伝学プロファイリングでは、薬剤の標的分子をコードする遺伝子を破壊した変異株がその薬剤に高い感受性を示すことを利用します。サッカロミセス・セレビシエの遺伝子破壊株ライブラリー[9]の中からNPD6433に高い感受性を示す株を探索したところ、脂肪酸合成酵素Fas1をコードするFAS1遺伝子の二倍体ヘテロ型遺伝子破壊株[10]がヒットしました(図1a)。これにより、NPD6433の標的分子は脂肪酸合成酵素Fas1であると予測され、培地に主要な脂肪酸を加えるとNPD6433感受性が低下したことも、この予測を支持するものでした(図1b)。
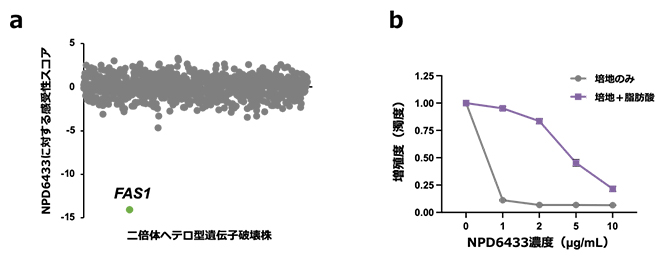
図1 化学遺伝学プロファイリングによるNPD6433の標的予測
- (a)約1,000個の二倍体ヘテロ型遺伝子破壊株のNPD6433感受性を調べた。縦軸の感受性スコアのマイナスの絶対値が大きいほど高い感受性を示している。FAS1遺伝子の二倍体ヘテロ型遺伝子破壊株(緑)がNPD6433に高い感受性を示した。
- (b)サッカロミセス・セレビシエのNPD6433感受性(増殖度)。主要な脂肪酸(ステアリン酸、パルミチン酸、ミリスチン酸)を培地に添加すると(紫)、NPD6433感受性が低下した。
一方、生化学的解析から、NPD6433は溶液中では二つの構造部分に分解していることが示され、そのうちジアゾニウム化合物[11]にFas1タンパク質の一部が共有結合していることが明らかになりました(図2)。以上のことから、NPD6433は真菌が持つ脂肪酸合成酵素Fas1に結合し、生育に必要なFas1の必須脂肪酸合成能を阻害することで、真菌の増殖阻害を引き起こしていることが分かりました。
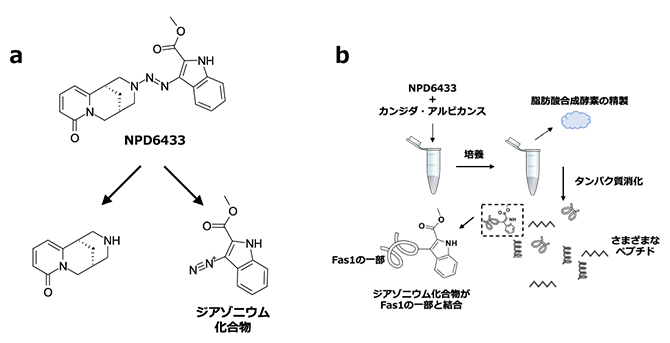
図2 NPD6433から生じるジアゾニウム化合物とFas1タンパク質との結合
- (a)NPD6433は溶液中でトリアゼン(R1R2N-N=N-R3)構造の部分で切断が起こり、ジアゾニウム化合物を含む二つの化合物に分解する。
- (b)カンジダ・アルビカンスをNPD6433で処理したのち、脂肪酸合成酵素を精製し、タンパク質消化を行った。質量分析により、NPD6433のジアゾニウム化合物とFas1タンパク質の一部が共有結合している物質が検出された。
次に、NPD6433の抗真菌効果を、既存のアゾール系抗真菌薬であるフルコナゾールと比較しました。フルコナゾールは真菌の細胞膜成分であるエルゴステロールの合成を阻害します。カンジダ・アルビカンスを、NPD6433およびフルコナゾールでそれぞれ24時間処理した後に寒天培地で生育させたところ、フルコナゾール処理株は全て生えてきましたが、一定以上の濃度のNPD6433で処理した株は生えてきませんでした(図3a)。つまり、NPD6433は真菌を死滅させる効果(殺菌作用)を持つことが分かりました。
さらに、線虫にカンジダ・アルビカンスを感染させ、NPD6433の有無での生存率の違いを観察しました。NPD6433を投与した感染個体は、投与しなかった感染個体と比較して有意な生存期間延長が観察されました(図3b)。
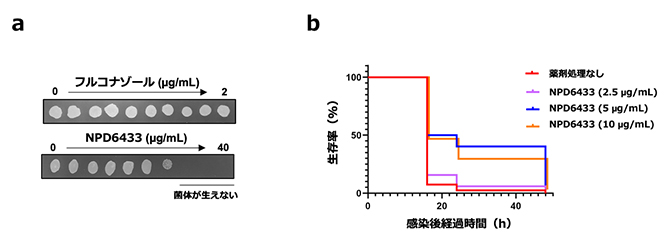
図3 NPD6433の抗真菌効果
- (a)カンジダ・アルビカンスを、表示された2倍段階希釈濃度のフルコナゾールおよびNPD6433で24時間処理した後、薬剤の含まれていない寒天培地にスポットして培養した。ある濃度以上のNPD6433で処理した細胞は24時間以内に死滅したことが分かった(下)。
- (b)線虫をカンジダ・アルビカンスに感染させると24時間で死滅したが(赤線)、5µg/mL以上のNPD6433処理群では生存期間が有意に延長した(青線、オレンジ線)。
- 注2)2017年7月25日プレスリリース「化合物の標的機能を決定するツールを開発」
- 注3)Persaud, R. et al., Clionamines stimulate autophagy, inhibit Mycobacterium tuberculosis survival in macrophages, and target Pik1. Cell Chemical Biology 29, 870-882 (2022)
今後の期待
本研究では、幅広い種類の病原性真菌に対して抗真菌性を示すNPD6433を見つけ出し、それが真菌の脂肪酸合成酵素Fas1に結合して阻害し、その結果、真菌を死滅させるという作用メカニズムを明らかにしました。ヒトや細菌も脂肪酸合成酵素を持っていますが、NPD6433が結合する部分の構造および特性が異なるため、NPD6433は真菌の脂肪酸合成酵素に特異的に作用します。よって、NPD6433が新たな抗真菌薬あるいはそのリード化合物[12]となる可能性があります。
また、本研究は、真菌の持つ脂肪酸合成酵素が真菌感染症の新たな治療薬を開発する上で重要な標的分子であることを示しました。今後、真菌脂肪酸合成酵素に特異的な阻害剤を開発すれば、既存の抗真菌薬に対する耐性菌が出現しても対抗できるような、真菌感染症に対する堅牢な治療法につながると期待できます。
本研究成果は、国際連合が2016年に定めた17項目の「持続可能な開発目標(SDGs)[13]」のうち、「3.すべての人に健康と福祉を」に貢献するものです。
補足説明
- 1.脂肪酸合成酵素
炭素数2のアセチルCoAと炭素数3のマロニルCoAから飽和脂肪酸を合成する酵素。真菌の脂肪酸合成酵素は、Fas1(β-サブユニット)とFas2(α-サブユニット)から構成される。真菌の脂肪酸合成酵素により、長鎖脂肪酸(炭素数16のパルミチン酸、炭素数18のステアリン酸、炭素数14のミリスチン酸など)が作られる。 - 2.真菌
酵母、糸状菌(カビ)、キノコを含む生物群。本研究におけるカンジダ・アルビカンス、サッカロミセス・セレビシエは酵母、アスペルギルス・フミガーツスは糸状菌(カビ)である。 - 3.真菌感染症
病原性真菌(酵母、カビ)がもたらすカンジダ症、クリプトコックス症、アスペルギルス症などがある。免疫力が低下すると、重篤な症状を引き起こすことがある。 - 4.理研天然化合物バンク(NPDepo)
微生物・植物由来の天然化合物および合成化合物を収集し、化合物ライブラリーとして配布している。 - 5.真菌優先病原体リスト
世界保健機関(WHO)が2022年に発表した19種の病原性真菌のリスト。真菌感染症に対する世界的な対応を強化するための研究や政策の推進を目的として作られた。本研究では、まず、このリストに含まれる4種の病原性真菌:カンジダ・アルビカンス、カンジダ・グラブラータ(Candida glabrata)、カンジダ・アウリス(Candida auris)、クリプトコックス・ネオフォルマンス(Cryptococcus neoformans)に作用する化合物を探索した。アスペルギルス・フミガーツスもこのリストに含まれる。 - 6.線虫
線虫の一種カエノラブディティス・エレガンス(Caenorhabditis elegans)は生命現象の研究に用いられる実験生物であり、カンジダ症の無脊椎動物モデルとしても使われている。 - 7.エルゴステロール
真菌におけるステロール脂質の主成分であり、真菌の細胞膜に多く含まれる。ヒトのステロール脂質であるコレステロールとは構造が異なることから、真菌特異的なエルゴステロールの合成やエルゴステロールそのものを標的とする、アゾール系やポリエン系の薬剤は抗真菌薬として有効である。 - 8.化学遺伝学プロファイリング
遺伝子破壊株など遺伝子発現量を変化させた変異株の薬剤感受性を指標にして、薬剤の作用メカニズムを解明する方法。ここでは、遺伝子破壊株ライブラリーに含まれる各遺伝子破壊株の薬剤感受性を網羅的に解析した結果から特徴を割り出す手法を指す。 - 9.サッカロミセス・セレビシエの遺伝子破壊株ライブラリー
実験室酵母サッカロミセス・セレビシエは約6,000個の遺伝子を持っており、それらの遺伝子破壊株が作られて、さまざまな網羅的解析に使われている。 - 10.二倍体ヘテロ型遺伝子破壊株
遺伝子を2コピー持つ二倍体の一方の遺伝子コピーが欠損している遺伝子破壊株のこと。この株では、その遺伝子情報をもとに作られるタンパク質の量が減少している。 - 11.ジアゾニウム化合物
分子内に置換基 -N+≡N を含む有機窒素化合物。 - 12.リード化合物
新たな医薬品を開発する際の出発点となる化合物。この化合物から化学構造を改変することにより、薬剤としての有効性を改良していく。 - 13.持続可能な開発目標(SDGs)
持続可能な開発目標(SDGs)とは、2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標である。持続可能な世界を実現するための17のゴールから構成され、地球上の誰ひとりとして取り残さないことを誓っている。SDGsは発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる。(外務省のホームページから一部改変して転載)
国際共同研究グループ
理化学研究所 環境資源科学研究センター
分子リガンド標的研究チーム
チームリーダー チャールズ・ブーン(Charles Boone)
(トロント大学教授)
副チームリーダー 八代田 陽子(ヤシロダ・ヨウコ)
研究員(研究当時)シーナ・リー(Sheena Li)
テクニカルスタッフⅠ 吉村 麻美(ヨシムラ・マミ)
テクニカルスタッフⅡ(研究当時)木村 寛美(キムラ・ヒロミ)
(現 脳神経科学研究センター タンパク質構造疾患研究チーム)
ケミカルゲノミクス研究グループ
グループディレクター 吉田 稔(ヨシダ・ミノル)
化合物リソース開発研究ユニット
ユニットリーダー 長田 裕之(オサダ・ヒロユキ)
研究パートタイマーⅠ 平野 弘之(ヒラノ・ヒロユキ)
トロント大学(カナダ)
教授 リア・コーウェン(Leah Cowen)
大学院生(研究当時)カリ・アイアー(Kali Iyer)
大学院生(研究当時)ニコール・レヴィ(Nicole Revie)
シニアリサーチアソシエイト ニコール・ロビンス(Nicole Robbins)
シニアリサーチアソシエイト ルーク・ホワイトセル(Luke Whitesell)
協力研究機関
ウィスコンシン大学(米国)
ゲルフ大学(カナダ)
トロント州立大学(カナダ)
ミネソタ大学(米国)
ルーネンフェルト・タネンバウム研究所(カナダ)
オンタリオがん研究所(カナダ)
プリンセス・マーガレットがんセンター(カナダ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業新学術領域研究「A chemical genomics approach for understanding chemical communication(17H06411、研究代表者:Charles Boone、研究分担者:八代田陽子)」「ユビキチン機能制御のためのケミカルバイオロジー(18H05503、研究代表者:吉田稔)」、同基盤研究S「革新的化学遺伝学による内在性代謝物の新機能の解明と応用(19H05640、研究代表者:吉田稔)」の助成を受けて行われました。
原論文情報
- Kali R. Iyer, Sheena C. Li, Nicole M. Revie, Jennifer W. Lou, Dustin Duncan, Sara Fallah, Hiram Sanchez, Iwona Skulska, Mojca Mattiazzi Ušaj, Hamid Safizadeh, Brett Larsen, Cassandra Wong, Ahmed Aman, Taira Kiyota, Mami Yoshimura, Hiromi Kimura, Hiroyuki Hirano, Minoru Yoshida, Hiroyuki Osada, Anne-Claude Gingras, David R. Andes, Rebecca S. Shapiro, Nicole Robbins, Mohammad T. Mazhab-Jafari, Luke Whitesell, Yoko Yashiroda, Charles Boone, Leah Cowen, "Identification of triazenyl indoles as inhibitors of fungal fatty acid biosynthesis with broad-spectrum activity", Cell Chemical Biology, 10.1016/j.chembiol.2023.06.005
発表者
理化学研究所
環境資源科学研究センター 分子リガンド標的研究チーム
チームリーダー チャールズ・ブーン(Charles Boone)
副チームリーダー 八代田 陽子(ヤシロダ ヨウコ)
研究員(研究当時)シーナ・リー(Sheena Li)
トロント大学(カナダ)
教授 リア・コーウェン(Leah Cowen)
大学院生(研究当時)カリ・アイアー(Kali Iyer)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
