理化学研究所(理研)開拓研究本部 袖岡有機合成化学研究室の闐闐 孝介 専任研究員(環境資源科学研究センター触媒・融合研究グループ専任研究員)、袖岡 幹子 主任研究員(環境資源科学研究センター 触媒・融合研究グループグループディレクター)らの研究チームは、有機化合物の不斉反応[1]に使われる触媒として開発されたパラジウム(Pd)錯体をケミカルバイオロジー[2]研究へ転用し、ペプチド混合物からβ-ケトアミドで修飾されたペプチドを捕捉するアフィニティー精製法[3]を開発しました。 本研究成果は、生物活性化合物の作用機序の解析や化学修飾されたタンパク質の解析に貢献すると期待できます。
研究チームはこれまでに、パラジウム錯体を触媒としたさまざまな不斉反応を開発してきました。その過程で、パラジウム錯体が反応基質のβ-ケトアミド(R-CO-CH2-CO-NH-R’)と安定な錯体を形成することを見いだしていました。 そこで本研究では、コンパクトな官能基であるβ-ケトアミドをタグとしてペプチドに導入した修飾ペプチドを、ペプチド混合物の中から固相に担持したパラジウム錯体を用いて捕捉する手法を開発しました。本手法を用いることで、酵素阻害剤がその標的タンパク質に結合する部位を同定することに成功しました。
本研究は、科学雑誌『Chemical Science』オンライン版(7月14日付)に掲載されました。
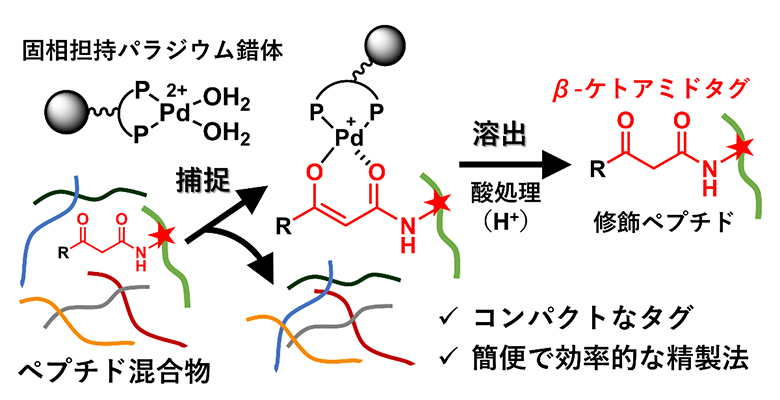
固相担持パラジウム錯体を用いたβ-ケトアミド修飾ペプチドの精製
背景
生物活性化合物が標的タンパク質のどの部位に結合して作用するのかを明らかにすることは、より高い活性の化合物を設計するのに重要であり、医薬品の開発に大きく貢献します。そのためには、生物活性化合物と標的タンパク質から共結晶[4]を調製して、そのX線結晶構造解析[5]により構造を明らかにすることが最も一般的ですが、標的が膜タンパク質[6]などの場合は共結晶を得ることが困難です。一方で、生物活性化合物と標的タンパク質との間に共有結合を形成させるアフィニティーラベル化法を用いて、標的タンパク質を酵素消化した後に質量分析法[7]により、生物活性化合物で修飾されたペプチドを同定し、結合部位を同定する方法はさまざまなタンパク質に適用可能です。しかし、この手法では修飾されたペプチドのみを得るための精製が必須であることから、より効率的な精製手法の開発が求められていました。
研究チームはこれまでに、パラジウム(Pd)錯体を触媒としたさまざまな不斉反応を開発してきました。パラジウム触媒に1,3-ジカルボニル化合物を基質として反応させると、パラジウムエノラート[8]という化学種が形成され、これを反応中間体としてさまざまな不斉反応が進行します(図1A)。特にβ-ケトアミド(R-CO-CH2-CO-NH-R’)を基質とした反応では、そのパラジウムエノラートの単離に成功し(図1B)、これが反応することで生成物が得られることを明らかにしました。さらに、パラジウムエノラートは反応中間体であるにもかかわらず、水や酸素に対して安定であるという特性を持つことも見いだしました。
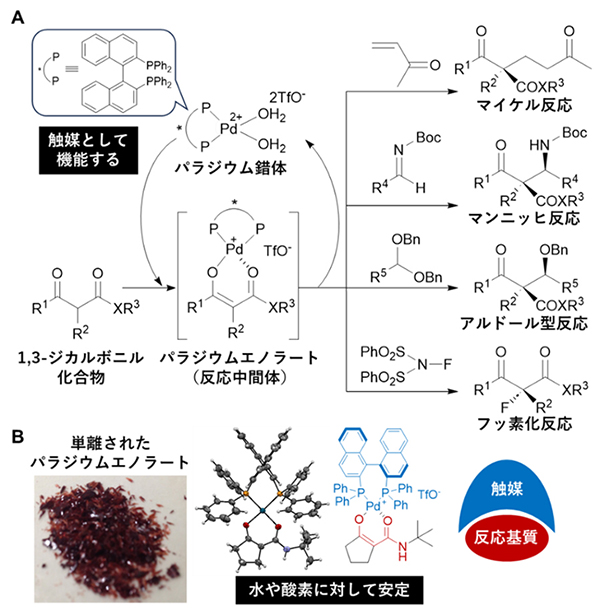
図1 パラジウム錯体を触媒とした不斉反応とパラジウムエノラート
- A:研究チームにより開発されたパラジウム錯体と、それにより触媒されるさまざまな不斉反応。
- B:単離されたβ-ケトアミド化合物から生成したパラジウムエノラート。その構造はX線結晶構造解析により確認された。このパラジウムエノラートは水や酸素に対して安定である
そこで本研究では、コンパクトな官能基であるβ-ケトアミドをタグとして生物活性化合物に導入することで、β-ケトアミドで修飾されたペプチドをパラジウムエノラートとして捕捉し、その後酸処理で溶出させるという新しいアフィニティー精製法の開発を計画しました。
研究手法と成果
研究チームはまず、ペプチドの固相合成に使われる樹脂にパラジウム錯体を担持したものを合成し、これが水溶液中でβ-ケトアミドと反応してパラジウムエノラートが生成されることを確認しました(図2)。
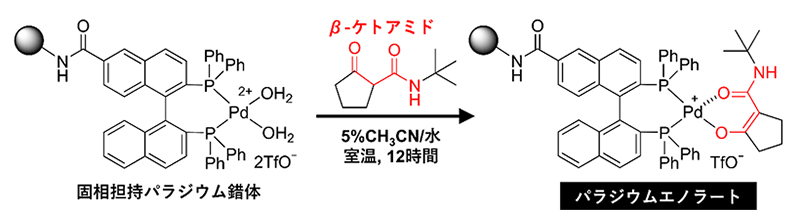
図2 固相担持パラジウム錯体とβ-ケトアミドからのパラジウムエノラートの生成
固相上に担持されたパラジウム錯体がβ-ケトアミド化合物と反応して、パラジウムエノラートが生成されることが確認された。
次に、β-ケトアミドをタグとして結合させたペプチドをモデルペプチド(β-ケトアミド修飾ペプチド)とし、このモデルペプチドのみが得られ精製できる条件を種々検討しました(図3A)。その結果、生体内タンパク質の標準試料であるウシ血清アルブミン(BSA)を酵素消化して得られるペプチド混合物から、固相担持パラジウム錯体を用いて、パラジウムエノラートとして捕捉し、その後酸処理で溶出させることで、モデルペプチドを精製することに成功しました(図3B)。
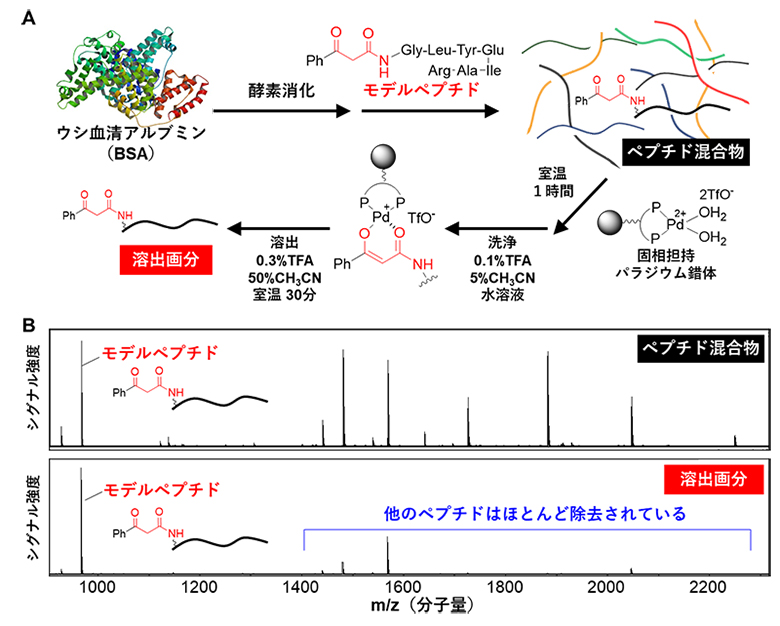
図3 ウシ血清アルブミン(BSA)酵素消化物中からのモデルペプチドの精製
- A.BSAの酵素消化物にβ-ケトアミドで修飾したモデルペプチドを添加し、ペプチド混合物とする。このペプチド混合物から、固相担持パラジウム錯体を用いてモデルペプチドをパラジウムエノラートとして捕捉し、その後酸処理で溶出させて溶出画分を得る。
- B.元のペプチド混合物および溶出画分に含まれるペプチドを質量分析法により解析した結果。溶出画分では、モデルペプチド以外のペプチドのピーク強度は大きく減弱したことから、モデルペプチドが効率的に精製されたことが確認された。
最後に、本手法を用いて実際に生物活性化合物の結合部位のアミノ酸残基を同定することを試みました。タンパク質分解酵素の一種であるカテプシンBと反応して共有結合を形成する阻害剤Z-FG-AOMKに着目し、この分子の一部をβ-ケトアミドで置き換えたBza-FG-AOMKを設計しました。まず、このβ-ケトアミドタグを導入した新たな阻害剤が、元の阻害剤の活性を損なうことなく、より優れた酵素阻害活性(IC50[9])を示すことを確認しました(図4A)。そこでカテプシンBをBza-FG-AOMKで処理し、共有結合を形成させた後で酵素消化し、固相担持パラジウム錯体によりBza-FG-AOMKで修飾されたペプチドを精製できるか調べました(図4B)。その結果、Bza-FG-AOMK修飾ペプチドが精製され、続く質量分析法によりBza-FG-AOMKの結合部位のアミノ酸残基の同定に成功しました(図4C)。
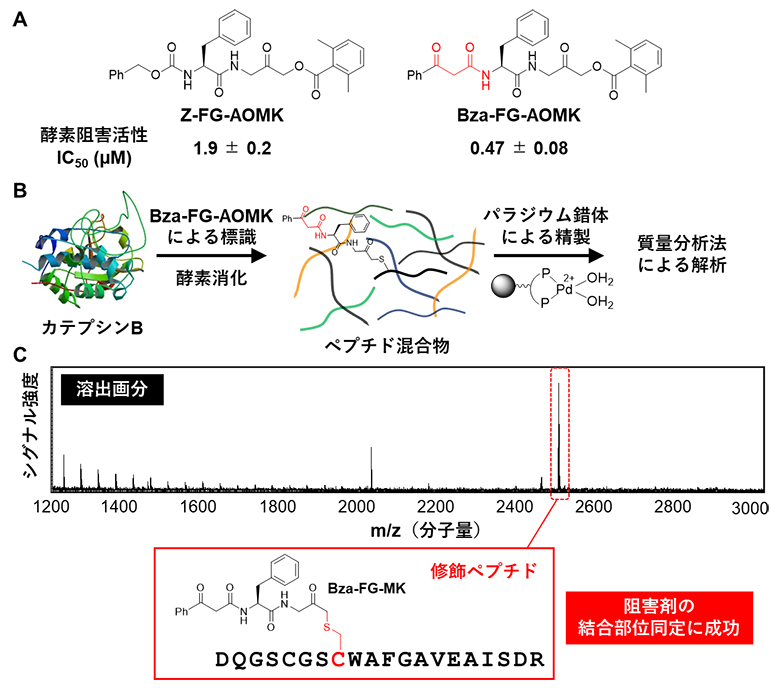
図4 本精製手法のカテプシンB阻害剤の結合部位同定への応用
- A.タンパク質分解酵素カテプシンBの阻害剤であるZ-FG-AOMKに、β-ケトアミド(赤字部分)をタグとして導入した新たな阻害剤Bza-FG-AOMKを開発した。Bza-FG-AOMKのカテプシンBに対する酵素阻害活性は元のZ-FG-AOMKよりも優れていたことから、コンパクトなβ-ケトアミドタグが活性を損なわず導入可能であることが分かった。
- B.カテプシンBから修飾ペプチドを調製する流れ。カテプシンBをBza-FG-AOMKで処理し、共有結合を形成させた後で酵素消化する。すると、Bza-FG-AOMKで修飾されたペプチドと修飾されていないペプチド混合物が得られる。その後、固相担持パラジウム錯体を用いて反応させ、質量分析法によりBza-FG-AOMKの結合部位を同定する。
- C.固相担持パラジウム錯体を用いて精製した後の溶出画分の質量分析法による解析結果。赤破線枠で囲んだピークからBza-FG-AOMKで修飾されたペプチドが検出され、Bza-FG-AOMKの結合部位(C:システイン)の同定に成功した。
今後の期待
本研究で開発されたβ-ケトアミドタグは、非常にコンパクトであることから導入される化合物の活性が損なわれにくく、さまざまな生物活性化合物の結合部位の同定に応用できると考えられます。その結果、生物活性化合物の作用機序解明や、より活性の高い化合物の開発などにつながり、将来的には創薬へ貢献するものと期待できます。
補足説明
- 1.不斉反応
光学活性な化合物の片方の鏡像異性体だけを選択的に合成する反応。 - 2.ケミカルバイオロジー
化学的な手法で生命現象を解明する研究分野。化合物を用いて特定の生体分子を制御したり、生体分子の変化を検出したりすることで生命現象の解明につなげる。 - 3.アフィニティー精製法
特定の分子間の特異的な結合親和性を利用して、タンパク質やペプチドなどの生体分子を精製する手法。 - 4.共結晶
化合物とタンパク質、あるいはタンパク質同士などの間で、結合を保った状態で結晶化したもの。 - 5.X線結晶構造解析
対象とする分子などの結晶を作製し、その結晶にX線を照射して得られる回折データを解析することにより、分子内部の原子の立体的な配置を調べる方法。この方法によって、タンパク質などの複雑な分子の立体構造を詳細に知ることができる。 - 6.膜タンパク質
細胞の生体膜中に埋まった状態で機能するタンパク質。通常のタンパク質に比べて、その調製や分析などは困難であることが多い。 - 7.質量分析法
原子や分子をイオン化し、そのイオンを検出することにより、その質量を計測する分析法。質量分析装置内で、イオンに高エネルギーを付加し、断片化させることで特異的なマススペクトルを取得し、分子構造の推定も可能である。 - 8.パラジウムエノラート
エノラートは、カルボニル化合物のα位炭素上の水素が塩基で脱プロトン化されて生じる化合物である。このエノラートのうち、パラジウムをカウンターカチオン(陽イオン、下図のM+)とするものをパラジウムエノラートという。パラジウムエノラートはO-Pd結合の共有結合性が強いため水中でも安定に存在するが、通常のアルカリ金属(M = Li、Na、K)などの場合は、水によってプロトン化を受けてカルボニル化合物に戻りやすい。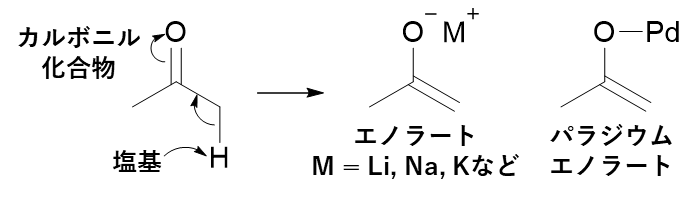
- 9.IC50
50%阻害濃度と呼ばれる。化合物の有効度を示す値であり、どの濃度で標的分子の活性を半分(50%)阻害できるかを示す。値が小さいほど阻害活性が大きいことを示す。
研究チーム
理化学研究所 開拓研究本部 袖岡有機合成化学研究室
主任研究員 袖岡 幹子(ソデオカ・ミキコ)
(環境資源科学研究センター 触媒・融合研究グループ グループディレクター)
専任研究員 闐闐 孝介(ドド・コウスケ)
(環境資源科学研究センター 触媒・融合研究グループ 専任研究員)
特別研究員(研究当時)早水 健二 (ハヤミズ・ケンジ)
特別研究員(研究当時)小池 晃太 (コイケ・コウタ)
(現 環境資源科学研究センター 触媒・融合研究グループ 特別研究員)
技師(研究当時)淺沼 三和子(アサヌマ・ミワコ)
(環境資源科学研究センター 触媒・融合研究グループ 技師(研究当時))
客員研究員(研究当時)江上 寛通 (エガミ・ヒロミチ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業挑戦的研究(開拓)「遷移金属化学のケミカルバイオロジーへの展開(研究代表者:袖岡幹子)」、同挑戦的萌芽研究「金属エノラートを鍵とする新規アフィニティー精製法の開発(研究代表者:闐闐孝介)」、「反応性アフィニティータグを用いた蛋白質標識・精製・検出法の開発(研究代表者:闐闐孝介)」、日本医療研究開発機構(AMED)AMED-CREST「生理活性代謝物と標的タンパク質同定のための基盤技術の創出(研究代表者:袖岡幹子)」、有機合成化学協会エーザイ研究企画賞(研究代表者:闐闐孝介)、金沢大学がん進展制御研究所共同研究(研究代表者:闐闐孝介)による助成を受けて行われました。
原論文情報
- Kenji Hayamizu, Kota Koike, Kosuke Dodo, Miwako Asanuma, Hiromichi Egami, and Mikiko Sodeoka, "Simple Purification of Small-Molecule-Labelled Peptides via Palladium Enolate Formation from β-Ketoamide Tags", Chemical Science, 10.1039/d2sc03112d
発表者
理化学研究所
開拓研究本部 袖岡有機合成化学研究室
専任研究員 闐闐 孝介(ドド・コウスケ)
(環境資源科学研究センター 触媒・融合研究グループ 専任研究員)
主任研究員 袖岡 幹子(ソデオカ・ミキコ)
(環境資源科学研究センター 触媒・融合研究グループ グループディレクター)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
