2023年10月4日
理化学研究所
国立がん研究センター
島根大学医学部産科婦人科学講座
卵巣がんの発がんメカニズムを解明
-がんエピゲノムを標的としたマルチオミックス解析による成果-
理化学研究所(理研)革新知能統合研究センター 目的指向基盤技術研究グループ がん探索医療研究チームの町野 英徳 研究員、浜本 隆二 チームリーダー、小松 正明 副チームリーダー、浅田 健 上級研究員、国立がん研究センター研究所 医療AI研究開発分野の金子 修三 ユニット長、同中央病院 婦人腫瘍科の加藤 友康 科長(研究当時)、病理診断科の吉田 裕 医員、島根大学 医学部 産科婦人科学講座の中山 健太郎 准教授(研究当時)、京 哲 教授らの国際共同研究グループは、卵巣がんの発がんモデル細胞を用いてマルチオミックス解析[1]を行い、卵巣がんの新しい発がんメカニズムを解明しました。
本研究成果は、卵巣がんのうち最も死亡者数の多い「高異型度漿液性卵巣がん[2]」の早期発見と新しい治療法の開発に貢献すると期待できます。
今回、国際共同研究グループは、高異型度漿液性卵巣がんの発生母地である卵管分泌上皮細胞[2]に遺伝子導入を行い、卵巣がんの予後不良なサブタイプの段階的な発がんモデル細胞を樹立し、がんのエピゲノム[3]を標的としたマルチオミックス解析を行いました。その結果、卵巣がんの発がん早期の段階で、エピゲノム異常を介してAP-1ファミリー[4]の転写因子[5]が活性化する一方、GATAファミリー[6]の転写因子が不活性化することが分かり、これらの異常が複合的に作用して発がんに重要な上皮間葉転換[7]が促進されることが明らかになりました。また、MEK阻害剤[8]による治療がエピゲノム異常を修復する効果を持つことが分かりました。この発見は、予後不良な卵巣がんの新しい治療法の開発に寄与します。
本研究は、科学雑誌『Experimental & Molecular Medicine』オンライン版(10月2日付)に掲載されました。
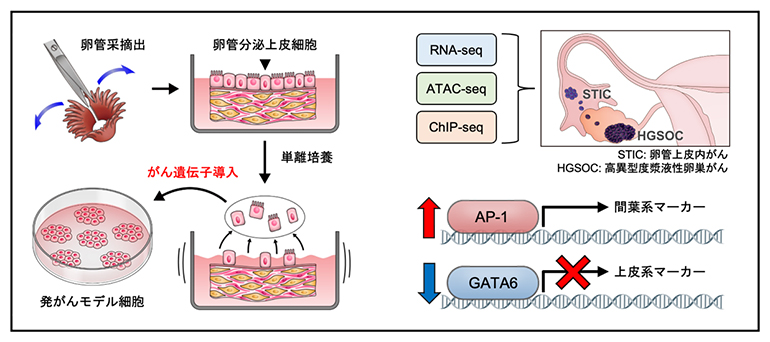
高異型度漿液性卵巣がんの発がんモデル細胞(左)を用いたマルチオミックス解析(右)
背景
高異型度漿液性卵巣がん(HGSOC)は世界的に最も頻度の高い婦人科系悪性腫瘍であり、卵巣がんによる死亡者数の70~80%を占めています注1)。高異型度漿液性卵巣がんのゲノム異常についてはこれまで頻繁に研究されてきており、相同組換え修復経路[9]の分子に機能異常が認められるサブタイプの卵巣がんには、新しい分子標的薬であるPARP阻害剤[10]が有効であることが示され、既に臨床応用が始まっています。一方で、相同組換え修復経路に異常が認められない卵巣がんには、有効な治療法が開発されておらず、いまだ予後不良であることから、個別化医療を推進する上での課題になっていました。
このような予後不良なサブタイプの卵巣がんでは、これまで網羅的ゲノム解析によっても有望な治療標的が発見されず、新しい治療法が開発されてこなかったという現状があります。そこで、国際共同研究グループはゲノム解析という従来の研究手法の枠組みを超えて、DNAやヒストン[3]の化学修飾によってゲノムの3次元構造や機能を調節するエピゲノムという仕組みの異常に注目し、ビッグデータ解析手法を活用して卵巣がんの新たな治療標的を探索してきました注2)。本研究では、予後不良な高異型度漿液性卵巣がんに特徴的な新たなエピゲノム異常を解明し、がんエピゲノムを治療標的とする新しい治療法を開発することを目的として研究を開始しました。
- 注1)Bowtell, D. D. et al. Rethinking ovarian cancer II: reducing mortality from high-grade serous ovarian cancer. Nat. Rev. Cancer 15, 668-679 (2015).
- 注2)2022年2月7日プレスリリース「卵巣がんの新しい治療標的を同定」
研究手法と成果
高異型度漿液性卵巣がんの多くは、卵管采(卵管先端の手のような部分)に存在する卵管分泌上皮細胞(HTFSEC)を由来として前がん病変(卵管上皮内がん)が発生し、その後に卵巣表面に播種することで卵巣がんに進展すると考えられています。国際共同研究グループは卵管分泌上皮細胞に段階的に遺伝子導入を行い、相同組換え修復経路の分子に異常を認めない、予後不良なサブタイプの高異型度漿液性卵巣がんの段階的な発がんモデル細胞(H、HT、HTK、HTKA、HTKM)を樹立し、網羅的なエピゲノム解析を含むマルチオミックス解析を実施しました(図1a)。
RNA-seq[11]解析の結果、がん遺伝子の導入に沿って段階的に発がんモデル細胞の形質が変化していることが確認されました。さらに、代表的なエピゲノム解析手法であり、ゲノムのオープンクロマチン領域[12]を評価できるATAC-seq[12]解析では、RNA-seqと比較して、腫瘍形成能を獲得した細胞(HTKA、HTKM)のプロファイルをより明瞭に抽出することができました(図1b)。これはエピゲノム解析が、正確な細胞情報を取得するために重要であることを示唆しています。
ATAC-seqデータを基に、転写因子のDNA結合モチーフ[13]の変動を網羅的に評価したところ、腫瘍形成能を獲得する過程でAP-1ファミリーの転写因子が活性化する一方、GATAファミリーの転写因子が不活性化することが分かりました(図1c、d)。
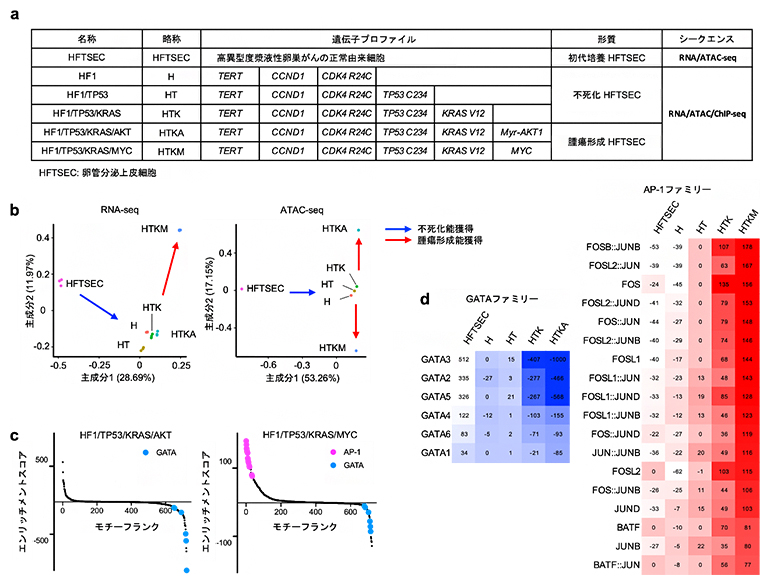
図1 高異型度漿液性卵巣がんの発がんモデル細胞のマルチオミックス解析
- a:高異型度漿液性卵巣がんの段階的発がんモデル細胞のプロファイル。正常由来細胞である卵管分泌上皮細胞(HFTSEC)に遺伝子導入を行い、不死化HFTSEC(H、HT、HTK)とした。不死化HFTSECにがん遺伝子導入を行い、腫瘍形成HFTSEC(HTKA、HTKM)を樹立した。それぞれのサンプルに実施した解析をシークエンスの項目に記載した。
- b:RNA-seq(左)とATAC-seq(右)のデータに対して、主成分分析を行った。遺伝子導入の段階に沿った変化を確認できる。RNA-seqでは有効に分離できなかった腫瘍形成HFTSECであるHTKAサンプルを、ATAC-seqでは明瞭に分離できている。
- c:ATAC-seqデータを用いて、網羅的な転写因子モチーフ解析を行った。腫瘍形成HFTSECのHF1/TP53/KRAS/AKT(HTKA)サンプルで、GATAファミリーの転写因子が不活性化している(左)。また、HF1/TP53/KRAS/MYC(HTKM)サンプルでは、AP-1ファミリーの転写因子が活性化している(右)。
- d:段階的な発がん過程におけるGATAファミリー(左)とAP-1ファミリー(右)の転写因子のエンリッチメントスコアをヒートマップで可視化した。段階的な発がん過程に沿ってGATAファミリーが不活性化し、AP-1ファミリーが活性化している。
この解析結果を検証するために、卵巣がん患者由来の検体を用いて、卵管組織(正常由来組織)と前がん病変(卵管上皮内がん)組織、浸潤がん(高異型度漿液性卵巣がん)組織の間で、タンパク質発現量を比較しました。その結果、正常由来組織と比較して、AP-1ファミリーの転写因子であるJUNの発現量が前がん病変と浸潤がんで上昇し、特に前がん病変では、活性化型のリン酸化JUN(p-JUN)の発現量が上昇していました(図2a)。これは、高異型度漿液性卵巣がんの発生早期の段階で、JUNの発現上昇と活性化が重要な意義を持つことを示唆しています。
また、遺伝子の転写を促進するエンハンサー[14]のマークとして重要なヒストンH3の27番目のリジン(H3K27)のアセチル化(H3K27ac)というヒストン修飾をChIP-seq[15]を用いて評価したところ、卵巣がん細胞株において確かにJUNの転写が活性化されていることが明らかになりました(図2b)。
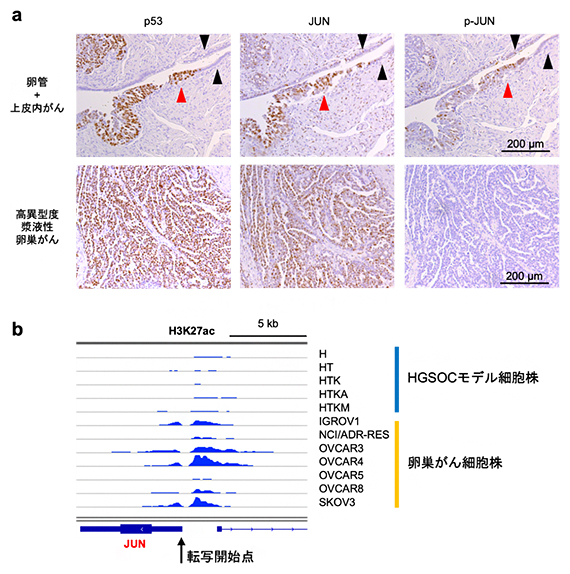
図2 AP-1ファミリーの転写因子JUNの発現解析
- a:免疫組織化学染色後の卵管組織(正常由来組織)および前がん病変(卵管上皮内がん)組織(上段)と浸潤がん(高異型度漿液性卵巣がん)組織(下段)の顕微鏡画像。p53は前がん病変と浸潤がんに対するポジティブコントロール(実験系において明らかに陽性を示すと予想される対照)で、発がん初期の段階から腫瘍抑制因子p53が不活性化された不活性化型p53(茶色)の過剰発現が認められる(上段左)。黒矢尻で示した正常由来組織と比較して、赤矢尻で示した前がん病変組織と、浸潤がん組織において、JUNの発現量(茶色)が上昇している(中央列)。特に、前がん病変では活性化型のリン酸化JUN(p-JUN)の発現量(茶色)が上昇している(上段右)。
- b:エンハンサーを示すH3K27acのヒストン修飾をChIP-seq解析で描出した。患者由来の卵巣がん細胞株では、JUNの転写開始点近傍でエンハンサー活性が上昇している。
一方で、GATAファミリーの転写因子であるGATA6の発現量は、正常由来組織と比較して前がん病変と浸潤がんで低下しており、GATA6によって転写されるDAB2というタンパク質も同様に、発現量が低下していました(図3a)。GATA6遺伝子とDAB2遺伝子では、H3K27acのヒストン修飾の低下によってタンパク質発現量が低下していることが分かりました(図3b)。DAB2遺伝子は卵巣がんのがん抑制遺伝子であり、がん促進的なRASシグナル[8]を抑制する因子として知られています。このため、GATA6-DAB2経路が不活性化することによってRASシグナルが活性化することが、卵巣がんの発がんに寄与していると考えられました。
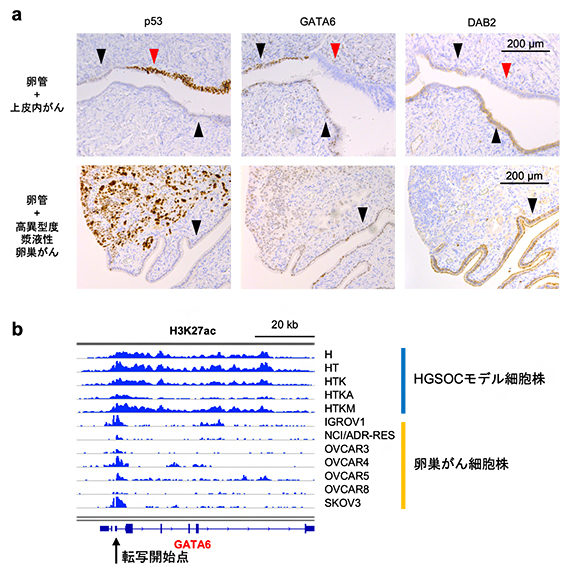
図3 GATAファミリーのGATA6とその転写産物DAB2の発現解析
- a:免疫組織化学染色後の卵管組織および前がん病変(卵管上皮内がん)組織(上段)、浸潤がん(高異型度漿液性卵巣がん)組織(下段)の顕微鏡写真。p53は前がん病変と浸潤がんに対するポジティブコントロール(実験系において明らかに陽性を示すと予想される対照)で、発がん初期の段階から腫瘍抑制因子p53が不活性化された不活性化型p53(茶色)の過剰発現が認められる(上段左)。黒矢尻で示した正常由来組織と比較して、赤矢尻で示した前がん病変組織と、浸潤がん組織において、GATA6(中央列)とDAB2(右列)のタンパク質発現量(茶色)が低下している。
- b:エンハンサーを示すH3K27acのヒストン修飾をChIP-seq解析で描出した。患者由来卵巣がん細胞株では、GATA6の転写開始点近傍でエンハンサー活性が低下している。
RASシグナルの活性化は、上皮細胞が形質転換して浸潤能・転移能を獲得する機構である上皮間葉転換に関わっており、重要な発がんメカニズムの一つです。今回の解析データも、卵巣がんの発がん早期の段階で上皮間葉転換が生じていることを強く示唆していました。
そこで、上皮間葉転換に重要なカドヘリン[16]遺伝子を多く含む16番染色体のカドヘリンクラスター領域のH3K27acを確認したところ、高異型度漿液性卵巣がんにおいて、コピー数減少[17]に加えて、広範囲にわたりH3K27acのヒストン修飾が低下していることが分かりました(図4a)。これらの解析結果は、高異型度漿液性卵巣がんの発がん早期に、エピゲノム異常を介したAP-1ファミリーとGATAファミリーの発現異常によって、上皮間葉転換が生じることを示唆しています。
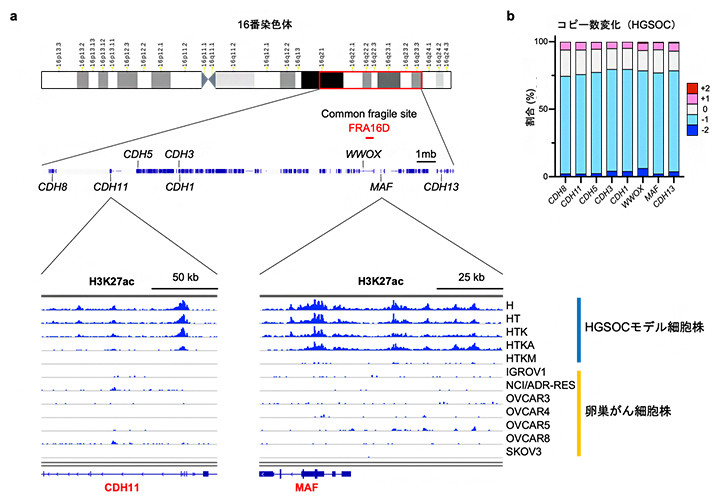
図4 16番染色体カドヘリンクラスター近傍のゲノム・エピゲノム解析
- a:16番染色体カドヘリンクラスター近傍のゲノムを可視化した。エンハンサーを示すH3K27acのヒストン修飾をChIP-seq解析で描出した。患者由来の卵巣がん細胞株では、カドヘリン遺伝子群(図ではCDH11遺伝子)や、JUN遺伝子に拮抗的に働くMAF遺伝子の近傍でエンハンサー活性が低下している。
- b:高異型度漿液性卵巣がん(HGSOC)検体において、16番染色体のカドヘリン遺伝子(CDH8、CDH11、CDH5、CDH3、CDH13)やMAF遺伝子は頻繁にコピー数減少を受ける傾向にある(水色と青の部分)。
このエピゲノム異常を回復する治療法を探索するために、RASシグナルの阻害剤であるMEK阻害剤(トラメチニブ、Trametinib)を投与した発がんモデル細胞を解析しました。すると期待した通り、腫瘍形成能を持つ発がんモデル細胞(HTKM)において、上皮間葉転換に関わるCDH1遺伝子の発現量が回復し、JUN遺伝子に拮抗的に作用するMAF遺伝子に加え、GATA6遺伝子とDAB2遺伝子の発現量が上昇しました(図5)。
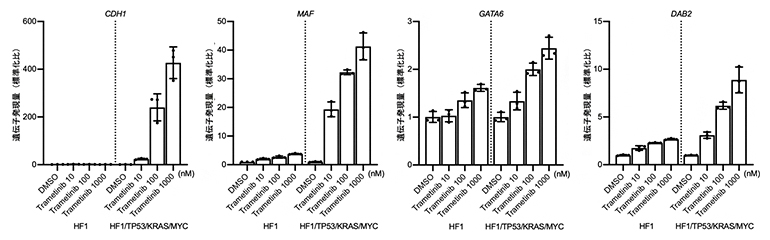
図5 MEK阻害剤を投与した発がんモデル細胞の遺伝子発現量解析
段階的発がんモデル細胞をMEK阻害剤で治療し、遺伝子発現解析を行った。不死化HFTSECであるHF1と比較して、腫瘍形成HFTSECであるHF1/TP53/KRAS/MYC(HTKM)では、発がん過程で遺伝子発現量が低下していたCDH1、MAF、GATA6、DAB2といった遺伝子の発現量が、MEK阻害剤の投与によって著しく回復している。
これらの結果は、MEK阻害剤を用いてRASシグナルを抑制することによって、高異型度漿液性卵巣がんのエピゲノム異常を修復することができることを示しており、がんエピゲノムを標的とした新しい治療法の開発に貢献する知見であると考えられます。
今後の期待
本研究では、マルチオミックス解析技術により、従来手法では同定することが困難であった卵巣がんのエピゲノム異常と、それに起因する転写因子のDNA結合異常を発見することができました。この成果は、がん研究において、実験室で実施する生化学的手法と、高度な計算機を活用した情報科学技術を融合することによる有機的なデータサイエンスが強力な効果を持つことを示しています。
高異型度漿液性卵巣がんは婦人科系悪性腫瘍の中で最も死亡者数の多いがん種であり、予後不良なサブタイプに対する有効な治療法の開発が強く求められています。本研究では、理研と国立がん研究センター、島根大学医学部産科婦人科が密接に連携を取り、予後不良な卵巣がんの発がんモデル細胞を樹立して、がんエピゲノムを標的としたマルチオミックス解析を行うことにより、高異型度漿液性卵巣がんのエピゲノム異常を介した新しい発がんメカニズムを解明しました。
今後、MEK阻害剤を使用した個別化医療や、エピゲノム異常を標的とした新しい治療薬の開発を通じて、予後不良な高異型度漿液性卵巣がんに対する有効な治療法の開発に結び付くことが期待できます。
補足説明
- 1.マルチオミックス解析
オミックスとは、生命のさまざまな層に存在する大量の生物学的情報の相互作用や機能を解析する学問領域である。マルチオミックス解析とは、さまざまなオミックスデータを用いて、複数のオミックスにまたがるように統合的に行われる解析のことを指す。 - 2.高異型度漿液性卵巣がん、卵管分泌上皮細胞
高異型度漿液性卵巣がんは、婦人科系悪性腫瘍のうち、世界的に最も頻度が高く、死亡者数が多い卵巣がん。その多くは、卵管分泌上皮細胞を由来として前がん病変(上皮内がん)が発生し、その後に卵巣表面に播種することで卵巣がんに進展する。卵管上皮には、主に、初期胚の輸送を促す繊毛細胞と、初期胚の発育に必要な物質を分泌する分泌細胞から構成されており、高異型度漿液性卵巣がんはこのうち卵管分泌上皮細胞を発生母地とすると考えられている。 - 3.エピゲノム、ヒストン
エピゲノムとは、DNA塩基配列の変化を伴わない、細胞分裂後も継承される遺伝子発現量あるいは細胞表現型の変化を研究する学問領域である。具体的には、DNAやヒストンの化学修飾による遺伝子発現量の制御機構のことを指す。4種類のヒストン(H2A、H2B、H3、H4)の各2個によって形成される8個のタンパク質複合体に、約146塩基対のDNAが巻き付くことによって、ヌクレオソームというDNAを安定的に維持する構造が形成される。 - 4.AP-1ファミリー
Activator protein-1ファミリーの略で、JUNやFOSなどの分子によって構成される転写因子の一群である。ファミリーの分子が二量体を形成したAP-1複合体は、細胞増殖、分化、アポトーシスなどさまざまな細胞応答に関わる。 - 5.転写因子
DNAに結合して遺伝子の転写を制御するタンパク質のこと。 - 6.GATAファミリー
細胞の発生や分化など、さまざまな細胞応答に関わる転写因子の一群である。GATAファミリーの機能異常は、さまざまな臓器の機能不全やがんの発生原因となることが知られている。 - 7.上皮間葉転換
上皮細胞がその細胞極性や周囲の細胞との細胞接着能を失う一方で、遊走能や浸潤能を獲得することで、間葉細胞のような形質に変化する過程のこと。本来は神経発達や創傷治癒を行うための生物学的な機能であるが、がんの浸潤・転移の過程においても上皮間葉転換が活性化することが明らかになっている。 - 8.MEK阻害剤、RASシグナル
RASシグナルとは、RAS/RAF/MEK/ERKから構成される古典的なシグナル伝達経路であり、主に増殖因子による刺激を核に伝え、細胞の増殖・分化・細胞死に関わる。発がんにおいて最も重要なシグナル伝達経路の一つであり、このシグナル伝達経路の分子に対して多数の分子標的薬が開発されている。MEK阻害剤とは、RASシグナルのうち、MEKの活性化を阻害する分子標的薬のこと。悪性黒色腫などで臨床応用されている。 - 9.相同組換え修復経路
DNAに二本鎖切断などの損傷が生じた場合に、姉妹染色分体の相同なDNA配列を利用して正確なDNA修復を行う経路のこと。 - 10.PARP阻害剤
PARPとは、DNAに生じた一本鎖切断端を認識して塩基除去修復によるDNA修復を行うタンパク質である。PARPを阻害することで、DNAの一本鎖切断は修復されず、DNA複製の過程で二本鎖切断に至る。相同組換え修復経路に機能異常があるがん細胞は、PARP阻害剤によって誘導されるDNAの二本鎖切断を修復できず、アポトーシスに至る。 - 11.RNA-seq
次世代シーケンサーを使用して網羅的に遺伝子発現量を定量化する、トランスクリプトーム解析を行うための実験手法である。 - 12.オープンクロマチン領域、ATAC-seq
ヒストンの周囲にDNAが巻き付いたヌクレオソームという単位が数珠状に連なっている構造をクロマチンと呼ぶ。DNAがヒストンからほどけてヌクレオソームの無い状態になる領域のことをオープンクロマチン領域といい、この領域は転写因子の結合などを介して遺伝子発現制御に密接に関わると考えられている。ATAC-seqは、網羅的にオープンクロマチン領域を抽出するための次世代シーケンサー技術である。ATAC-seqはassay for transposase-accessible chromatin using sequencingの略。 - 13.転写因子のDNA結合モチーフ
転写因子が特異的に結合するDNA塩基配列のこと。転写因子のDNA結合モチーフを用いて、転写因子のDNA結合能を評価する手法を転写因子モチーフ解析という。 - 14.エンハンサー
遺伝子の転写量を増加させる作用を持つDNA領域のこと。H3K27アセチル化(H3K27ac)というヒストン修飾がエンハンサーのマークであることが知られている。 - 15.ChIP-seq
クロマチン免疫沈降法と次世代シークエンサーを組み合わせた実験手法。ヒストンの化学修飾や転写因子のDNA結合部位などを網羅的に解析することができる。ChIP-seqはchromatin immunoprecipitation sequencingの略。 - 16.カドヘリン
カルシウムイオン依存的に細胞と細胞を接着させる作用を持つ主要な細胞接着分子である。カドヘリンファミリーの発現異常を介して、発がんに重要な上皮間葉転換が生じることが知られており、発がん初期にE-カドヘリン(CDH1)の発現抑制が起きることが特に有名である。 - 17.コピー数減少
コピー数変化は、体細胞に後天的に生じるDNAのコピー数の変化のことである。DNAのコピー数が減少することをコピー数減少といい、がん抑制遺伝子に1本のコピー数減少が生じている場合、その対立遺伝子にも発現抑制や機能異常が生じることによって遺伝子の機能が完全に不活性化し、発がんの原因になることが知られている。
国際共同研究グループ
理化学研究所 革新知能統合研究センター
目的指向基盤技術研究グループ がん探索医療研究チーム
研究員 町野 英徳(マチノ・ヒデノリ)
チームリーダー 浜本 隆二(ハマモト・リュウジ)
副チームリーダー 小松 正明(コマツ・マサアキ)
上級研究員 浅田 健(アサダ・ケン)
国立がん研究センター研究所 医療AI研究開発分野
研修生(研究当時)同前 愛(ドウゼン・アイ)
ユニット長 金子 修三(カネコ・シュウゾウ)
テクニカルスタッフ(研究当時)小中 真理子(コナカ・マリコ)
テクニカルスタッフ 井川 典子(イカワ・ノリコ)
研修生(研究当時)生水 貫人(ショウズ・カント)
国立がん研究センター中央病院
婦人腫瘍科
科長(研究当時)加藤 友康(カトウ・トモヤス)
病理診断科
医員 吉田 裕(ヨシダ・ヒロシ)
島根大学医学部 産科婦人科学講座
教授 京 哲(キョウ・サトル)
准教授(研究当時)中山 健太郎(ナカヤマ・ケンタロウ)
医員(研究当時)中村 康平(ナカムラ・コウヘイ)
米国国立がん研究所 がん研究センター
Physician-Scientist Early Investigator
ヴァシリキ・サローラ(Vassiliki Saloura)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業若手研究「段階的発がんモデルを用いた卵巣がんのマルチオミックス解析」(研究代表者:町野英徳)、科学技術振興機構(JST)戦略的創造研究推進事業(JST CREST)「人工知能を用いた統合的ながん医療システムの開発」(研究代表者:浜本隆二)による助成を受けて行われました。
原論文情報
- Hidenori Machino, Ai Dozen, Mariko Konaka, Masaaki Komatsu, Kohei Nakamura, Noriko Ikawa, Kanto Shozu, Ken Asada, Syuzo Kaneko, Hiroshi Yoshida, Tomoyasu Kato, Kentaro Nakayama, Vassiliki Saloura, and Ryuji Hamamoto, "Integrative analysis reveals early epigenetic alterations in high-grade serous ovarian carcinomas", Experimental & Molecular Medicine, 10.1038/s12276-023-01090-1
発表者
理化学研究所
革新知能統合研究センター 目的指向基盤技術研究グループ がん探索医療研究チーム
研究員 町野 英徳(マチノ・ヒデノリ)
チームリーダー 浜本 隆二(ハマモト・リュウジ)
副チームリーダー 小松 正明(コマツ・マサアキ)
上級研究員 浅田 健(アサダ・ケン)
国立がん研究センター研究所 医療AI研究開発分野
ユニット長 金子 修三(カネコ・シュウゾウ)
国立がん研究センター 中央病院
婦人腫瘍科
科長(研究当時)加藤 友康(カトウ・トモヤス)
病理診断科
医員 吉田 裕(ヨシダ・ヒロシ)
島根大学医学部 産科婦人科学講座
准教授(研究当時)中山 健太郎(ナカヤマ・ケンタロウ)
教授 京 哲(キョウ・サトル)
 町野 英徳
町野 英徳
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
国立がん研究センター 企画戦略局 広報企画室
Tel: 03-3542-2511 / Fax: 03-3542-2545
Email: ncc-admin [at] ncc.go.jp
島根大学医学部 総務課 企画調査係
Tel: 0853-20-2018 / Fax: 0853-20-2025
Email: mga-kikaku [at] office.shimane-u.ac.jp
※上記の[at]は@に置き換えてください。
