理化学研究所(理研)開拓研究本部 佐甲細胞情報研究室の佐甲 靖志 主任研究員、小林 俊秀 客員主管研究員らの国際共同研究チームは、エイズウイルス[1]の形成を担うウイルスタンパク質が、感染した細胞の細胞膜の脂質を再編成してウイルス被膜を形成することを見いだしました。本研究は、エイズウイルスの形成に感染細胞の脂質のダイナミックな変化が重要であり、膜脂質の動態が抗ウイルス剤の標的と成り得ることを示唆しています。
エイズウイルスやコロナウイルスなどは被膜ウイルスと呼ばれ、脂質膜に囲まれた構造をしています。ウイルスは自身で脂質を合成できないため、ウイルス粒子形成の際に感染細胞の細胞膜脂質の一部を利用しています。細胞膜にはさまざまな脂質が存在しますが、ウイルスは、感染細胞の脂質をランダムに獲得するわけではなく、主としてスフィンゴミエリンとコレステロールの二つの脂質を濃縮しています。これらの脂質の濃縮がウイルス活性の保持に必要であることが示されています。しかしウイルスがどのようにして特定の脂質を濃縮するかは分かっていませんでした。
エイズウイルスの形成にはGag[2]と呼ばれるウイルスタンパク質が中心的な役割を果たしています。今回、国際共同研究チームは感染細胞の膜脂質をナノメートルレベルで可視化することにより、Gagタンパク質がスフィンゴミエリンとコレステロールに富んだ脂質マイクロドメイン[3]を再編成、濃縮することを明らかにしました。さらに、ウイルスの形成にはGagタンパク質同士の会合によって誘導される、細胞膜の曲率の変化が重要であることを突き止めました。
本研究は、科学雑誌『Nature Communications』オンライン版(11月21日付:日本時間11月21日)に掲載されました。
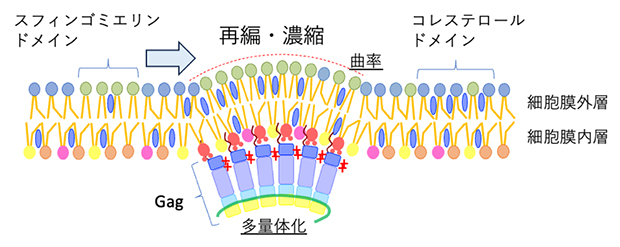
エイズウイルスタンパク質Gagによる脂質マイクロドメインの再編成・濃縮
背景
細胞膜は細胞を取り囲む最も外側の膜で、タンパク質と脂質から構成されています。細胞膜は外層と内層から成る脂質二重層の構造をとっていますが、その構成脂質は外層と内層で大きく異なっています。外層の主要な構成脂質はスフィンゴミエリンです。スフィンゴミエリンはコレステロールと親和性が高く、共に脂質マイクロドメインを形成します。この脂質マイクロドメインにはさまざまな生理機能や感染・病態における重要な役割があることが知られていますが、細胞膜における分布については不明な点が多くあります。
ヒト免疫不全ウイルスHIV-1はエイズ(後天性免疫不全症候群)の原因ウイルスです。2022年時点で、全世界で3,900万人注)の感染者が存在する公衆衛生上の脅威です。そのため、HIV-1の感染・複製メカニズムの解明と、創薬・治療への応用が求められています。
HIV-1が細胞へ感染すると、複製サイクル後期にウイルスの構造タンパク質Gagが細胞膜内層で多量体[4]構造を形成します。この多量体構造が足場となり、その上でウイルスの構成成分が組み立てられ、新たなウイルス粒子が細胞膜から出芽します。出芽の際、新たなウイルス粒子は感染細胞の細胞膜脂質を、自身を覆う被膜であるエンベロープとして獲得します(図1)。
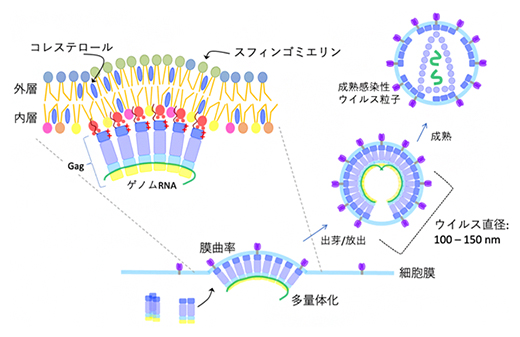
図1 HIV-1 Gagを足場にして新たなウイルス粒子が放出される仕組み
HIV-1が細胞に感染すると、Gagタンパク質が感染細胞の細胞膜内層で多量体化し、新たなウイルス粒子が出芽・放出する足場を作る。
これまでに、ウイルス粒子エンベロープの脂質組成の解析によって、スフィンゴミエリンとコレステロールを含む特定の細胞膜構成脂質が、感染細胞の細胞膜に比べて濃縮されていることが明らかにされてきました。さらに最近では、出芽後のウイルス粒子が成熟して感染能を獲得するために、スフィンゴミエリンが重要な役割を果たしていることが報告されています。しかし、感染細胞の細胞膜内層に局在するHIV-1 Gagが、直接接触のない細胞膜外層の脂質をどのように選択的にウイルス粒子に取り込むのかは分かっていませんでした。
研究手法と成果
本研究では、HIV-1 Gagが細胞膜内層で多量体化し出芽に至る過程で、細胞膜外層の脂質マイクロドメインの分布・動態を可視化・定量する必要がありました。通常ウイルス粒子の形成には、ウイルスゲノムの他にウイルス由来のタンパク質が必要です。一方、Gagタンパク質のみを細胞内で発現させると、感染性と複製能を持たないウイルス様粒子VLP(Virus-like particle)を産生できることが広く知られており、本研究でもこの実験系を使いました。また、細胞膜外層の脂質あるいは脂質マイクロドメインを可視化するために、スフィンゴミエリンに富んだ脂質マイクロドメインに特異的なプローブ(結合タンパク質)であるNT-Lysと、コレステロールに富んだ脂質マイクロドメインに特異的なプローブのD4を用いました。
ウイルスのサイズは直径100~150ナノメートル(nm、1nmは10億分の1メートル)、脂質マイクロドメインのサイズは直径5~50nmとされ、通常の蛍光顕微鏡の解像限界(約250nm)以下であるため、これらの構造の観察・計測には超解像顕微鏡法[5]や、異なるプローブ間の距離や比率に感度の高い、蛍光共鳴エネルギー移動に基づく蛍光寿命イメージング(FLIM-FRET)[6]を使用しました。
培養細胞にGagタンパク質を一時的に過剰発現させると、24時間後には細胞膜へ到達して直径約100nmのGagが集積した構造が観察されます。この細胞の培地に、蛍光標識したNT-LysあるいはD4を加えると、細胞膜外層の脂質マイクロドメインを蛍光標識することができます(図2)。
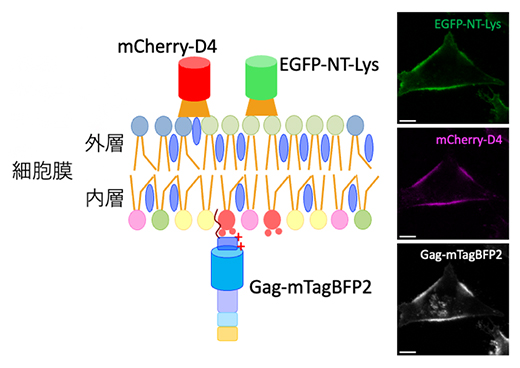
図2 細胞膜外層の脂質マイクロドメインと内層のGagタンパク質の可視化
スフィンゴミエリン、コレステロールに富んだ脂質マイクロドメインは、それぞれ蛍光タンパク質を融合したNT-Lys、D4で外側から標識した。一方、内層のGagタンパク質は、蛍光タンパク質を融合したGagタンパク質を細胞内で発現させることにより可視化した。左は標識の模式図、右は蛍光顕微鏡像。
超解像顕微鏡による計測により、Gagタンパク質が細胞膜を挟んでスフィンゴミエリンあるいはコレステロールに富んだ脂質マイクロドメインと同程度に共局在することを見いだしました。また、この共局在はGagの多量体の形成に依存して増加することが分かりました。スフィンゴミエリンに富んだ脂質マイクロドメインのサイズはGagタンパク質を発現させることによって増加した一方、コレステロールに富んだ脂質マイクロドメインのサイズは変化しませんでした。これらの結果は、Gagタンパク質がスフィンゴミエリンに富んだ脂質マイクロドメインを集め、大きなドメインを形成することを意味しています(図3)。
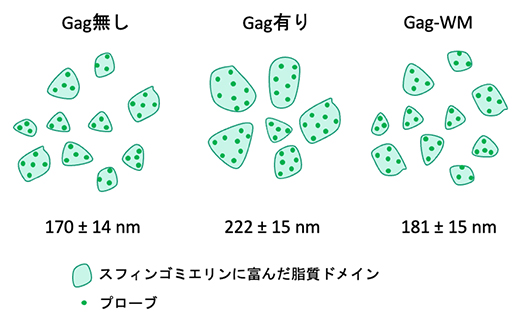
図3 Gagタンパク質によるスフィンゴミエリンに富んだ脂質マイクロドメインのサイズ変化
Gagタンパク質の発現によって脂質マイクロドメインのサイズは有意に大きくなったが、多量体を形成できない変異体(Gag-WM)では変化が見られなかった。数値はマイクロドメイン直径の平均値±誤差。
次に、脂質マイクロドメインの動態を計測し、Gagタンパク質の効果を検証しました。その結果、Gagタンパク質はスフィンゴミエリンに富んだ脂質マイクロドメインの動きを抑えることが分かりました。コレステロールに富んだ脂質マイクロドメインはGagタンパク質の有無に関わらず、常に動きが抑えられていることも明らかになりました。
さらに、二つの異なる脂質マイクロドメインの相対的な分布・動態に対するGagタンパク質の効果を評価するため、FLIM-FRETにより二つのプローブ間の距離・構成比率を計測しました。その結果、Gagタンパク質は二種類の脂質マイクロドメインを近接させることが分かりました。
以上の結果から、Gagタンパク質はまず、細胞膜内層でスフィンゴミエリンまたはコレステロールに富んだ脂質マイクロドメインの裏側に到達した後、近傍のスフィンゴミエリンに富んだ脂質マイクロドメインを捕捉して大きな脂質ドメインを形成すると考えられます。すると、最終的にスフィンゴミエリン、コレステロールに富んだ膜をエンベロープに持つウイルス粒子を産生できます。
最後に、Gagタンパク質が多量体化する際に形成する膜曲率が脂質マイクロドメインの再編にどのような影響を持っているかを検証しました。Gagタンパク質変異体のうち、膜曲率が小さい変異体P99AとEEは平たい多量体を作り、膜曲率が大きい変異体∆Lでは出芽したVLPが細胞膜から切り離されず、膜上にVLPが連なるような表現型を示します。FLIM-FRET計測によりこれらの変異体に対する細胞膜の脂質マイクロドメインの分布を調べた結果、膜曲率を形成できないP99A、EEはGagタンパク質を発現していないサンプルと、膜曲率が大きい∆Lは野生型のGagタンパク質と同様のパターンを示しました(図4)。この結果は、膜曲率がスフィンゴミエリンに富んだ脂質ドメインとコレステロールに富んだ脂質ドメインを近接、再編することに膜曲率が役割を果たしていることを示しています。
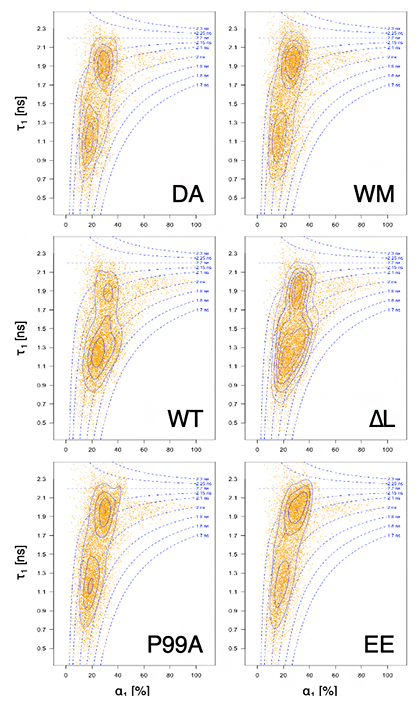
図4 膜曲率の異なるGagタンパク質変異体に対する脂質マイクロドメインの相互作用
スフィンゴミエリンに富んだ脂質マイクロドメインを標識するEGFP-NT-Lysの蛍光寿命は、近傍にコレステロールに富んだ脂質マイクロドメインを標識するmCherry-D4が存在することにより短くなる。この性質を生かして、蛍光寿命の違いによって両者の近接度合いを調べることができる。オレンジ色の点は顕微鏡画像の各ピクセルに相当し、それぞれのピクセルにおける平均蛍光寿命t1(縦軸)を持つ脂質マイクロドメインが存在する割合(横軸)をプロットした。Gagタンパク質がないとき(DA)には二つの分布が見られるが、Gagタンパク質野生型(WT)や∆Lを発現させると蛍光寿命t1の短い分布の割合が増加する。つまり、二つの脂質マイクロドメインが近付いていることが分かる。一方、P99AやEEを発現させると、Gagタンパク質がない時や多重体化できない変異体WMと同様の分布パターンを示す。このことは膜曲率が二つの異なる脂質マイクロドメインを近接させるのに重要であることを示している。
今後の期待
本研究成果は、エイズウイルスHIV-1の複製メカニズムを理解する上で重要な知見になると期待されます。COVID-19(新型コロナウイルス感染症)でもよく知られるように、ウイルスは変異しやすいため、ウイルス自身を標的とした創薬には限界があります。本研究のようにウイルス複製時の感染細胞側の因子の性質・動態を明らかにしていくことで、今後、感染細胞側の因子を標的とした創薬の一助となると期待されます。
細胞膜内層と外層の脂質マイクロドメイン同士は共役していると考えられています。しかしどのようなメカニズムが機能しているかは不明です。これは細胞膜上のタンパク質受容体や輸送タンパク質の機能とも関わる、基礎生物学の重要な課題の一つです。本研究で得られた知見や確立した実験系がその解明に貢献することが期待されます。
補足説明
- 1.エイズウイルス
HIV-1は、エンベロープを持つプラス鎖の一本鎖RNAウイルスであるレトロウイルス科レンチウイルス属に属する。エイズの主要な原因ウイルスである。 - 2.Gag
HIV-1 Gagは55kDaのマトリックス(MA)、キャプシド(CA)、ヌクレオキャプシド(NC)、p6など複数のドメインから成るタンパク質で、ウイルス粒子の形成に重要な役割を果たす。細胞膜からウイルス粒子が放出された後、各ドメインはウイルスプロテアーゼによって切断され、感染性を持った成熟ウイルスの生成に機能する。 - 3.脂質マイクロドメイン
物理化学的に親和性の高いスフィンゴ脂質とコレステロールといった脂質同士が集まってできる構造的・機能的なまとまりのこと。細胞の情報伝達や膜輸送、ウイルス感染において重要な役割を果たしていることが示唆されている。 - 4.多量体
同種のタンパク質が、物理的・化学的な相互作用で複数まとまった分子を指す。 - 5.超解像顕微鏡法
従来の光学顕微鏡が持つ回折限界を超えた分解能を発揮する顕微鏡法。超解像度の蛍光顕微鏡の開発に関しては、2014年にノーベル化学賞が授与された。本研究では、PALM(photoactivation localization microscopy)、dSTORM(direct stochastic optical reconstruction microscopy)を使用した。 - 6.蛍光寿命イメージング(FLIM-FRET)
蛍光分子の蛍光寿命は、その周りの環境に影響を受けやすい。2種類の蛍光分子が発光スペクトルと励起スペクトルに重なりを持ち、かつ分子間の距離が約10nm以下のとき、一方の分子(ドナー)から他方(アクセプター)へとエネルギーの受け渡し(蛍光共鳴エネルギー移動)が起こり、ドナーの蛍光寿命が短くなる。この蛍光寿命を測定することにより、分子間の距離やドナー/アクセプターの比率をモニターする方法。FLIM-FRETはFluorescence lifetime imaging based on Förster resonance energy transferの略。
国際共同研究チーム
理化学研究所
開拓研究本部 佐甲細胞情報研究室
主任研究員 佐甲 靖志(サコウ・ヤスシ)
客員主管研究員 小林 俊秀(コバヤシ・トシヒデ)
(ストラスブール大学 リサーチディレクター)
ストラスブール大学(フランス)
研究員 冨重 斉生(トミシゲ・ナリオ)
大学院生 Maaz Bin Nasim(マーズ・ビン・ナシム)
研究員(研究当時)村手 源英(ムラテ・モトヒデ)
(現 理研 脳神経科学研究センター 電子顕微鏡技術支援ユニット 技師)
テクニカルスタッフ Brigitte Pollet(ブリジット・ポレット)
教授 Pascal Didier(パスカル・ディディエ)
助教授 Julien Godet(ジュリアン・ゴデット)
上級技官 Ludovic Richert(ルドビッヒ・リシャール)
教授 Yves Mély(イヴ・メリー)
研究支援
本研究は、Agence Nationale de Recherche sur le Sida et les Hépatites Virale 18365(研究代表者:小林俊秀)、Agence Nationale de la Recherche A20R417C(研究代表者:小林俊秀)、理研グライコリピドローグプログラム(研究代表者:佐甲靖志)による助成を受けて行われました。
原論文情報
- Nario Tomishige, Maaz Bin Nasim, Motohide Murate, Brigitte Pollet, Pascal Didier, Julien Godet, Ludovic Richert, Yasushi Sako, Yves Mély, and Toshihide Kobayashi, "HIV-1 Gag targeting to the plasma membrane reorganizes sphingomyelin-rich and cholesterol-rich lipid domains", Nature Communications, 10.1038/s41467-023-42994-w
発表者
理化学研究所
開拓研究本部 佐甲細胞情報研究室
主任研究員 佐甲 靖志(サコウ・ヤスシ)
客員主管研究員 小林 俊秀(コバヤシ・トシヒデ)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
