理化学研究所(理研)生命医科学研究センター 自然免疫システム研究チームの大瀧 夏子 研究生、茂呂 和世 チームリーダー(大阪大学大学院 医学系研究科 生体防御学教室 教授)らの共同研究グループは、指定難病である特発性肺線維症(idiopathic pulmonary fibrosis:IPF)の病態解明に役立つ新たなモデルマウスを開発し、このモデルマウスを解析することによって、病気の発症と進行に自然リンパ球(innate lymphoid cells:ILC)[1]が重要な役割を担うことを明らかにしました。本研究成果は、いまだ効果的な治療法がない肺線維症の病態の理解や、新薬開発に貢献すると期待されます。
共同研究グループは、自然リンパ球を抑制する二つの遺伝子(Ifngr1[2]とRag2[3]遺伝子)を欠損するマウス(欠損を記号「-/-」で表し、Ifngr1-/-Rag2-/-と表す)を樹立することで、自然リンパ球の恒常的な活性化によって肺線維症が自然発症することを発見し、これまで報告されてきた上皮細胞のDNA損傷から始まる線維化とは異なる、線維化発症機構が存在することを明らかにしました。自然リンパ球の活性化は線維芽細胞[4]からのコラーゲン産生を誘導し、また線維芽細胞は自然リンパ球を活性化するインターロイキン-33(IL-33)を産生することから、自然リンパ球と線維芽細胞の間に形成されるポジティブフィードバック機構が肺線維症の慢性化および不可逆性を生み出す可能性があることが明らかになりました。
本研究は、科学雑誌『Nature Communications』オンライン版(12月14日付:日本時間12月14日)に掲載されました。
背景
IPFは指定難病の一つで、肺にコラーゲンなどの細胞外マトリクス[5]が蓄積することで、呼吸困難をきたす疾患です。上皮細胞のDNA損傷によって起こる免疫系の活性化が原因の一つと考えられてきました。しかしヒトの病態に類似するモデルマウスがなかったため、その病態解明は遅れています。有効な治療法に乏しく、進行し続け、診断確定後の平均生存期間は数年と予後が極めて悪い疾患であるため、IPFの病態解明と治療法の開発は喫緊の課題です。IPFのリスク因子として、外から体の中に侵入する外来因子(喫煙、化学物質、薬剤など)の他に、内在性因子(加齢、炎症など)が指摘されてきました。
IPFの病態解明をするために、これまでの研究ではブレオマイシン[6]などの薬剤を肺に投与することで線維化を誘導するモデルマウスが世界中で使用されてきました。しかしながらこのモデルマウスは、薬剤を外から投与しているため、内在性因子がどのように疾患に関与するのかを解析することができません。また、薬剤の効果が切れると線維化が自然に治癒してしまうため、症状の悪化が進行性であるヒトIPFの病態を正確に模しているとはいえませんでした。
この問題を解決するため、薬剤投与なしに肺線維症を自然発症し、病態が進行し続けるモデルマウスが必要とされていました。
研究手法と成果
共同研究グループは、内在性因子による線維化発症機構を明らかにするために、内在性因子のみで活性化できることが知られている2型自然リンパ球(Group 2 innate lymphoid cells:ILC2)に着目しました。外来因子の関与を除くために獲得免疫系の細胞を欠損するRag2欠損マウスをベースに、ILC2を強力に抑制することが知られているIFNγに対する受容体を欠損させた遺伝子二重欠損マウス(Ifngr1-/-Rag2-/-マウス)を作製しました。このマウスでは、IFNγによる抑制がなくなるためILC2が活性化しやすい状態になります。その結果、若いIfngr1-/-Rag2-/-マウスは免疫細胞も呼吸機能も正常ですが、加齢によって徐々にILC2が活性化し、20週齢ごろにはほとんどのマウスで肺線維症が自然発症することが明らかになりました(図1)。
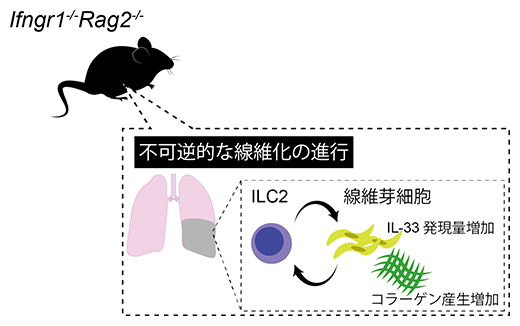
図1 Ifngr1-/-Rag2-/-マウスにおける肺線維症
遺伝子二重欠損マウス(Ifngr1-/-Rag2-/-マウス)では、ILC2が活性化し、線維芽細胞からのコラーゲン産生を誘導し線維化が引き起こされる。また線維芽細胞はIL-33を発現することで、ILC2の活性化を助長する。
病態が時間とともに悪化していくメカニズムを解明するために、病期を健常期・炎症期・線維化期の三つのフェーズに分け、詳細な解析を進めました(図2)。その結果、炎症期にILC2がまず増加し、線維化期になると呼吸困難の指標である血中酸素飽和度の低下、静肺コンプライアンスの低下が見られ、ヒトIPF患者と類似した病態を形成することが分かりました。
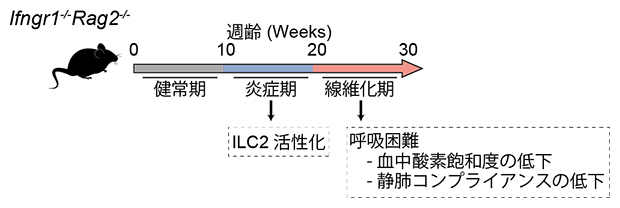
図2 Ifngr1-/-Rag2-/-マウス肺線維症のフェーズごとの解析
Ifngr1-/-Rag2-/-マウスの病態進行を健常期、炎症期、線維化期に分けて解析を行った。炎症期に入るとILC2が活性化し、線維化期には呼吸困難の指標である血中酸素飽和度の低下および静肺コンプライアンスの低下が起こる。
理研生命医科学研究センターエピゲノム技術研究チーム(研究当時)の蓑田亜希子チームリーダー(研究当時)らの協力を得て、シングルセルRNAシークエンス解析[7]を進めたところ、炎症期にILC2が活性化することで線維芽細胞からのコラーゲン産生が誘導され、線維化を引き起こすことが明らかになりました。さらにコラーゲンを産生するようになった線維芽細胞は危機シグナルの一つであるIL-33を発現するようになることを発見しました。IL-33はILC2を強力に活性化することから、ILC2と線維芽細胞が互いに活性化し合うことが、線維症が外来刺激なしに進行し続ける原因となる可能性があることも突き止めました。加えてILC欠損マウスやIL-33欠損マウスをIfngr1-/-Rag2-/-マウスにかけ合わせることで、ILC2やIL-33が線維化の発症に不可欠であることを同定しました。
このメカニズムがヒトにも存在するかどうかを確かめるため、神奈川県立循環器呼吸器病センター、東海大学、およびアステラス製薬の共同研究者とともにヒトIPF患者の末梢血中ILC2を解析したところ、ヒトのILC2においても、同様の機能を持つIFNGR1遺伝子の低下、およびIL-33受容体遺伝子の高発現が見られたことから、IFNγの機能低下に起因するIL-33を介したILC2と線維芽細胞の相乗効果がヒトIPF患者においても存在する可能性があることが確認されました。
今後の期待
これまで研究に用いられてきた線維化モデルマウスは、外来因子によって誘導される線維化発症機構の理解に貢献してきました。しかし、内在性因子を考慮した解析なくして肺線維症の全貌は解明されません。今回新たに開発されたモデルマウスは、世界で初めて加齢に伴う線維化を再現しました。今後、このマウスに外来因子を組み合わせて病態の進行を解析したり、線維化を完全に止めることが可能な薬の開発に利用したりすることで、さらなるIPFの発症メカニズムの解明や新薬開発に貢献することが見込まれます。特に、これまで提案されてこなかった自然免疫をターゲットにした新薬の開発が大きく進む可能性が期待できます。
補足説明
- 1.自然リンパ球(innate lymphoid cells:ILC)
抗原を認識する受容体を持たないリンパ球。これに対して、抗原を特異的に認識するリンパ球として、T細胞、B細胞、ナチュラルキラー(NK)T細胞が知られている。ILCはその機能に基づいてILC1、ILC2、ILC3に分類されており、この中で、ILC2は茂呂チームリーダーらが2010年に新しく同定したリンパ球である注1)。- 注1)Moro, K. et al. (2010). Innate production of T H 2 cytokines by adipose tissue-associated c-Kit + Sca-1 + lymphoid cells. Nature 463, 540-544.
- 2.Ifngr1
インターフェロンγに対する受容体をコードする遺伝子。インターフェロンγは主に、T細胞やNK細胞から分泌される物質であり、炎症を引き起こす。茂呂チームリーダーらは2016年にILC2の抑制因子に関する検討を行った結果、IFNγが最も強くILC2を抑制することを報告している注2)。- 注2)Moro, K. et al. (2016). Interferon and IL-27 antagonize the function of group 2 innate lymphoid cells and type 2 innate immune responses. Nat Immunol 17, 76-86.
- 3.Rag2
獲得免疫系のリンパ球(T、B、NKT細胞)は、体内に侵入した病原体や異物の構造を認識するための多種多様な抗原受容体を持っている。この多様性を作るために、Rag2という遺伝子の働きで、抗原受容体の構造を変化させる機構が獲得免疫系の細胞には備わっている。Rag2遺伝子が欠損したマウス(Rag2-/-マウス)には、獲得免疫系のリンパ球が存在しない。 - 4.線維芽細胞
コラーゲンなどの細胞外マトリクスを産生する細胞。この細胞が過剰に活性化することで、余分な細胞外マトリクスが組織に蓄積し、線維症が発症する。 - 5.細胞外マトリクス
組織を構成する、非細胞性の構成物。 - 6.ブレオマイシン
抗がん剤の一種。重篤な副作用として肺線維症が起きることが知られている。従来、マウスにブレオマイシンを投与することで肺線維症を人工的に引き起こし、肺線維症モデルとして使用してきた。 - 7.シングルセルRNAシークエンス解析
1細胞ごとに転写産物(RNA)の種類と量を網羅的に検出する技術。計測されたRNA発現パターンに基づいて、多くの種類の細胞が含まれた細胞集団を亜集団に分類し、解析することが可能である。
共同研究グループ
理化学研究所 生命医科学研究センター
自然免疫システム研究チーム
チームリーダー 茂呂 和世(モロ・カズヨ)
(大阪大学 大学院医学系研究科 生体防御学教室 教授)
研究生 大瀧 夏子(オオタキ・ナツコ)
(慶應義塾大学大学院 医学研究科 博士課程 大学院生)
テクニカルスタッフⅠ 望月 美穂(モチヅキ・ミホ)
テクニカルスタッフⅠ 岳野 なつき(タケノ・ナツキ)
免疫細胞システム研究チーム
チームリーダー 小安 重夫(コヤス・シゲオ)
エピゲノム技術研究チーム(研究当時)
チームリーダー(研究当時)蓑田 亜希子(ミノダ・アキコ)
(現 ゲノム情報解析チーム 客員主管研究員)
研究員(研究当時)トミー・テロオアテア(Tommy Terooatea)
(現 ゲノム情報解析チーム 客員主管研究員)
特別研究員(研究当時)トーマス・ケリー(S. Thomas Kelly)
大阪大学
大学院 医学系研究科 生体防御学教室
准教授 本村 泰隆(モトムラ・ヤスタカ)
大学院 医学系研究科/生命機能研究科 免疫細胞生物学教室
准教授 菊田 順一(キクタ・ジュンイチ)
免疫学フロンティア研究センター・微生物病研究所(中央実験室)
助教(研究当時)杉原 文徳(スギハラ・フミノリ)
(現 阪大微生物病研究会(BIKEN財団))
東京大学 先端科学技術研究センター
特任助教 玉光 未侑(タマミツ・ミウ)
アステラス製薬
研究員(研究当時)齊田 裕治(サイタ・ユウジ)
研究員 永野 勇治(ナガノ・ユウジ)
研究員 宮之原 遵(ミヤノハラ・ジュン)
東海大学医学部 内科学系 呼吸器内科
教授 浅野 浩一郎(アサノ・コウイチロウ)
特任講師 白石 良樹(シライシ・ヨシキ)
神奈川県立循環器呼吸器病センター 呼吸器内科
所長兼臨床研究所長 小倉 髙志(オグラ・タカシ)
医長 北村 英也(キタムラ・ヒデヤ)
研究支援
本研究は、日本学術振興会科学研究費助成事業基盤研究(S)「2型自然リンパ球による特発性間質性肺炎発症機構の解明(研究代表者:茂呂和世)」、同新学術領域研究(研究領域提案型)「予防を科学する炎症細胞社会」の「肺線維症を自然発症するマウスを用いた細胞ネットワーク解析(研究代表者:本村泰隆)」、同特別研究員奨励費「肺線維症におけるILC2の役割解明(研究代表者:大瀧夏子)」、武田報彰医学研究助成「2型自然リンパ球による線維化発症機構(研究代表者:茂呂和世)」による助成を受けて行われました。
原論文情報
- Natsuko Otaki, Yasutaka Motomura, Tommy Terooatea, S. Thomas Kelly, Miho Mochizuki, Natsuki Takeno, Shigeo Koyasu, Miu Tamamitsu, Fuminori Sugihara, Junichi Kikuta, Hideya Kitamura, Yoshiki Shiraishi, Jun Miyanohara, Yuji Nagano, Yuji Saita, Takashi Ogura, Koichiro Asano, Aki Minoda, Kazuyo Moro, "Activation of ILC2s through constitutive IFNγ signaling reduction leads to spontaneous pulmonary fibrosis", Nature Communications, 10.1038/s41467-023-43336-6
発表者
理化学研究所
生命医科学研究センター 自然免疫システム研究チーム
チームリーダー 茂呂 和世(モロ・カズヨ)
(大阪大学 大学院医学系研究科 生体防御学教室 教授)
研究生 大瀧 夏子(オオタキ・ナツコ)
 茂呂 和世
茂呂 和世
 大瀧 夏子
大瀧 夏子
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
大阪大学 大学院医学系研究科 広報室
Tel: 06-6879-3387
Email: medpr [at] office.med.osaka-u.ac.jp
※[at]は@に置き換えてください。
