理化学研究所(理研)環境資源科学研究センター 機能有機合成化学研究チームのイリエシュ・ラウレアン チームリーダー、浅子 壮美 上級研究員らの研究チームは、スピロビピリジン(SpiroBpy)配位子[1]を持つイリジウム(Ir)[2]触媒[3]が、芳香族炭化水素[4]の官能基化反応において極めて高活性な触媒性能を示すことを突き止めました。
本研究成果は、医農薬品や機能性分子の迅速かつ効率的な合成手法の開発に貢献すると期待されます。
短時間で効率よく目的化合物を合成する手法として高活性触媒を開発することは、持続可能な有機合成の実現へ向けた重要な課題です。地球上に豊富にある炭化水素は、一般に反応性が低いため、直接官能基化を行うためには高活性な触媒が必要です。中でも、Ir錯体とビピリジン[5]配位子を触媒とする芳香族炭化水素の直接ホウ素化反応[6]が有用な合成法として知られます。しかし、基質として電子豊富[7]な芳香族炭化水素を制限試薬[8]として用いた反応を効率的に行うことは困難でした。
今回、研究チームは、SpiroBpy配位子とIr錯体から成る触媒を用いて、電子豊富な基質を含む幅広い芳香族炭化水素の効率的なホウ素化反応の開発に成功しました。この触媒は、これまでに報告された触媒の効率を上回り、グラムスケールでの複雑な医薬品分子の官能基化に利用できます。理論計算および重水素[9]標識した配位子を用いた速度論的同位体効果[10]実験より、本反応における加速効果の要因の一つとして、SpiroBpy配位子と基質の間に働く非共有結合性相互作用[11](特にCH-π相互作用)が重要であることが示唆されました。本研究は、科学雑誌『Nature Communications』オンライン版(4月17日付)に掲載されました。
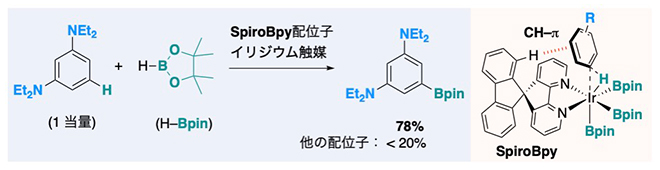
SpiroBpy配位子を持つIr触媒を用いた電子豊富な芳香族炭化水素の官能基化
背景
豊富な資源である炭化水素を直接官能基化することができれば、医薬品分子や機能性分子、高分子などの標的化合物を短工程で効率的に合成できるようになります。そのような反応として、遷移金属触媒を用いた芳香族化合物のホウ素化反応があり、得られる有機ホウ素化合物が有機合成の有用な中間体となることから、広く研究されています。ホウ素化反応の効率的な触媒として、Ir錯体とビピリジン誘導体を配位子とする触媒系が知られています。しかし、特にピナコールボラン(HBpin)をホウ素化剤として、電子豊富な芳香族炭化水素基質を温和な条件下で反応させることは、依然として困難な課題でした。
研究手法と成果
研究チームは、平面的な構造を持つ2,2'-ビピリジンを3次元的に拡張したスピロビピリジン(SpiroBpy)に「屋根」となるBPin(ピナコールボリル)基を取り付けた配位子「ルーフ配位子」を設計し、遠隔位立体制御を可能とすることで、Ir触媒による芳香族炭化水素のホウ素化反応がメタ位[12]選択的に進行することを報告しました注1)。この研究を進める中で、ルーフ配位子は現在よく用いられている配位子(図1のdtbpy配位子やtmphen配位子)よりも高い選択性があることに加え、高い反応性も持っていることを発見しました。さらに検討を進めた結果、「屋根」を取り除いたSpiroBpy骨格そのものに反応加速効果があることを突き止めました。
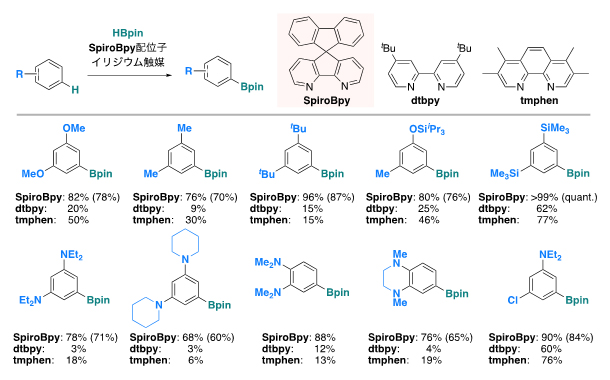
図1 SpiroBpy配位子を持つIr触媒による芳香族化合物のホウ素化反応
スピロビピリジン(SpiroBpy)配位子を持つイリジウム触媒(Ir/SpiroBpy触媒)を用いて、芳香族炭化水素にBpin基(ピナコールボリル基)を導入するホウ素化反応(上段)。フェノール誘導体、アルキルベンゼン誘導体、アニリン誘導体、アリールシラン誘導体のホウ素化反応の例(下段)。いずれの場合も、よく用いられているdtbpy配位子やtmphen配位子よりも高い収率で生成物を与えることが分かった。収率は反応粗生成物のGC(ガスクロマトグラフ)もしくはNMR(核磁気共鳴)収率とカッコ内に精製操作後の単離収率を示す。
図1で示したように、SpiroBpy配位子とIr錯体から成る本触媒系により、電子豊富なフェノール誘導体、アニリン誘導体、アルキルベンゼン誘導体のホウ素化反応が温和な条件で円滑に進行し、dtbpy配位子やtmphen配位子よりも顕著な加速効果を示しました。本触媒系は、医薬品分子のホウ素化にも適用可能であり、グラムスケールでも問題なく反応が進行しました(図2)。理論計算および重水素標識したSpiroBpy配位子を用いた速度論的同位体効果実験から、SpiroBpy配位子と基質の間に働く非共有結合性相互作用、特にCH-π相互作用が、反応促進の駆動力の一つであることが示唆されました。このような弱い相互作用を使った触媒活性の向上は、これまで例がほとんどありませんでしたが、SpiroBpy配位子の剛直な3次元構造を生かすことで可能になりました。CH結合もπ電子も有機分子にありふれた要素であるため、さらなる応用が期待されます。
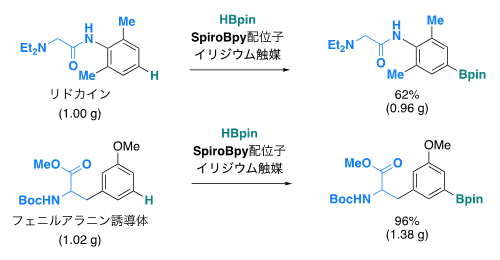
図2 本反応を用いた医薬品などの官能基化の例
Ir/SpiroBpy触媒を用いて、医薬品分子や生物活性物質にBpin基(ピナコールボリル基)を導入するホウ素化反応をグラムスケールで行うことができる。
- 注1)2022年2月11日プレスリリース「ルーフ配位子で位置選択的合成に成功」
今後の期待
代表的な窒素二座配位子であるビピリジン化合物は、発見以降100年以上の歴史を持ち、配位子設計をする際の基本骨格として広く用いられています。これまでのビピリジン修飾法は、ビピリジン分子の周縁部を平面的に修飾するものが大多数でした。
一方、本研究のように、ビピリジンを3次元拡張したスピロビピリジン構造を利用することで、ビピリジン平面の上下に広がる未開拓空間を機能化し、金属触媒の反応性や基質との相互作用を制御するための新しい反応場の構築が可能になります。これらの相互作用には、弱くてこれまで利用が困難だったCH-π相互作用なども含まれます。
今後も、多様な機能性SpiroBpy配位子の開発により、さまざまな相互作用を利用して金属触媒反応を制御するための独創的な触媒設計指針が提供されることが期待されます。
今回の研究は、国際連合が定めた17項目の「持続可能な開発目標(SDGs)[13]」のうち「12.つくる責任つかう責任」に大きく貢献する成果です。
補足説明
- 1.配位子
錯体化合物の中心金属原子に配位して、その性質を変化させたり機能を付与したりする化合物。 - 2.イリジウム(Ir)
周期表の第9族に属する原子番号77の遷移金属元素。芳香族炭化水素のホウ素化反応の触媒として最もよく用いられる金属の一つ。 - 3.触媒
化学反応の反応速度を速める物質。触媒自身は反応前後で変化しない。 - 4.芳香族炭化水素
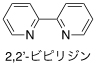
炭素原子と水素原子から成る化合物のうち、ベンゼン環を含み芳香族性を示すもの。アレーンとも呼ばれる。 - 5.ビピリジン
ピリジン分子が二つの炭素−炭素単結合でつながった分子をビピリジンという。金属の配位子としては、下に示す2,2'-ビピリジンがよく用いられる。
- 6.ホウ素化反応
置換反応や付加反応によりホウ素原子を導入する反応。本研究では、炭素に結合した水素原子をホウ素原子で置換している。 - 7.電子豊富
置換基の影響により、ベンゼン環上の(主にπ)電子の密度が高くなった状態を電子豊富、低くなった状態を電子不足と言う。一般に、イリジウム触媒によるホウ素化反応において、電子豊富な基質を用いると反応効率が低下することが知られている。 - 8.制限試薬
化学反応の生成物の量を制限する反応物。反応が理想的に進行すると最初に消失し、その時点で反応は終了する。本研究では、芳香族炭化水素を制限試薬として1当量、ピナコールボランを過剰量用いている。 - 9.重水素
水素原子の安定同位体の一つ。通常の軽水素(電子1個+陽子1個)と異なり、重水素は中性子も持つため(電子1個+陽子1個+中性子1個)、その質量はほぼ2倍になる。 - 10.速度論的同位体効果
ある原子をその同位体で置換したときに反応速度の変化が生じる効果のこと。 - 11.非共有結合性相互作用
共有結合を作らずに分子間に働くさまざまな相互作用の総称。原子間で電子を共有する強固な共有結合に比べ、非共有結合性相互作用は一般に弱い。静電相互作用、水素結合相互作用、本研究で鍵となるCH-π相互作用などが挙げられる。 - 12.メタ位
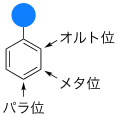
一置換ベンゼンには、置換基(青丸)が結合した炭素原子以外に3種類の炭素がある。近い順にオルト位、メタ位、パラ位と区別される。
- 13.持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴール、169のターゲットから構成され、発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる(外務省ホームページから一部改変して転載)。
研究チーム
理化学研究所 環境資源科学研究センター 機能有機合成化学研究チーム
チームリーダー イリエシュ・ラウレアン(ILIES Laurean)
上級研究員 浅子 壮美(アサコ・ソウビ)
特別研究員(研究当時)金 玉樹(キン・ギョクキ)
特別研究員(研究当時)ラマドス・ブーバラン(RAMADOSS Boobalan)
研究支援
本研究は、理化学研究所奨励課題(研究代表者:浅子壮美)により実施し、日本学術振興会(JSPS)科学研究費助成事業学術変革領域研究(A)「Development of SpiroBipyridine Ligands for Efficient and Selective C-H Activation(研究代表者:イリエシュ・ラウレアン)」、同基盤研究(B)「豊富・安定化合物を利用するサステイナブル有機合成の開拓(研究代表者:浅子壮美)」、同若手研究「Development of Bifunctional Ligands for Efficient Selective Activation of Simple Arenes(研究代表者:金玉樹)」、住友財団基礎科学研究助成「分子認識による有機分子の選択的直接変換(研究代表者:イリエシュ・ラウレアン)」、松籟科学技術振興財団研究助成「スピロビピリジンの機能開拓:豊富な炭化水素資源の効率的かつ選択的官能基化(研究代表者:浅子壮美)」の助成を受けて行われました。
原論文情報
- Yushu Jin, Boobalan Ramadoss, Sobi Asako, Laurean Ilies, "Noncovalent Interaction with a Spirobipyridine Ligand Enables Efficient Iridium-Catalyzed C-H Activation", Nature Communications, 10.1038/s41467-024-46893-6
発表者
理化学研究所
環境資源科学研究センター 機能有機合成化学研究チーム
チームリーダー イリエシュ・ラウレアン(ILIES Laurean)
上級研究員 浅子 壮美(アサコ・ソウビ)
 イリエシュ・ラウレアン
イリエシュ・ラウレアン
 浅子 壮美
浅子 壮美
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
