理化学研究所(理研)生命機能科学研究センター 動的恒常性研究チームのユ・サガン チームリーダー(理研 開拓研究本部 Yoo生理遺伝学研究室 主任研究員)、内藤 早紀 特別研究員らの研究チームは、ショウジョウバエ[1]を用いて、個体の老化に伴って腸の組織幹細胞[2]が疲弊していく際に、染色体の特定領域の構造と遺伝子発現が変化することを発見しました。
本研究成果は、老化に伴って幹細胞の性質が変化する「幹細胞疲弊[3]」の分子機構の解明に迫るものであり、ヒトを含めた動物の老化現象の理解につながることが期待できます。
個体が老化すると、腸幹細胞などの組織幹細胞は、がん化し過剰に増殖することもあれば、増殖能力を失う「幹細胞疲弊」という状態になることも知られています。幹細胞疲弊は、幹細胞数の減少や組織再生能の低下をもたらしますが、これがどのような分子機構で起こるのか明確ではありませんでした。
今回、研究チームは、ショウジョウバエの腸幹細胞を用い、腸幹細胞が老化に伴って疲弊する分子機構に着目しました。染色体[4]の構造変化と遺伝子[5]の発現変化を解析した結果、Trl[6]というタンパク質で制御される染色体領域が老化に伴い閉じていき、その領域に存在する遺伝子の発現が低下することで、細胞が疲弊していくことを発見しました。
本研究は、科学雑誌『iScience』オンライン版(9月9日付:日本時間9月10日)に掲載されます。
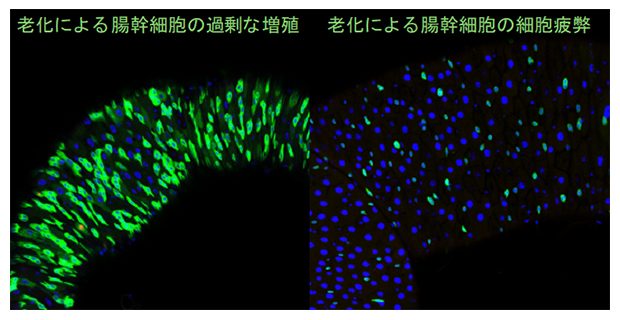
老化時に起こる腸幹細胞の過剰な増殖(緑)と、増殖しない疲弊した腸幹細胞(青)
背景
組織幹細胞は、体のさまざまな組織に存在する未分化な細胞であり、組織の維持や再生に寄与します。老化すると組織幹細胞の機能に異常が起こり、過剰に増殖してがん化したり、反対に正常な増殖能を失って幹細胞疲弊という状況に陥ったりすることが知られています。ヒトにおいて、細胞のがん化の分子機構は理解がかなり進んでいる一方で、老化に伴って起こる幹細胞疲弊の分子機構はまだ多くが不明です。以前、ユ チームリーダーらはショウジョウバエの腸幹細胞が老化によってがん化する機構を突き止めました注1)。今回はこの実験系を用いて、老化に伴いどのような分子機構で幹細胞疲弊が起こるのかを解明することに挑みました。
- 注1)2021年4月6日プレスリリース「老化による幹細胞のがん化機構の発見」
研究手法と成果
研究チームは、幹細胞疲弊の分子機構を調べるために、ショウジョウバエの腸幹細胞において、老化に伴う染色体構造と遺伝子発現の変化に着目しました。若齢と老齢のショウジョウバエについて、染色体構造をATAC-seq[7]という手法で、遺伝子発現をRNA-seq[8]という手法で、それぞれ解析した結果、オスとメスの両方において、老化に伴い染色体構造と遺伝子発現の両者が変化することが分かりました(図1)。
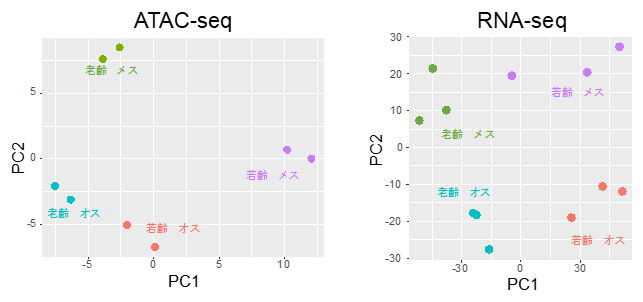
図1 若齢・老齢時のATAC-seqとRNA-seqの主成分分析
若齢オス(オレンジ)、若齢メス(紫)、老齢オス(水色)、老齢メス(緑)それぞれから採取した腸幹細胞を、ATAC-seq(染色体構造に基づく解析)あるいはRNA-seq(遺伝子発現に基づく解析)で解析し、得られた塩基配列の特徴を統計的手法(主成分分析)により二つの変数(PC1:主成分1、PC2:主成分2)に縮減し、2次元グラフで表現したもの。
- (左)若齢・老齢時のオス・メスの腸幹細胞におけるATAC-seqの主成分分析。それぞれ2個体から独立に得た結果を2次元グラフ上の点で示した。近い位置にある点は、互いに似通った特徴を持つことを示す。オス、メスともに、若齢の点と老齢の点が離れていることから、老化すると染色体の構造変化が起きることが示された。
- (右)若齢・老齢時のオス・メスの腸幹細胞におけるRNA-seqの主成分分析。それぞれ3個体から独立に得た結果を2次元グラフ上の点で示した。ATAC-seqと同様に、オス、メスともに老化すると遺伝子発現が変化することを示す。
次に、染色体構造の変化が見られたDNA領域を詳しく解析すると、Trlという転写因子[9]によって発現制御される遺伝子が多く見つかりました。これらの遺伝子領域の染色体構造は老化に伴い閉じていき(図2)、その発現も低下する傾向にありました。
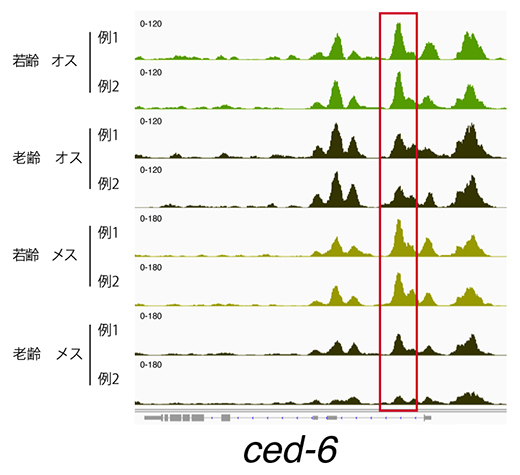
図2 転写因子Trlによって制御されるced-6領域の老化時の染色体構造変化
ATAC-seqは、開いた構造を持つ染色体領域のDNA配列を選択的に決定する手法であり、ATAC-seqで多量に解読されたDNA配列は、その領域が開いていることに対応する。図は、ced-6遺伝子のゲノム領域のうち、ATAC-seqで決定された配列の頻度を縦軸で表したグラフ。赤の囲みは、オス、メスともに老化個体と若齢個体で特に顕著な差が見られた領域を示し、老化とともにこの領域の染色体構造が閉じる(ピークが低くなる)ことを示唆する。
Trlは、染色体構造を制御して標的遺伝子の発現や抑制に関わることが知られています。また、Trlの発現制御を受ける遺伝子の一つに、ced-6[10]があります。そこで、Trlやced-6の腸幹細胞での発現をRNAi法[11]によって阻害したところ、老化時の細胞増殖が抑制され、幹細胞疲弊を人為的に誘導できることが分かりました(図3)。
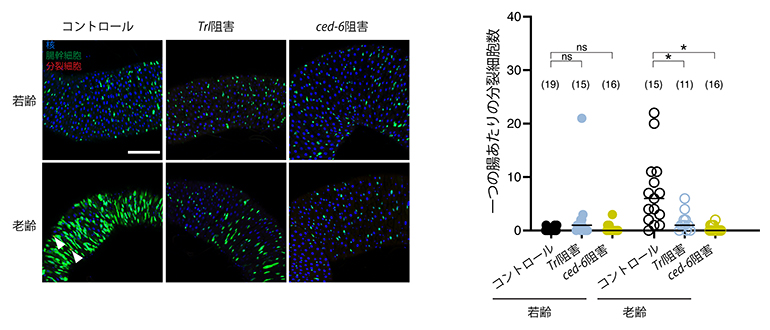
図3 Trlもしくced-6の発現阻害による老化時の幹細胞疲弊促進
腸幹細胞においてTrlもしくはced-6の発現をRNAi法によって人為的に阻害したところ、老化時の幹細胞疲弊が促進された。
- (左)腸組織の蛍光顕微鏡観察像。青は視野内の全細胞の核、緑は腸幹細胞、赤は分裂細胞を示す。発現操作をしないコントロールでは、老齢時に十分な腸幹細胞が存在し、一部では過剰な細胞分裂が生じていた(白の矢頭)。一方Trlもしくはced-6の発現を阻害すると、幹細胞が著しく減少する幹細胞疲弊が促進された。スケールバーは100μm。
- (右)腸における分裂細胞数を定量的に解析したグラフ。Trlもしくはced-6の発現阻害は、若齢ではほとんど影響しなかったが、老齢では分裂細胞数を顕著に減少させた。ns:有意差なし。*:有意差あり。
さらに、研究チームは、老化時以外の通常の細胞増殖が促進されるような状況で、Trlやced-6の阻害により腸幹細胞の疲弊を誘導できるかを調べました。ストレスを受けた腸組織は幹細胞を増殖させて傷を修復しようとしますが、そのような状況でも、Trlやced-6の発現を阻害すれば幹細胞疲弊を引き起こすことができました。すなわち、Trlやced-6の幹細胞疲弊への関与は、老化時だけでなく、細胞増殖が促進されるさまざまな状況で起きることが分かりました。
以上の結果から、老化時の幹細胞疲弊は、Trlで制御される遺伝子領域が閉じる染色体構造変化により、ced-6などの遺伝子発現が低下することで引き起こされるという分子機構が見いだされました(図4)。
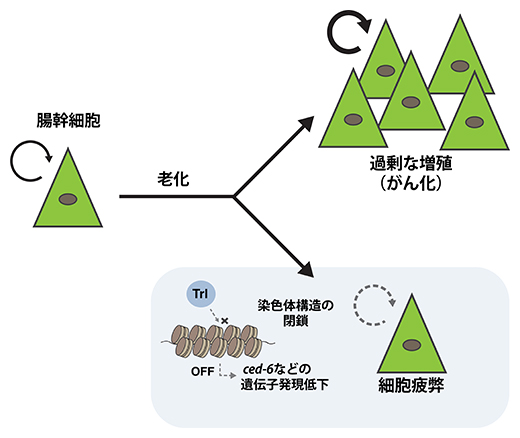
図4 老化時に腸幹細胞で起こる細胞疲弊の分子機構
老化すると、Trlが制御する遺伝子(ced-6など)領域の染色体構造が閉鎖し、それらの遺伝子発現が低下することで、幹細胞は疲弊する方向に向かう。
今後の期待
本研究成果の意義は、ショウジョウバエの腸幹細胞というモデルを用いて、老化に伴って起こる幹細胞疲弊の分子機構を明らかにしたことです。今回発見した染色体構造と遺伝子発現の変化を伴う分子機構が、ヒトの老化時の組織幹細胞の疲弊にも関わっているのかを明らかにすることが今後の課題です。
補足説明
- 1.ショウジョウバエ
さまざまな研究分野でよく使用されるモデル生物であり、体長2~3mm前後の大きさで、飼育が容易であり、遺伝学的な解析に優れている。 - 2.組織幹細胞
臓器や組織にもともと存在する未分化細胞。臓器や組織の細胞が失われた時に、新しく細胞を補充する能力を持つ。 - 3.幹細胞疲弊
組織幹細胞の数が減少したり、再生能力が低下したりする現象。過剰な細胞分裂の結果や、細胞分裂とは無関係に生じると考えられている。本稿では、stem cell exhaustionの訳語としてこれを用いる。 - 4.染色体
DNAとタンパク質が複合した構造で、細胞内で遺伝情報を保持し、細胞分裂の際に分配される。 - 5.遺伝子
遺伝情報を持つDNAの特定の部分で、生物の形質や機能を決定する。 - 6.Trl
ショウジョウバエのTrithorax-like遺伝子がコードする転写因子([9]参照)。DNAのGAGAG配列を認識して結合するGAGAファクターの一種。 - 7.ATAC-seq
染色体の構造が、開いているか閉じているかを判別する手法。染色体構造が開いていればその領域の遺伝子が発現しやすく、逆に閉じていれば遺伝子発現しにくい。 - 8.RNA-seq
遺伝子が発現(転写)されてできるmRNAの量を定量することで、遺伝子の発現量を解析する手法。 - 9.転写因子
DNAに結合して特定の遺伝子の発現を促進したり抑制したりするタンパク質。 - 10.ced-6
ced-6がコードするタンパク質は免疫系の細胞で細胞貪食を制御することが知られているが、腸幹細胞でどのような機能を持っているのかは未知な点が多い。 - 11.RNAi法
特定の遺伝子の発現を抑制する技術。RNA干渉法ともいう。小さな2本鎖RNA(small interference RNA:siRNA)が細胞内で標的mRNAと結合し、そのmRNAを分解することで、特定の遺伝子の発現を抑制する。RNAiはRNA interferenceの略。
研究チーム
理化学研究所 生命機能科学研究センター 動的恒常性研究チーム
チームリーダー ユ・サガン(Sa Kan Yoo)
(理研 開拓研究本部 Yoo生理遺伝学研究室 主任研究員)
特別研究員 内藤 早紀(ナイトウ・サキ)
特別研究員(研究当時)シヴァクシ・スレク(Shivakshi Sulekh)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究、開拓研究)で実施し、日本医療研究開発機構(AMED)革新的先端研究開発支援事業(PRIME)「全ライフコースを対象とした個体の機能低下機構の解明」研究開発領域における研究開発課題「老化の遺伝学的・非遺伝学的分子基盤の解明(研究代表者:兪史幹)」、日本学術振興会(JSPS)科学研究費助成事業若手研究(A)「個体レベルでの物理的損傷に対する応答・修復メカニズムの解明(研究代表者:兪史幹)」、同基盤研究(B)「老化中の恒常性破綻機構の解明(研究代表者:兪史幹)」、科学技術振興機構(JST)創発的研究支援事業「エレボーシスを切り口とした腸恒常性維持機構の解明(研究代表者:兪史幹)」による助成を受けて行われました。
原論文情報
- Saki Naito, Shivakshi Sulekh, Sa Kan Yoo, "Insidious chromatin change with a propensity to exhaust intestinal stem cells during aging", iScience, 10.1016/j.isci.2024.110793
発表者
理化学研究所
生命機能科学研究センター 動的恒常性研究チーム
チームリーダー ユ・サガン(Sa Kan Yoo)
(理研 開拓研究本部 Yoo生理遺伝学研究室 主任研究員)
特別研究員 内藤 早紀(ナイトウ・サキ)
 内藤 早紀(左)、ユ・サガン(右)
内藤 早紀(左)、ユ・サガン(右)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
