理化学研究所(理研)生命医科学研究センター 免疫転写制御研究チームの谷内 一郎 チームリーダー、情報・システム研究機構 国立遺伝学研究所 分子細胞工学研究室の鐘巻 将人 教授らの共同研究グループは、生体内で標的とするタンパク質を分解する新たな技術を開発しました。
本研究成果は、研究対象のタンパク質を効率よく迅速に生体内から欠乏させる新しい生物学の実験手法として広く用いられることだけでなく、抗体医薬や分子標的薬など特定のタンパク質を標的とした薬剤の薬効を生体内で再現できることから創薬研究にも貢献することが期待されます。
近年、細胞内のタンパク質分解機構を利用して標的タンパク質を分解する技術が次々と開発されていますが、ほとんどは培養細胞など生体外での応用にとどまっていました。今回、共同研究グループは標的タンパク質分解技術を生体内(マウス)で応用することに成功しました。この技術を用いれば、脳を含むさまざまな組織で標的のタンパク質を迅速に分解することができ、胎児や新生児の体内でも標的のタンパク質を分解可能なことを示しました。
本研究は、科学雑誌『Nature Communications』オンライン版(11月29日付:日本時間11月29日)に掲載されました。
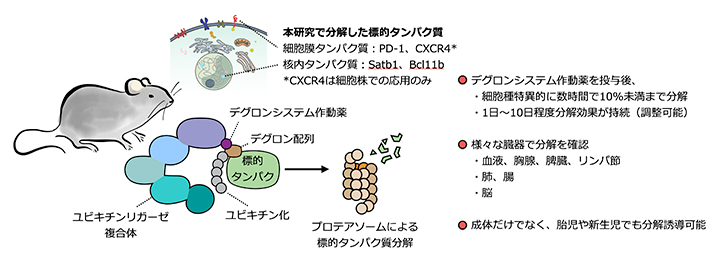
マウスでの生体内標的タンパク質分解技術の概要と特徴
背景
ある遺伝子の機能を研究する際に、その遺伝子が存在しない状態を作り出してその影響を調べる研究手法は、遺伝子ノックアウトを代表として多くの研究で行われてきました。一方で近年、研究対象の遺伝子から作られるタンパク質自体を細胞や生体から除去するという研究手法の有用性が明らかになってきました。
細胞内では、不要になったタンパク質にユビキチンという小さなタンパク質を付加し(ユビキチン化)、ユビキチン化されたタンパク質をプロテアソームという細胞内のタンパク質を分解する機構で速やかに除去する仕組みがあります。ユビキチン化を媒介する酵素であるユビキチンリガーゼ複合体の特異性を調整して、標的とするタンパク質のユビキチン化を誘導し、標的タンパク質を分解する技術を標的タンパク質分解技術と呼びます。中でもデグロン配列[1]を用いた標的タンパク質分解技術は汎用(はんよう)性が高いことが知られています。デグロン配列とは、デグロンシステムの作動薬(リガンド[2])の存在下でユビキチンリガーゼ複合体に認識され、ユビキチン化を受ける短いペプチド配列であり、標的タンパク質に融合させることで作動薬の投与により標的タンパク質の分解を誘導します(図1)。
近年、さまざまなタイプの標的タンパク質分解技術が開発されていますが、ほとんどは培養細胞などの生体外での応用にとどまっていました。生体内で、標的タンパク質分解を自由に誘導することができれば、より生理的な条件下で標的タンパク質の機能を明らかにすることになり、例えば創薬研究へ応用することが期待されていました。
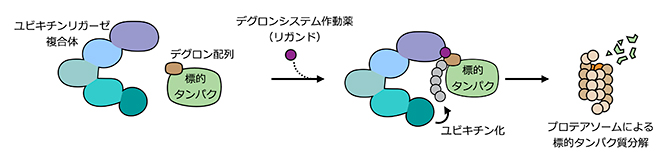
図1 デグロンシステムによる標的タンパク質分解技術の概要
デグロン配列を使った標的タンパク質分解技術。ユビキチンリガーゼ複合体に認識され、ユビキチン化を受けるペプチド配列である「デグロン配列」を標的のタンパク質に融合させた上で、デグロンシステム作動薬(リガンド)を投与すると、ユビキチンリガーゼ複合体によってデグロン配列がユビキチン化される。その結果、プロテアソームで標的タンパク質が分解される。
研究手法と成果
本研究ではマウスをモデル生物としてデグロンシステムを用いた生体内標的タンパク質分解技術の開発を行いました。まず、細胞種特異的なユビキチンリガーゼの発現をコントロールするため、マウス以外の生物由来のユビキチンリガーゼ複合体の構成分子(ヒト由来のhCRBN遺伝子、イネ科植物由来のOsTIR1遺伝子)をマウスゲノムに導入し、二つのマウス系統を樹立しました(図2左)。この際、共同研究グループはCre-LoxPシステム[3]を使って、細胞の種類を選んでこれらの遺伝子の発現が誘導できるように工夫しました。
次に生体内標的タンパク質分解技術の標的タンパク質として核内に存在するSatb1というゲノムオーガナイザー[4]を選びました。Satb1はすでに先行研究でVenus(緑色の蛍光タンパク質)が付加された遺伝子改変マウスが作製されており、Venusの蛍光を検出することで、タンパク質分解技術によって細胞内でのSatb1分解の動態(分解や回復の速さ、分解の程度)を簡単に検出することができます。マウスゲノムのSatb1遺伝子座に、hCRBNによって認識されるSALL 4デグロン配列(S4D)、OsTIR1によって認識されるオーキシンデグロン配列(mAID)を導入し、これらの融合タンパク質を発現する二つのマウス系統を作製しました(図2右)。
デグロンシステムを稼働し、標的タンパク質の分解を誘導するために、hCRBN-S4D系を持つマウスには免疫調節薬としても知られるサリドマイド誘導体のポマリドミドを、OsTIR1-AID2(mAID)系を持つマウスには植物ホルモンであるオーキシン誘導体の5-Ph-IAAを腹腔(ふくくう)内投与(注射)しました。これらポマリドミドや5-Ph-IAAといったリガンドの投与後に、数時間以内に標的タンパク質であるSatb1の分解が起きていることが確認できました。
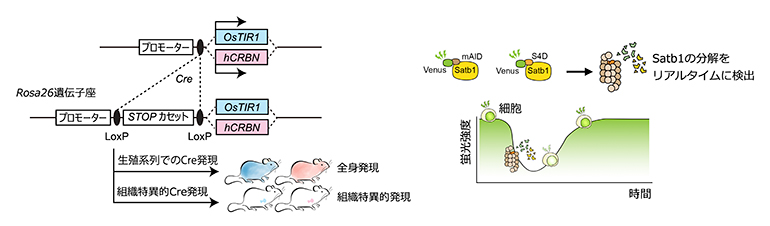
図2 細胞種特異的ユビキチンリガーゼ複合体の形成と標的タンパク質へのデグロン配列の付加
- (左)ユビキチンリガーゼ複合体の構成分子(ヒト由来のhCRBN遺伝子とイネ由来のOsTIR1遺伝子)をマウスゲノムに導入し、二つのマウス系統を作製した。Cre-LoxPシステムを使って、細胞種を選んでこれらの遺伝子の発現を誘導できるようにした。
- (右)マウスゲノムのSatb1遺伝子座に、hCRBNによって認識されるSALL 4デグロン配列(S4D)、OsTIR1によって認識されるオーキシンデグロン配列(mAID)を導入し、これらの融合タンパク質を発現する二つのマウス系統を作製した。S4DとmAIDはSatb1Venus(Satb1にVenus(蛍光タンパク質)が融合されたタンパク質)へのデグロンタグとなる。Venusの蛍光強度を測定することで、細胞中のSatb1の量を定量できる。
hCRBN-S4D系、OsTIR1-AID2系ともに、血液に加えて、胸腺、脾臓(ひぞう)、リンパ節、肺、腸管、脳といったさまざまな臓器でSatb1の分解が誘導できることが分かりました(図3A)。
また、胎児や新生児マウスに腹腔内投与でリガンドを投与することは困難ですが、妊娠中の母マウス、授乳中の母マウスにリガンドを腹腔内投与することで、胎児や新生児マウスにおいてもSatb1の分解が誘導できることが分かりました。
本研究ではリガンドを1回腹腔内投与した後に、血液のT細胞(リンパ球)におけるSatb1のタンパク質量を、時間を追って計測しました。hCRBN-S4D系、OsTIR1-AID2系のどちらのシステムでも、リガンド投与後数時間でSatb1のタンパク質量は元のレベルの10%ほどまで減ることが判明しました(図3B)。OsTIR1-AID2系では3日ほどかけて元のレベルにまで回復し、hCRBN-S4D系では薬剤を溶解する溶媒を変えることで、24時間で元のレベルまで回復させることや、10日以上分解状態を維持できることも明らかになりました。
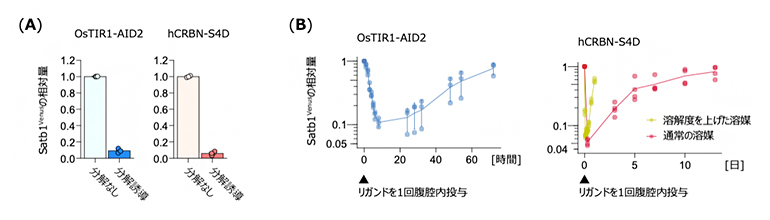
図3 胸腺細胞でのSatb1の分解と血液T細胞のSatb1タンパク質レベルの推移
- (A)OsTIR1-AID2系、hCRBN-S4D系ともに、標的タンパク質Satb1を分解誘導できる。グラフは胸腺細胞における分解誘導前後でのSatb1のタンパク量。
- (B)OsTIR1-AID2系、hCRBN-S4D系ともに、リガンド投与後数時間で血液のT細胞におけるSatb1のタンパク質量は元のレベルの10%ほどに減った。OsTIR1-AID2系では3日ほどで元のレベルまで回復する。hCRBN-S4D系では、(1)薬剤を溶解する溶媒に変えると24時間で元のレベルに回復する(2)通常の溶媒では分解が10日以上継続する。
hCRBN-S4D系、OsTIR1-AID2系ともに、標的タンパク質以外のタンパク質が分解されていないかを評価するために、リガンド投与後の胸腺を用いてタンパク質の発現を網羅的に解析できるプロテオミクス解析を行いました。hCRBN-S4D系では標的タンパク質のSatb1以外にもS4Dとの分子間の類似性を持つタンパク質の分解が起きていることが確認されました。一方で、OsTIR1-AID2系では標的タンパク質以外に分解されるタンパク質はほとんどなく、基質特異性(特定の物質にしか作用しない性質)が高いことが分かりました。
Satb1の分解後に、どのくらいの時間が経過するとSatb1遺伝子ノックアウトと同じ影響が出てくるのかをFoxp3遺伝子[5]の発現を指標として評価しました。その結果、1日間Satb1を欠乏させただけでFoxp3遺伝子の発現誘導が見られました。このように、生体内標的タンパク質分解技術を用いることで、研究対象のタンパク質を欠乏させたときにどのくらいの時間で、その影響が遺伝子発現に見られるのかということを観察できるようになりました。
また、本研究ではがん治療にも用いられる免疫チェックポイント阻害薬の標的分子であるPD-1のような細胞膜タンパク質も分解できることを確認しました。PD-1は細胞表面上に発現し、腫瘍細胞や抗原提示細胞が発現するPD-L1、PD-L2が結合すると免疫応答が抑制されることが知られており、抗PD-1抗体はこのPD-1を介した免疫抑制作用を解除することでがんに対する免疫応答を増強します。OsTIR1-AID2系で血球細胞においてPD-1を分解誘導できるようにしたマウスに腫瘍細胞を移植した後、PD-1を分解するとT細胞が活性化し抗腫瘍免疫が増強していました(図4)。さらにCD8+ T細胞(細胞障害性T細胞)特異的にPD-1を分解したところ、血球細胞におけるPD-1分解と同様の抗腫瘍効果を示しました。この結果から、抗PD-1抗体治療の主なターゲットはCD8+ T細胞であることを確かめることができました。抗体や分子標的薬は作用する細胞の選択性がありませんが、本研究で開発したデグロン技術を用いた生体内標的タンパク質分解法は、特定の細胞でのみ標的タンパク質を分解することができることが特長の一つです。
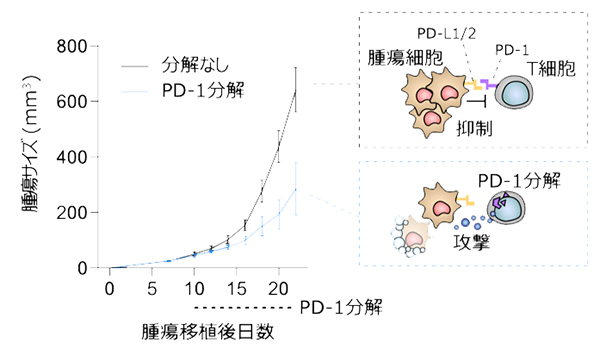
図4 OsTIR1-AID2系でのPD-1分解による抗腫瘍免疫の増強
OsTIR1-AID2系で血球細胞においてPD-1を分解誘導できるようにしたマウスに腫瘍細胞を移植した後、PD-1を分解すると、分解なしの場合と比べ、腫瘍サイズが小さくなっていた。PD-1を分解すると、T細胞が活性化し抗腫瘍免疫が増強していたことが分かった。
さらに、本研究ではT細胞分化をつかさどる転写因子であるBcl11bを分解して早期にどのような影響が出るかを調べました。これまでの遺伝子改変マウスを用いた研究から、Bcl11bを欠損すると初期T細胞分化が妨げられることが分かっていました。例えばBcl11bを欠損すると、T細胞分化はDN2[6]と呼ばれる分化段階で止まってしまい、それ以降の分化段階でのBcl11bの機能を調べることは困難でした。本研究で開発したデグロン技術を用いた生体内標的タンパク質分解法を用いることで、DN2以降の分化段階にある細胞で後天的にBcl11bを欠乏させることで、DN2以降の胸腺細胞の分化にもBcl11bが必要であることが分かりました。
また、Bcl11bは2型自然リンパ球(Group 2 innate lymphoid cell、ILC2)の分化に必要であることも知られています。ILC2が分化する胎児期に短期間Bcl11bを欠乏させることで乳児期の肺のILC2の数が減ることが分かりました。これは胎児期のBcl11b発現が肺のILC2の産生に必要であることを示しています。このように、特定の発生ステージにおいて一時的にBcl11bを欠乏させ、その後発現量を回復させることで特定の発生ステージにおけるBcl11bの機能に注目した解析をすることができました。これらは、既存の研究手法では解明できなかったタンパク質の機能を、生体内標的タンパク質分解技術を用いて明らかにすることができた例です。
今後の期待
本研究で開発した生体内標的タンパク質分解技術は、研究対象のタンパク質を細胞の種類を限定して、欠乏させるタイミングと期間を自由に制御できる技術としての特長を持ち、幅広い生物学研究、医学研究、創薬研究に応用できます。
生体内で研究対象のタンパク質を欠損させるアプローチとしては遺伝子ノックアウトが最も広く用いられてきましたが、観察された事象が標的の遺伝子をノックアウトしたことによる直接的な影響なのか、二次的な影響なのかを区別することは原理的に困難でした。標的遺伝子のノックアウトで細胞の分化障害を生じてしまうような場合は、それ以降の分化段階にある細胞が得られず、これら細胞での遺伝子の働きを捉えるのは困難でした。
生体内標的タンパク質分解技術を用いれば、標的タンパク質分解後数時間での解析が可能であり、標的タンパク質の欠損によって生じる直接的な変化を捉えることができます。このような短時間では細胞の分化障害は生じず、目的の細胞群での標的タンパク質の働きを調べることができます。標的タンパク質の分解は一過性であることから、特定のタイミング(胎児期、新生児期などの発生段階のタイミングや感染症罹患時、薬剤投与時、腫瘍移植時などの実験的な介入のタイミング)で標的タンパク質を分解し、その後タンパク質発現を回復させることで、さまざまなタイミングや状況での標的タンパク質の働きを明らかにすることが容易になります。
この技術は創薬研究にも応用できると期待できます。抗体医薬や分子標的療法(阻害薬)の治療のターゲットとなり得る候補分子があるときに、その分子の阻害が治療的に有用かどうかを判断するのは困難です。生体内標的タンパク質分解技術を使えば、治療のターゲット候補分子にデグロン配列を付加し、マウスにおいて疾病状態を作り出した上で標的分子を分解してその治療効果を見ることで薬効や副作用を効率よく評価することができるようになると考えられます(図5)。
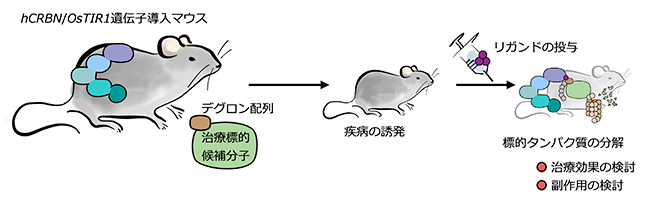
図5 創薬研究への生体内標的タンパク質分解技術の応用
hCRBN遺伝子、OsTIR1遺伝子導入マウスに対して、ゲノム編集によりデグロン配列を治療標的候補分子に付加する。その上で、疾病状態を作り出す。そのマウスにリガンドを投与し、治療標的候補分子を分解させる。分解による効果を見て、薬効や副作用などを評価できると考えられる。
補足説明
- 1.デグロン配列
標的タンパク質に融合する短いペプチドであり、リガンドに依存してユビキチン化を誘導する。ユビキチンリガーゼの種類によってリガンドやデグロン配列は異なる。デグロンという名称は英語の分解(デグラデーション)に由来する。 - 2.リガンド
機能タンパク質に特異的に結合する分子のこと。ここではデグロン配列と特定のユビキチンリガーゼ複合体に結合し、ユビキチンリガーゼによるデグロン配列のユビキチン化を誘導する小分子のことを指す。 - 3.Cre-LoxPシステム
Creリコンビナーゼ(組換え酵素)は、ゲノム上のLoxPという特定のDNA配列を認識し、組換え反応を起こす。この一連の反応により遺伝子改変するシステムをCre-LoxPシステムという。本研究ではプロモーターの下流にLoxP配列に挟まれたSTOPカセットを挿入しており、組み換えが起きていない段階ではその下流に位置するOsTIR1、hCRBN各遺伝子は発現しない。組織特異的プロモーターによりCreリコンビナーゼが発現すると組み換えが起こり、STOPカセットが切り出されOsTIR1、hCRBN各遺伝子が発現するようになる。また、Creリコンビナーゼを生殖系列で発現させると、全身でOsTIR1、hCRBN各遺伝子を発現させることができる。 - 4.ゲノムオーガナイザー
ゲノムDNAの3次元構造やエピゲノム(遺伝子の発現を調節する可逆的な化学修飾)の調節を通じて特定の遺伝子の発現を制御する分子のこと。 - 5.Foxp3遺伝子
T細胞のうち、免疫を抑制する機能を担う制御性T細胞の分化や機能において必須の役割を果たす転写因子のこと。Satb1を欠損するマウスではT細胞においてFoxp3遺伝子発現の抑制が解除され、本来Foxp3遺伝子が発現していない細胞でもFoxp3遺伝子が発現する。 - 6.DN2
胸腺におけるT細胞初期分化段階の一つで、Double negative(DN)1→DN2→DN3→DN4→Double positive(DP)の順に分化が進む。
共同研究グループ
理化学研究所 生命医科学研究センター
免疫転写制御研究チーム
チームリーダー 谷内 一郎(タニウチ・イチロウ)
基礎科学特別研究員 山下 基(ヤマシタ・モトイ)
研究員 小川 ちひろ(オガワ・チヒロ)
特別研究員(研究当時)アニラ・ノムラ(Aneela Nomura)
特別研究員(研究当時)チェンチェン・ゾウ(Chengcheng Zou)
粘膜免疫研究チーム
上級研究員 章 白浩(ショウ・ヒャクコウ)
チームリーダー シドニア・ファガラサン(Sidonia Fagarasan)
自然免疫システム研究チーム
副チームリーダー 小林 哲郎(コバヤシ・テツロウ)
チームリーダー 茂呂 和世(モロ・カズヨ)
統合ゲノミクス研究チーム
テクニカルスタッフⅠ クライブ・バーカー(Clive Barker)
チームリーダー 清田 純(セイタ・ジュン)
プロテオーム恒常性研究ユニット
ユニットリーダー 今見 考志(イマミ・コウシ)
開拓研究本部 眞貝細胞記憶研究室
主任研究員 眞貝 洋一(シンカイ・ヨウイチ)
環境資源科学研究センター 創薬化学基盤ユニット
上級研究員 白井 文幸(シライ・フミユキ)
愛媛大学 プロテオサイエンスセンター 無細胞生命科学部門
特定助教 山中 聡士(ヤマナカ・サトシ)
教授 澤崎 達也(サワサキ・タツヤ)
岡山理科大学 理学部生物化学科 生物分子化学研究室
教授 林 謙一郎(ハヤシ・ケンイチロウ)
情報・システム研究機構 国立遺伝学研究所 分子細胞工学研究室
教授 鐘巻 将人(カネマキ・マサト)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業新学術領域研究「血球系細胞分化過程での非ゲノム情報複製機構の解明(研究代表者:谷内一郎)」、同基盤研究(A)「細胞及び動物個体で迅速タンパク質分解を可能にするAID2法の発展的基盤技術の開発(研究代表者:鐘巻将人)」、同学術変革領域研究(A)「オーキシンデグロン法によるタンパク質寿命操作(研究代表者:鐘巻将人)」「タンパク質寿命の大規模計測技術と寿命制御原理(研究代表者:石濱泰)」、科学技術振興機構(JST)戦略的創造研究推進事業CREST「動原体超分子複合体の構造ダイナミクス(研究代表者:深川竜郎)」、武田科学振興財団医学系研究助成による助成を受けて行われました。
原論文情報
- Motoi Yamashita, Chihiro Ogawa, Baihao Zhang, Tetsuro Kobayashi, Aneela Nomura, Clive Barker, Chengcheng Zou, Satoshi Yamanaka, Ken-ichiro Hayashi, Yoichi Shinkai, Kazuyo Moro, Sidonia Fargarasan, Koshi Imami, Jun Seita, Fumiyuki Shirai, Tatsuya Sawasaki, Masato T. Kanemaki, and Ichiro Taniuchi, "Cell-type specific, inducible and acute degradation of targeted protein in mice by two degron systems.", Nature Communications, 10.1038/s41467-024-54308-9
発表者
理化学研究所
生命医科学研究センター 免疫転写制御研究チーム
チームリーダー 谷内 一郎(タニウチ・イチロウ)
 谷内 一郎
谷内 一郎
情報・システム研究機構 国立遺伝学研究所 分子細胞工学研究室
教授 鐘巻 将人(カネマキ・マサト)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
情報・システム研究機構 国立遺伝学研究所 広報室
Email: prkoho [at] nig.ac.jp
※上記の[at]は@に置き換えてください。
