理化学研究所(理研)生命機能科学研究センター 先端バイオイメージング研究チームの渡邉 朋信 チームリーダー(広島大学 原爆放射線医科学研究所 教授)、広島大学 原爆放射線医科学研究所の藤田 英明 助教らの共同研究チームは、非線形光散乱現象を魚肉の鮮度評価に応用し、マグロが熟成する過程における筋肉分解の進み具合を定量化する新技術を開発しました。魚肉に直接触れることなくレーザー光を当て、歯応えなどの食感(粘性や弾性)を非接触で評価できます。
本研究成果は、世界に広がる寿司や刺身など魚の生食文化の発展に向けて、鮮魚の安全検査や冷蔵保管時の品質検査の基盤技術になり得ると期待されます。
食用魚は低温下一定時間寝かせて熟成することでイノシン酸などのうま味成分が増すことが知られ、これらうま味成分を計測する方法は多々存在しています。一方で、鮮魚のおいしさはうま味成分のみで決まらず、歯応えなどの食感も重要な要素です。食感は熟成する過程において、肉身を構成する筋肉の分解の進み具合が大きく影響しています。
今回、共同研究チームは非線形光学現象[1]の一つである光第二高調波発生(SHG)を応用した偏光顕微鏡[1]を用いて、解凍後のマグロの切り身の熟成過程における筋肉分解を、定量化しました。その結果、解凍後72時間までに少なくとも三つの筋肉分解プロセスが存在することを発見しました。これは、鮮魚の低温保管下における筋肉分解を非接触、非侵襲で直接評価した初めての実験例です。
本研究は、科学雑誌『Journal of Food Engineering』2025年5月号掲載に先立ちオンライン(2024年12月7日付)で掲載されました。
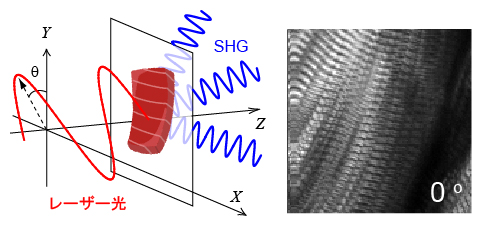
切り身にレーザー光を当て、発生した散乱光(SHG光)で筋繊維の状態を観察
背景
生魚を食すると、必須アミノ酸、不飽和脂肪酸、DHA、脂溶性ビタミンなどの栄養素を摂取できます。昨今の日本食ブームに伴い、世界で魚の生食が広がっています。魚肉は、低温下一定時間寝かせて熟成することでうま味成分が増しますが、非常に傷みやすく、腐敗に伴う栄養価の低下や、細菌・寄生虫の増殖による食中毒リスクを引き起こします。生魚をおいしく、安全に食するためには、鮮度評価が欠かせません。
物理化学に基づく魚肉の鮮度評価技術は100年以上の歴史を持ち、外観や臭い、食感などの物理化学的特徴を基にした侵襲的な方法が主流となっています。これらは測定時間が長く、結果が測定者の技術に依存しやすいという課題がありました。そこで近年では、非接触で非破壊的な評価方法が注目されています。特に光学分光法[2]は、魚組織の色や透明性などの物理化学的状態を反映するため有効とされています。例えば、分光データ(色の詳細な情報)から、うま味成分の計測を基にした鮮度指標であるK値[3]を推定することも可能です。さらに、コンピュータの深層学習[4]技術の導入も進んでおり、魚の目の透明度や色の変化を基にした鮮度評価が試みられています。しかし現状の深層学習では、単に活け締め後の経過時間を鮮度として学習させており、評価基準の科学的根拠が不十分な可能性があります。また、切り身を対象とした深層学習アプローチは実用化が進んでいません。
一方で、魚肉は主に筋肉で構成されているため、活け締め後の時間経過に伴う筋肉の分解が食感に大きく関わっています。しかし食感の評価には、検査器を物理的に接触させる必要であり、非接触評価は難しいとされていました。
共同研究チームはこの課題を解決するため、以前に開発した二次高調波発生(SHG)偏光顕微鏡を、魚肉の筋肉分解の過程を定量化するために流用することを試みました。SHG偏光顕微鏡は、筋繊維[5]やコラーゲン[6]のような構造的に偏りのある物質内で特殊な散乱光(SHG光)を発生させます。繊維構造が変化すると観察されるSHG光も変化することを利用し、渡邉チームリーダーらは生きた心筋の活性を非接触で定量する技術の開発に成功しています注1)。心筋細胞内の筋繊維の構造の違いを定量できるのであれば、魚肉の筋肉分解(繊維構造の変化)も定量できるはずです。今回共同研究チームは、SHG偏光顕微鏡を用いて、冷蔵保存中のキハダマグロの切り身の筋肉やコラーゲンの分解プロセスを非接触で解析する手法の確立に挑戦しました。
- 注1)2023年5月26日プレスリリース「個体を傷付けず、生きた心筋活性を光で定量」
研究手法と成果
新鮮な冷凍キハダマグロのさくを入手し、凍結状態のまま八つのブロックにカットしました。このマグロのブロックに対して、飲食店で提供されるマグロと同じ手順で解凍した後に、4℃条件下に静置(チルド冷蔵)しました。静置後、0、12、24、48、72時間で、サンプリングを行いました(図1)。外見上は、解凍後24時間で赤味が増加しており、72時間かけて水分が少しずつ減少していった印象が見受けられます。
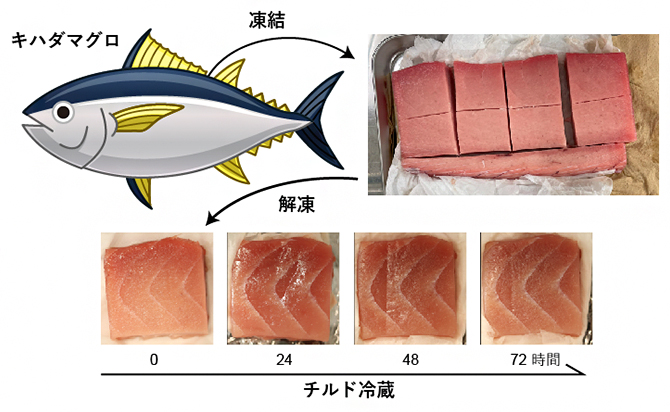
図1 キハダマグロの冷蔵熟成
飲食店で提供されるキハダマグロと同じ手順で解凍したサンプル調製。-80℃で冷凍したマグロをブロックに切り分け、実験の前日に-30℃の冷凍庫に移す。実験当日に4℃の食塩水で20秒間すすぎ、4℃で30分間保管したものを「解凍後0時間」とし、その後4℃で72時間までチルド冷蔵した。
ブロックからさらに切り出した小さな切り身に対して、レーザー光をさまざまな偏光角度で照射しました。照射光は切り身内の筋肉分子と相互作用して散乱光になります。この散乱光から非線形成分であるSHG光を抽出します。切り身内でSHG光を発生する源は、主に、筋繊維とコラーゲン繊維です。解凍直後のマグロの切り身でSHG光を観察すると、筋繊維の特徴でもある周期構造(サルコメア構造[5])が明瞭に映し出されていました(図2)。また、照射したレーザーの偏光角度を変えると、SHG光の強度が変化することも観察されました。SHG光の強度がレーザー光の偏光角度に依存して変化する現象は、観察対象内に異なる繊維構造が複数存在していることを意味します。この場合は筋繊維とコラーゲン繊維の構造の違いを反映していると考えられるため、偏光依存性を定量化することで、筋肉の分解の仕組みに関する情報(筋繊維とコラーゲン繊維の存在比)が得られます。
最初に、筋繊維構造の時間変化を評価するため、全ての偏光角度でのSHG光を足し合わせた信号強度での画像を比較しました。解凍後12時間でSHG光強度は大きく低下し、24時間後にはさらに10分の1程度まで減少していました(図2左)。SHG光強度は信号源の密度に依存するので、この結果は筋肉の分解を反映していると考えられます。一方、画像処理により暗部の明るさを補正すると、24時間後でもサルコメア構造は残っていることが分かりました(図2右)。これは、筋肉の周期構造は保たれながらも、繊維がほどけていることを示しています。24時間から48時間にかけて、大きな裂け目(図2右矢印)が観察されたり、サルコメア構造がぼやけたりしている切り身もあり、いよいよ、筋肉の繊維構造が崩れ出していることが分かります。72時間後には、多くの切り身でサルコメア構造はもはや観察できず、細い繊維のみが観察されます。これは大部分がコラーゲン繊維であると考えられます。すなわちSHG光強度の解析からは、筋肉分解は3段階で起こり、第2段階に安定期が存在していることが示唆されました。
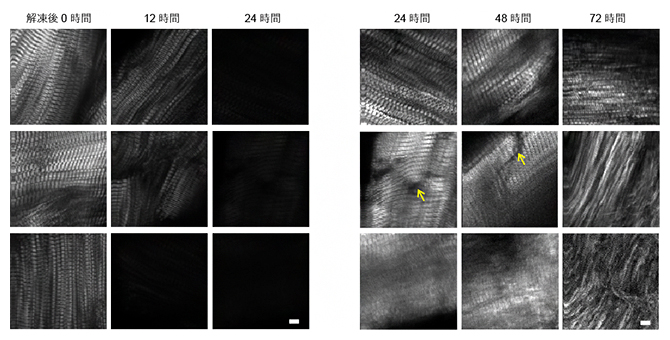
図2 冷凍熟成過程におけるマグロ切り身のSHG画像
- 左)解凍後0、12、24時間後のSHG偏光顕微鏡観察画像。静置後12時間でSHG光が大きく低下していることが分かる。スケールバーは5マイクロメートル(μm、1μmは100万分の1メートル)を示す。
- 右)解凍後24、48、72時間後のSHG偏光顕微鏡観察画像を画像処理し、繊維構造を見やすくしたもの。周期的なサルコメア構造が次第に消失し、最終的に細い繊維が残された。スケールバーは5μmを示す。
次に、偏光依存性についての解析を行いました。SHG光の偏光依存性を基にタンパク質の繊維構造を推定する先行研究では、筋繊維を構成するミオシン[5]と、コラーゲンの違いを見分けられることが報告されています。解凍0時間のブロックでサルコメア構造がよく観察される箇所を選んで解析すると、入射するレーザーの偏光角度(入射偏光角度)に依存してSHG光の強度が変化するグラフは、二つの山を持った形状を示しました(図3A左)。この二山形状は、ミオシンから発せられるSHG光の特徴とよく一致しており、SHG光がミオシンの構造由来であることを示しています。一方で、解凍72時間後のブロックで細い繊維のみが観察される箇所を選んで解析すると、入射偏光角度依存性のグラフは、すり鉢状の形状を示しました(図3A右)。これは、コラーゲンから発せられるSHG光の特徴とよく一致しています。解凍後72時間にサルコメア構造が失われたブロックで観察された繊維(図2右)が、コラーゲンであることを傍証する結果です。
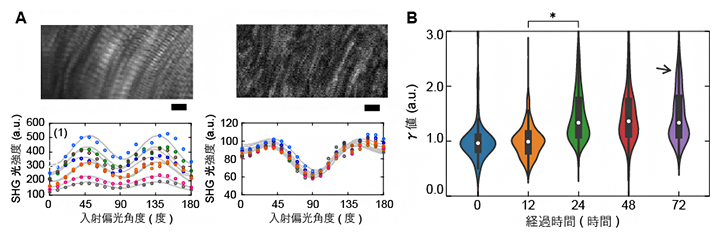
図3 マグロ切り身におけるSHG光強度の入射偏光角度依存性
- (A)入射するレーザーの偏光角度(横軸)に対する、SHG光の相対的な強度(縦軸)をプロットし、入射偏光角度依存性のグラフを作図した。
- 左)解凍0時間後のサンプルで見られる明瞭なサルコメア構造と、その領域の入射偏光角度依存性。グラフは二山形状を示した。
- 右)解凍72時間後のサンプルで見られる細い繊維と、その領域の入射偏光角度依存性。グラフはすり鉢状の形状を示した。スケールバーはいずれも5μm。
- (B)SHG光強度の入射偏光角度依存性の時間経過のグラフを作図した。
入射偏光角度依存性を示すグラフの形状を近似的に求める数式から、グラフの形状はパラメータγの値のみで決まることが分かっている。γ値(縦軸)は解凍後の時間経過とともに高くなっていた。アステリスク(*)は、経過12時間と24時間の比較で有意差があることを、矢印は経過72時間で高いγ値を示す集団が増加していることをそれぞれ示す。
図3Aで示した二山形状グラフとすり鉢形状グラフは、同じ数式で近似することができ、パラメータγのみで形状が決定されることが先行研究で示されています注2)。そこで、グラフの形状が二山形からすり鉢形に変わるまでの間のγ値の時間経過をグラフ化してみると、解凍後12時間までは変化がなく、12時間後から24時間後にかけて増加し、その後、大きく変化していないことが分かりました(図3B)。γ値の増加は、筋繊維に対するコラーゲンの比率の上昇を反映していることから、12時間後から24時間後にかけて筋繊維の分解が進み、コラーゲンの含有比率が増加したと考えられます。解凍後72時間後には、高いγ値を示す集団が増加しており(図3B矢印)、筋繊維がほぼなくなっている切り身が増えていることを示しています。
以上、SHG光の強度変化と偏光依存性の結果をまとめると、マグロ切り身の熟成過程においては3段階の筋肉分解プロセスが存在すると考えられます。①解凍後12時間までにタンパク質の分解が筋肉全体で始まりますが、筋肉の構造はそれほど変化しません。②次の12時間でサルコメア構造が急速に分解していきますが、24時間後から48時間後までいったん安定期に入ります。③そして48時間後から72時間後までの間に筋肉分解が徐々に再開し、やがてコラーゲン繊維を主とする組織となります。
今回得られたSHG光による鮮度評価の結果と従来の食品検査法を用いた評価結果と比較したところ、鮮度の指標であるK値は解凍後48時間で大きく増加し、並行してタンパク質量が減少していることから、解凍後48時間で鮮度が低下していることが示されました。前述した段階②において、筋肉分解は解凍後24時間から48時間の間は安定していることを示しましたが、鮮度低下に関わる生化学的な反応は、まさにこの24時間の間に行われていると考えられます。また歯応えの指標とされる弾性力についても、従来法で計測しましたが、こちらは、弾性力を計測するためのプローブ(サンプルと接する部分)の形状(歯形状プローブと5mmシリンダープローブ)により異なる結果が得られ、歯形状プローブでは時間経過とともに弾性力が減少したのに対し、シリンダープローブでは増加していました。すなわち、解凍後、歯で感じる弾性は減少し、舌で感じる弾性が増加することを示唆していると解釈されています。
食べごろは、人によって異なります。プリプリとした弾力のある食感が好みの場合には、筋肉構造の変化が少ない段階①(解凍後12時間内)が食べごろとなります。段階②は、イノシン酸が産生されており、かつ、筋肉分解も安定しています。解凍後48時間後にはK値が増加し鮮度の劣化が始まりますが、筋肉分解にとっては24時間という長期間の安定期になります。すなわち、段階②(解凍後24~48時間)は、柔らかい歯応えとうま味を安定して感じられる食べごろだといえます。段階③になると筋肉分解が進みコラーゲンの食感を強く感じるようになります。いわゆる「筋張った食感」です。K値も大きく増加しており、段階③はもはや食べごろを過ぎています。しかしながら、K値が増加する直前である解凍後48時間は、イノシン酸の産生量が飽和する時間帯でもあります。解凍後の時間を正確に制御できるのであれば、解凍後48時間は解けるような食感と強いうま味を感じられる「最もおいしい」食べごろだといえるかもしません。
- 注2)Tiaho, F., Recher, G., & Rouède, D. (2007) Estimation of helical angles of myosin and collagen by second harmonic generation imaging microscopy. Optics express, 15, 12286–12295.
今後の期待
これまでに報告された光を基盤とした鮮魚評価技術は、そのほとんどが光の吸収や、組織に由来する自家蛍光を指標としており、これらは魚種によって大きく異なることが知られています。今回開発された手法は、筋肉繊維のみから選択的に発せられるSHG光を指標としているため、適用する魚種を選びません。また、従来の食感に関わる指標とも異なり、微視的な構造変化に基づいて評価でき、新しい鮮魚の評価法となると期待されます。
魚肉は、切り身になってしまうと鮮度を見た目で推測することは難しく、目の前に出された寿司や刺身の鮮度は、私たち一般の消費者には簡単に判断できません。しかし近年は、レーザー装置や撮像素子の小型化が進んでおり、これらを統合したマイクロデバイスを開発できれば、今まさに食す刺身の鮮度を卓上で評価することも可能となるかもしれません。
本手法は、基礎科学における先端ツール(SHG偏光顕微鏡)の開発をきっかけとし、心筋細胞の筋活性評価という医学分野への応用から、今回は食品業界の課題に対する解決策に発展しました。基礎研究での技術開発や解析手法が社会実装につながる例の一つです。
補足説明
- 1.非線形光学現象、光第二高調波発生(SHG)を応用した偏光顕微鏡
非線形光学現象とは、物質に強い光が入射した際に、入射光と放出光の関係が非線形になる現象。光第二高調波発生とは、物質に強い光が入射したとき、散乱される光(SHG光)が入射した光の2倍のエネルギーを持つ非線形光学現象であり、光散乱現象の一つ。SHG光の発生には偏光依存性があり、入射光の偏光の向きによってSHG光の強度が変化する。SHG偏光顕微鏡はレーザー照射の偏光を制御してSHG光の強度変化を画像化する顕微鏡であり、生物学研究においては、コラーゲン、筋肉、微小管など、電気分極が非対称な繊維状物質を非染色かつ選択的に可視化する技術として利用されている。SHGはsecond harmonic generationの略。 - 2.光学分光法
光には通常、さまざまな波長が含まれている。光をプリズムに通したり回折格子に反射させたりすることで、波長ごとの成分に分けることを分光と呼び、これを応用して観察対象を分析する手法を光学分光法(分光法)と呼ぶ。 - 3.K値
魚の鮮度を示す値の一つ。K値とは、アデノシン三リン酸(ATP)の分解物(イノシン酸、イノシン、ヒポキサンチン)の総量がATP関連物質全体に占める割合を示す指標。K値が小さいほど鮮度が良好なことを示す。ATPは筋肉を動かすエネルギー源であり、筋肉組織に多く含まれる。 - 4.深層学習
多層のニューラルネットワークを用いた機械学習手法の一種。データ間の非自明な関係を非線形関数などでモデル化し、入出力データの関係を学習することで、分類や予測などを可能にする。 - 5.筋繊維、サルコメア構造、ミオシン
筋繊維は、筋肉を構成する繊維状の多核細胞。ミオシンは、筋肉を構成するタンパク質の一つで、筋肉の中では繊維を形成している。アデノシン三リン酸(ATP)を加水分解する際に産生されるエネルギーを利用して、もう一つの繊維(アクチン繊維)を引っ張ることで、力を発生させる。筋原繊維は、筋繊維を構成する幅約1μmの細長い円筒状の器官で、ミオシン繊維とアクチン繊維の束により構成される。サルコメア構造は、筋原繊維の長軸に沿う周期構造の単位の呼称で、単にサルコメアと呼ぶこともある。 - 6.コラーゲン
代表的な細胞外基質の一つで、脊椎動物では真皮や腱、筋間質などに見られる。
共同研究チーム
理化学研究所 生命機能科学研究センター 先端バイオイメージング研究チーム
チームリーダー 渡邉 朋信(ワタナベ・トモノブ)
(広島大学 原爆放射線医科学研究所 教授)
技師 前田 康大(マエダ・ヤスヒロ)
技師 塩井 剛(シオイ・ゴウ)
広島大学 原爆放射線医科学研究所
助教 藤田 英明(フジタ・ヒデアキ)
学部生 宮崎 夏帆(ミヤザキ・カホ)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、一部、理化学研究所-広島大学共同研究拠点で実施されました。基盤となったSHG偏光顕微鏡技術は、科学技術振興機構(JST)戦略的創造研究推進事業CREST「オールオプティカルメカノバイオロジーの創出に向けた技術開発と発生生物学への応用(研究代表者:倉永英里奈)」の研究過程において開発されました。
原論文情報
- Tomonobu M WATANABE, Yasuhiro MAEDA, Go SHIOI, Kaho MIYAZAKI, Hideaki FUJITA, "Optical evaluation of internal meat quality deterioration in a tuna fillet based on second-harmonic generation anisotropy measurement", Journal of Food Engineering, 10.1016/j.jfoodeng.2024.112422
発表者
理化学研究所
生命機能科学研究センター 先端バイオイメージング研究チーム
チームリーダー 渡邉 朋信(ワタナベ・トモノブ)
(広島大学 原爆放射線医科学研究所 教授)
広島大学 原爆放射線医科学研究所
助教 藤田 英明(フジタ・ヒデアキ)
 渡邉 朋信
渡邉 朋信
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
広島大学 広報室
Tel: 082-424-6762
Email: koho [at] office.hiroshima-u.ac.jp
※[at]は@に置き換えてください。
