理化学研究所(理研)生命医科学研究センター 炎症制御研究チーム(研究当時)の杉本 晶子 テクニカルスタッフⅠ(研究当時、現 感染免疫研究チーム テクニカルスタッフⅠ)、田中 貴志 チームリーダー(研究当時、現 免疫器官形成研究チーム 客員研究員)らの研究チームは、Fボックスタンパク質[1]の一つであるFbxo16が炎症反応を抑制することを発見しました。
本研究成果は、炎症性疾患や自己免疫疾患[2]の治療を目的とした、人為的な免疫制御法の開発に貢献すると期待されます。
炎症反応は感染早期の生体防御に重要な反応ですが、過剰になると炎症性疾患や自己免疫疾患を発症するため、生体は炎症が過剰にならないように抑制するシステムを備えています。田中チームリーダーらは、炎症反応に必須の核内転写因子[3]NF-κB[4]に結合し、これをユビキチン[5]化・分解することで炎症反応を抑制するPDLIM2[6]を同定し、その分子メカニズムを研究してきました。
今回、研究チームは、Fbxo16というタンパク質が、炎症反応を終息させる新たな分子であることを発見しました。Fbxo16は、PDLIM2と結合してユビキチンリガーゼ複合体を形成し、NF-κBをこの複合体に引き込むことによりNF-κBの分解を促進することで、より効率的に炎症反応を抑制していることが明らかになりました。
本研究は、科学雑誌『Frontiers in Immunology』オンライン版(6月3日付:日本時間6月3日)に掲載されました。
背景
細菌やウイルスなどの病原体に感染すると、まず樹状細胞[7]が細胞膜上のToll(トール)様受容体(TLR)[8]により病原体を認識して、細胞質内のNF-κBを活性化します。活性化したNF-κBは核内に移行し、炎症性サイトカイン[9]などの炎症反応に必要なさまざまな遺伝子を活性化させて炎症反応を誘導することにより、侵入した病原体と戦います。活性化した樹状細胞はどのような病原体に感染したのかをT細胞[10]に伝え、T細胞は侵入した病原体の種類に応じて「STAT4」および「STAT3」という転写因子STAT[11]を活性化して、それぞれTh1、Th17と呼ばれる異なった機能を持つ特殊なT細胞に分化することにより、効率よく病原体の排除を行います。つまり樹状細胞による炎症反応の発動には、核内の転写因子NF-κBの活性化が極めて重要です。
ところが、このNF-κBやSTAT4、STAT3が過剰に活性化して、免疫細胞が暴走する状態が続くと、炎症性疾患や自己免疫疾患を発症することが報告されています。このため、正常な免疫応答を保ちながらこれら疾患の発症を防ぐには、NF-κBやSTAT4、STAT3の活性をオンにするだけでなく、それを適切な時点でオフにするシステムが重要です。
2007年、田中チームリーダーらは核内タンパク質PDLIM2が、樹状細胞においてNF-κBの分解を誘導して炎症反応を抑制することを明らかにしました注1)。つまり、PDLIM2はNF-κBを選別して結合し、NF-κBにユビキチンという小さな分子を付加(ユビキチン化)します。ユビキチン化されたNF-κBは最終的にプロテアソーム[12]によって分解され、これにより炎症反応は終息します。また、PDLIM2はT細胞においては、STAT4、STAT3をユビキチン化して分解を誘導することによりTh1、Th17細胞の働きを抑制することも報告しました。田中チームリーダーらは、その後一貫して炎症反応を負に制御する分子メカニズムを研究し、樹状細胞における炎症反応の新たな制御因子の探索を行ってきました。
- 注1)2007年4月30日プレスリリース「炎症反応を制御する新たなメカニズムを解明」
研究手法と成果
PDLIM2のように標的タンパク質を選別し結合し、これにユビキチン分子を連結することにより、その標的タンパク質の分解を誘導するという役割を担う分子をユビキチンリガーゼといいます。ユビキチンリガーゼは多くの場合、単独ではなく他の分子と結合して複合体を形成することによりその機能を発揮します。
まず、研究チームはPDLIM2がどのような分子と複合体を形成するかを調べました。その結果、PDLIM2が、複合体の足場を担うCullin1というタンパク質とSkp1というアダプター分子[13]とともにユビキチンリガーゼ複合体を形成することを明らかにしました。
ユビキチンリガーゼ複合体においては、Fボックスタンパク質と呼ばれる分子も、複合体の構成分子として、ユビキチン化される基質タンパク質との結合を担うことが報告されています注2)。これまで60種類以上のFボックスタンパク質が同定されていますが、PDLIM2がどのFボックスタンパク質と結合するかは明らかにされていませんでした。そこで、PDLIM2とNF-κBの結合を仲介し、NF-κBの分解を促進する活性に基づいてFボックスタンパク質を調べたところ、Fbxo16というFボックスタンパク質が、樹状細胞でのPDLIM2によるNF-κBの分解に必須であることが分かりました。
次に、Fbxo16のNF-κBに対する作用を調べたところ、Fbxo16は、NF-κBと結合し、NF-κBのユビキチン化を促進して、プロテアソームによる分解に導くことでNF-κBの働きを抑制することが分かりました。また、Fbxo16を欠損させた樹状細胞をTLRが認識する細菌成分であるリポ多糖(LPS)[14]で刺激したときの炎症性サイトカインの産生量を測定したところ、コントロール(対照)の細胞と比べて2~3倍に増加しており、同時にNF-κBの分解も妨げられていました。さらに、Fbxo16とPDLIM2の両方を欠損させた樹状細胞においては、Fbxo16またはPDLIM2のみを欠損させた細胞と比べて、LPSで刺激したときの炎症性サイトカインの産生がさらに2倍増加していました。
こうしたことから、Fbxo16は、PDLIM2とともにユビキチンリガーゼ複合体を形成した上、NF-κBの受容体としてNF-κBをこの複合体に引き込んでNF-κBの分解を促進することで、より効率的に炎症反応を抑制していることが明らかになりました(図1)。
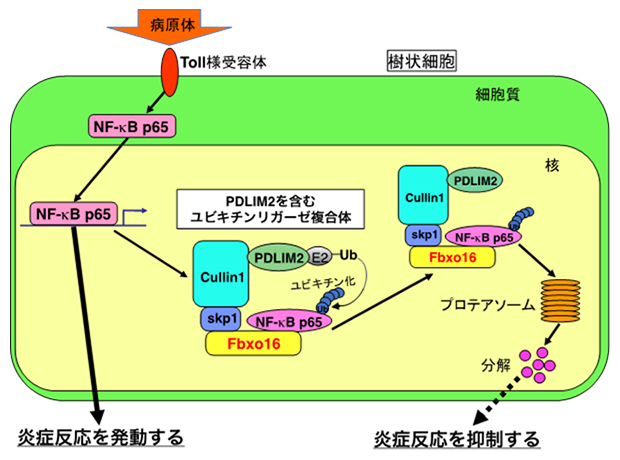
図1 Fbxo16およびPDLIM2による炎症反応制御機構
Fbxo16は、PDLIM2とともにユビキチンリガーゼ複合体を形成し、そのユビキチンリガーゼ複合体に、NF-κBを特異的に引き込み、プロテアソームにおいて分解を促進することで、より効率的に炎症反応を抑制している。E2はユビキチンリガーゼによる標的タンパク質へのユビキチン分子の付加を仲介する分子である。Ubはユビキチン。
一方、Fbxo16のSTAT4、STAT3に対する作用を調べたところ、Fbxo16はSTAT4、STAT3のユビキチン化と分解には全く関与しないこと、および、Fbxo16を欠損させたT細胞では、STAT4、STAT3によるTh1、Th17細胞の分化は全く正常であることが分かりました。このことは、Fbxo16が、PDLIM2を含むユビキチンリガーゼ複合体におけるSTAT4およびSTAT3の受容体にはならないことを示しており、この機能は別のFボックスタンパク質が担うと予想されます(図2)。
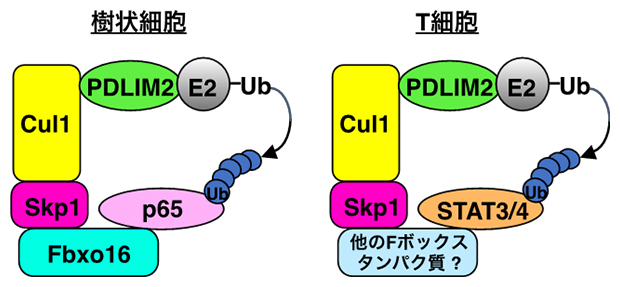
図2 PDLIM2を含むユビキチンリガーゼ複合体による標的タンパク質の認識機構
Fbxo16はPDLIM2とともに複合体を形成する。樹状細胞においては、Fbxo16はNF-κBを認識する受容体として、NF-κBをその受容体に引き込んで、PDLIM2によるNF-κBのユビキチン(Ub)化を促進する。一方、T細胞においては、Fbxo16ではなく、他のFボックスタンパク質がSTAT3およびSTAT4の受容体として、PDLIM2によるSTAT3およびSTAT4のユビキチン化を仲介すると考えられる。
以上のことから、Fbxo16は、樹状細胞においてPDLIM2を含むユビキチンリガーゼ複合体に、NF-κBを特異的に引き込むことにより、NF-κBによる炎症反応を特異的に抑制することが判明しました。
- 注2)Skaar, J.K. et al. Mechanisms and function of substrate recruitment by F-box proteins, Nat Rev Mol Cell Biol. 2013 14: 3690381.
今後の期待
Fbxo16は、樹状細胞においてPDLIM2を含むユビキチンリガーゼ複合体に、NF-κBを特異的に引き込むことにより、NF-κBによる炎症反応を特異的に抑制することが明らかになりました。一方で、T細胞におけるSTAT4、STAT3によるTh1、Th17細胞の機能には全く影響を与えないことも分かりました。このことは、Fbxo16の活性を人為的に制御することにより、樹状細胞特異的に免疫反応を抑制できることを示しています。炎症性疾患や自己免疫疾患の治療を目的とした人為的な免疫制御法の開発に役立つことが期待されます。
補足説明
- 1.Fボックスタンパク質
タンパク質分子の中で特定の構造と機能を持つことで他と区別できる領域をドメインという。Fボックスタンパク質は、Fボックスドメインというドメイン構造を共通して持つ一群のタンパク質の総称。Fボックスタンパク質は、ユビキチンリガーゼ複合体のコンポーネントの一つとして働く場合には、ユビキチン化される標的タンパク質の受容体となる。 - 2.自己免疫疾患
何らかの免疫異常によって自分の体や組織を異物のように認識し、自己抗体や自己に反応するリンパ球をつくり、自分の体を攻撃する疾患。代表的なものに関節リウマチなどあるが、根本的な治療法は見つかっていない。 - 3.転写因子
特定のDNA配列に結合して遺伝子の発現を制御するタンパク質。 - 4.NF-κB
NF-κBは転写因子で、p65を含む5種類のサブユニットが知られている。これらが二量体を形成したものが転写因子として機能する。細菌やウイルスの構成成分などの刺激で活性化され、炎症性サイトカインなどの発現を亢進(こうしん)させることで、炎症反応の誘導に中心的役割を果たす。 - 5.ユビキチン
ユビキチンは76個のアミノ酸から成る小さなタンパク質。標的タンパク質にユビキチンを付加することをユビキチン化といい、タンパク質分解酵素の目印となる。 - 6.PDLIM2
PDZドメインとLIMドメインという二つの特殊な構造を持つタンパク質で田中チームリーダーらが発見した。標的タンパク質となる転写因子をユビキチン化し分解を誘導することで、シグナル伝達を抑制するように働く。 - 7.樹状細胞
自然免疫を担う免疫細胞の一種で、皮膚組織や粘膜に存在し、表面に多くの突起を持つ。異物を取り込んで活性化すると、リンパ節や脾臓(ひぞう)などの二次リンパ器官に移動して抗原特異的なT細胞([10]参照)に抗原を提示し、T細胞を活性化する。 - 8.Toll(トール)様受容体(TLR)
病原体由来のさまざまな成分の認識に関与する膜タンパク質群の総称。病原体を認識するセンサーとして機能する。ヒトでは10種類、マウスでは12種類が報告されており、それぞれのTLRが病原体特異的な成分(膜分子や核酸)を認識する。TLRはToll-like receptorの略。 - 9.炎症性サイトカイン
サイトカインとは、細胞同士の情報伝達に関わるさまざまな生理活性を持つタンパク質の総称。炎症性サイトカインとは、体内への病原体の侵入を受けて産生されるサイトカインで、生体防御に関与する多種類の細胞に働き、炎症反応を引き起こす。 - 10.T細胞
免疫制御の中心的役割を果たすリンパ球。胸腺(Thymus)で形成されるためT細胞と呼ぶ。各細胞(クローン)が異なる抗原特異的な受容体(T細胞抗原受容体:TCR)を発現し、抗原を認識する。機能により、種々のサイトカインを産生したり、骨髄で形成されるB細胞からの抗体産生の調節をしたりするもの(ヘルパーT細胞)や、標的細胞の傷害を担うもの(キラーT細胞)などがある。 - 11.STAT
サイトカイン、増殖因子、ホルモンなどのシグナルを細胞膜上の受容体から核まで伝達する細胞内情報伝達分子であるが、核に入った後は、転写因子としてDNAに結合して遺伝子の発現を制御する。細胞内情報伝達と遺伝子発現制御の二つの機能を兼ね備えている。STATはSignal Transducers and Activators of Transcriptionの略。 - 12.プロテアソーム
プロテアソームは、細胞質内および核内に分布する巨大なタンパク質分解酵素複合体で、ユビキチン化された標的タンパク質を認識して選択的に分解する。 - 13.アダプター分子
シグナル伝達に関与するタンパク質の一種であり、それ自身は酵素活性などは持っていないが、特定の配列や構造を認識して二つまたはそれ以上の異なるタンパク質の結合を仲介する分子。 - 14.リポ多糖(LPS)
大腸菌などのグラム陰性菌の細胞壁を構成する糖脂質の一つ。樹状細胞の細胞表面にあるToll様受容体の一つTLR4を刺激することにより、転写因子NF-κBを活性化する。LPSはLipopolysaccharideの略。
研究チーム
理化学研究所 生命医科学研究センター 炎症制御研究チーム(研究当時)
チームリーダー(研究当時)田中 貴志(タナカ・タカシ)
(現 免疫器官形成研究チーム 客員研究員)
テクニカルスタッフⅠ(研究当時)杉本 晶子(スギモト・アキコ)
(現 感染免疫研究チーム テクニカルスタッフⅠ)
テクニカルスタッフⅠ(研究当時)城道 絢(ジョウドウ・アヤ)
(現 代謝ネットワーク研究チーム テクニカルスタッフⅠ)
研究支援
本研究は、内藤記念科学振興財団(研究代表者:田中貴志)、および、科学技術振興機構(JST)戦略的創造研究推進事業個人型研究(さきがけ)「炎症の慢性化機構の解明と制御(研究総括:高津聖志)」の研究課題「炎症反応を負に制御する分子機構の解明(研究代表者:田中貴志)」による助成を受けて行われました。
原論文情報
- Akiko Ishige-Sugimoto, Aya Jodo, Takashi Tanaka, "Fbxo16 mediates degradation of NF-κB p65 subunit and inhibits inflammatory response in dendritic cells.", Frontiers in Immunology, 10.3389/fimmu.2025.1524110
発表者
理化学研究所
生命医科学研究センター 炎症制御研究チーム(研究当時)
チームリーダー(研究当時)田中 貴志(タナカ・タカシ)
(現 免疫器官形成研究チーム 客員研究員)
テクニカルスタッフⅠ(研究当時)杉本 晶子(スギモト・アキコ)
(現 感染免疫研究チーム テクニカルスタッフⅠ)
発表者のコメント
PDLIM2のようなユビキチンリガーゼは、多くの場合、複合体を形成することによりその機能を発揮しますが、個々のユビキチンリガーゼがどのような分子と複合体を形成するのかに関する研究はこれまであまり行われてきませんでした。今回の研究で、PDLIM2を含むユビキチンリガーゼ複合体においては、Fbxo16がNF-κBを引き寄せる受容体となることが分かりましたが、一方では、STAT3およびSTAT4の受容体は、別のFボックスタンパク質が担うことが示唆されました。これは、一つのユビキチンリガーゼが、その複合体の中の標的タンパク質の受容体タンパク質を変えることにより、どの標的タンパク質をユビキチン化するのか(ユビキチン化の特異性)を変化させていることを示唆しており、非常に興味深い発見です。(田中 貴志)
 田中 貴志
田中 貴志
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
