理化学研究所(理研)生命機能科学研究センター 染色体分配研究チームの吉田 周平 技師、浅井 皓平 研究パートタイマーⅠ、北島 智也 チームディレクター、無細胞タンパク質合成研究チームの中川 れい子 技師の研究チームは、卵母細胞[1]の分裂では、動原体[2]がまず紡錘体(ぼうすいたい)[3]を二極性化し、その次に微小管[4]の接続が安定化する、という手順が正常な染色体[5]分配に重要であることを発見しました。
本研究成果は、卵母細胞における染色体分配機構への理解を深め、卵母細胞において染色体分配異常が起こりやすい原因の解明に貢献すると期待されます。
哺乳動物の卵母細胞には中心体[4]が存在せず、染色体を両極に分配する紡錘体がゆっくりと楕円形になります(二極性化)。そして紡錘体を形成する微小管が動原体へと接続され、染色体は紡錘体の両極へと分配されることで、染色体が正しく分配されます。二極性化する前に微小管が動原体に接続すると、染色体分配異常の原因となることが予想されますが、これを防ぐ仕組みはよく分かっていません。
今回、研究チームは、マウス卵母細胞では動原体に局在するMPS1[6]というリン酸化酵素が、紡錘体の二極性化を制御していることを明らかにしました。MPS1を阻害した卵母細胞では紡錘体の二極性化が遅れ、染色体分配異常の原因となる誤った微小管の接続が増加します。MPS1は微小管と動原体の接続前に二極性化を促進することから、卵母細胞には最初に紡錘体を二極性化し、その後に微小管接続を安定化する仕組みが備わっていることが分かりました。
本研究は、科学雑誌『The EMBO Journal』オンライン版(6月4日付:日本時間6月4日)に掲載されました。
マウス卵母細胞において紡錘体の二極性化を促進するMPS1
背景
卵母細胞は卵子の元となる細胞で、卵母細胞において染色体が減数分裂[7]によって正しく分配されることで、受精後の正常な胚発生が可能になります。しかし哺乳動物の卵母細胞では体細胞に比べ、染色体の分配異常が起こりやすいことが報告されています。
染色体は、主に微小管によって構成される紡錘体により分配されます。減数分裂の際、紡錘体の微小管は複製された染色体上の動原体と接続し、それぞれの染色体を反対方向に引っ張ります。染色体が正しく分配されるためには、微小管が動原体へと正しく接続し、染色体の移動方向を決める紡錘体が二つの極を持つこと(二極性)が重要です。
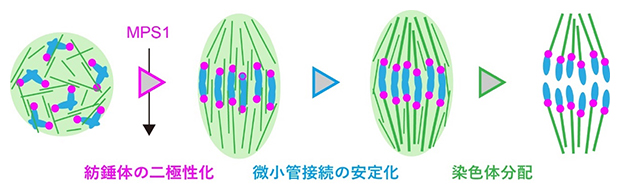
多くの動物の体細胞には、中心体と呼ばれる細胞小器官が存在します。細胞分裂では中心体も二つに複製され、それぞれの中心体から伸びる微小管によって二極性の紡錘体が形成されます。一方、哺乳動物の卵母細胞は中心体を持たず、紡錘体は極性のない状態からゆっくり二極性化されます(図1)。このとき、紡錘体が二極性化する前に微小管が動原体に安定的に接続してしまうと、染色体の移動方向がそろわず分配異常の頻度が高まる原因になると考えられます。しかし、微小管の接続に先行して紡錘体が二極性化する仕組みが卵母細胞に備わっているかどうかは不明でした。
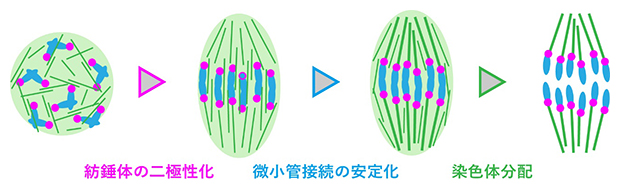
図1 マウス卵母細胞における紡錘体の二極性化
マウス卵母細胞の減数第一分裂における微小管(緑色)、染色体(青色)、動原体(マゼンタ色)の模式図。中心体を持たない卵母細胞では、微小管はまず極性を持たない球状構造を形成し、その後、楕円形の紡錘体を形成する。この過程を二極性化と呼ぶ。一方の極から伸びる微小管が一つの動原体に正しく接続することで、複製した染色体が正しく分配される。なおマウスの動原体は、ヒトとは異なり染色体の末端部に位置する。
動原体タンパク質であるNDC80[2]は、微小管と動原体の接続に必須のタンパク質です。吉田技師、北島チームディレクターらの先行研究から、マウスの卵母細胞では、このNDC80が紡錘体の二極性化にも必要であることや、微小管を束ねる(架橋する)タンパク質PRC1[8]がNDC80によって動原体に集積すること、PRC1が紡錘体の二極性化に関わっていることが明らかになっています注)。そこで本研究では、動原体に「紡錘体の二極性化」と「微小管との接続」の順番を制御する仕組みがあると考え、その解明に取り組みました。
- 注)2020年5月27日プレスリリース「卵母細胞における染色体分配装置の形成機構を解明」
研究手法と成果
紡錘体の二極性化が微小管接続に先行する仕組みとして、微小管と動原体の接続が安定化する前に二極性化が促進している可能性が考えられます。この仮説を検証するため、「紡錘体の二極性化」と「微小管との接続」の両方に必要なマウスNDC80タンパク質の二つの機能のうち、微小管の接続を形成することができない変異型NDC80を用い、紡錘体の二極性化に重要な因子の探索を行いました。その結果、動原体に局在するリン酸化酵素MPS1を見いだしました。MPS1の酵素活性を薬剤で阻害した卵母細胞では、紡錘体の二極性化が遅れることがライブイメージング[9]による紡錘体の形態解析で分かりました(図2)。
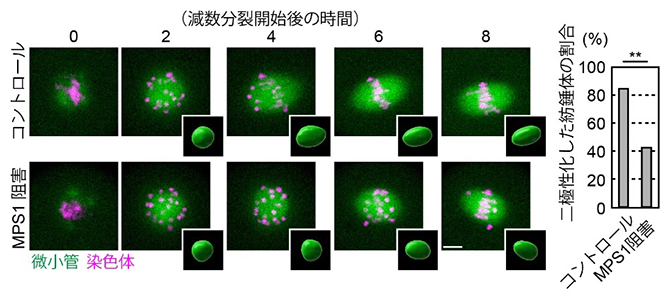
図2 MPS1を阻害した卵母細胞の紡錘体
緑色は紡錘体微小管、マゼンタ色は染色体を示す。各ライブイメージング像の右下に、紡錘体の外形を立体的に再構成した形態解析像を示す。MPS1の酵素活性を阻害した卵母細胞では、紡錘体が球形から楕円形に変わるまでの時間が長くなり、二極性化が遅れていることが分かる。スケールバーは10マイクロメートル(μm、1μmは1,000分の1ミリメートル)。
MPS1を阻害した卵母細胞では、動原体に局在するNDC80やPRC1の量が減少していました。また、質量分析[10]の結果、リン酸化酵素であるMPS1は、NDC80とPRC1を直接リン酸化することが示されました。そして動原体に局在するNDC80が、MPS1によりリン酸化を受けていることも観察されました。
さらに、MPS1を阻害した卵母細胞では、PRC1による紡錘体を二極性化する活性が低下することが分かりました(図3)。
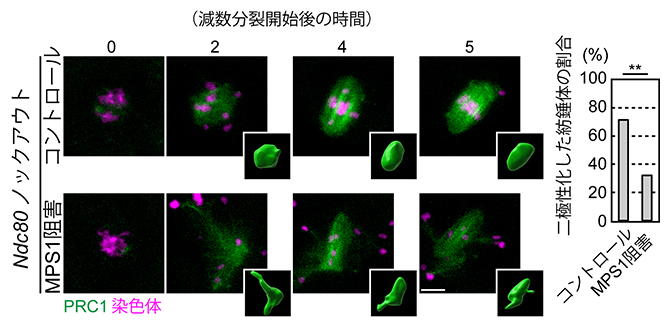
図3 Ndc80ノックアウト卵母細胞でのMPS1阻害の影響
Ndc80をノックアウト(遺伝子破壊)した卵母細胞は二極性紡錘体を形成することができないが、PRC1を過剰発現させることで紡錘体の二極性化を回復できる。この実験系に対して、MPS1阻害の影響を調べた。Ndc80ノックアウト卵母細胞にPRC1を過剰発現した場合、MPS1の活性を阻害すると二極性化する紡錘体の割合が低くなった。緑色はPRC1、マゼンタ色は染色体を示す。スケールバーは10μm。
MPS1を阻害した卵母細胞では、紡錘体の二極性化が遅れるだけでなく、染色体分配異常の原因となる誤った微小管の接続が増加しました。しかし、微小管の架橋とスライドを促進するタンパク質を増やして紡錘体二極性化の遅れを回復させると、正しい接続が増加し、誤った接続が減少することが示されました(図4)。
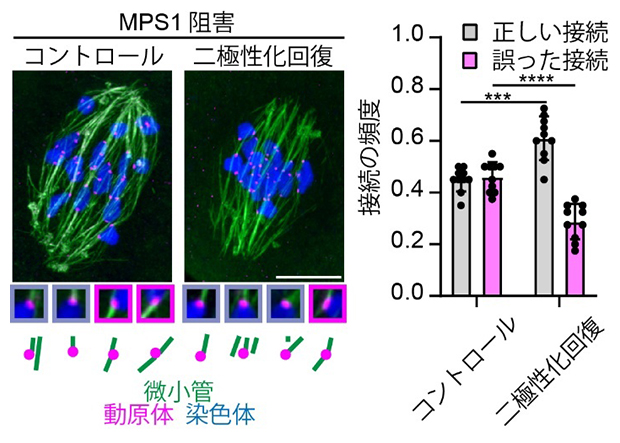
図4 MPS1を阻害した卵母細胞での動原体と微小管の接続
緑色は微小管、マゼンタ色は動原体、青色は染色体を示す。正常な微小管接続では、一つの動原体には一方の極から伸びる微小管の先端だけが接続する。これに対し、両極から伸びた微小管の先端が同じ動原体に接続すると、染色体分配異常の原因となる誤った微小管接続となる。MPS1を阻害した卵母細胞(コントロール)では誤った接続が増加している(マゼンタ色で囲んだ拡大像)が、紡錘体の二極性化の遅れを回復させることで正しい接続が増加し、誤った接続が減少する。スケールバーは10μm。
これらの結果より、①マウスの卵母細胞ではMPS1が紡錘体の二極性化を制御すること、②紡錘体が二極性化する時期が正しい微小管の接続を形成するために重要であること、が示唆されました。微小管が接続される前の動原体でMPS1が紡錘体の二極性化を促進し、その後に動原体と微小管の接続が安定化することが、卵母細胞の正常な染色体分配に重要であると考えられます。
今後の期待
本研究では、マウスの卵母細胞において、動原体に局在するリン酸化酵素であるMPS1が、NDC80やPRC1を介して紡錘体の二極性化を制御していることを明らかにしました。ヒトの卵母細胞では、PRC1は動原体に局在しませんが、別の因子が動原体での微小管の再構成を促進していることが分かっています。従って、動原体が紡錘体の制御に重要であることは、哺乳類の種を超えて共通していると考えられます。
今後、紡錘体を二極性化するタイミングを制御する手法を開発できれば、染色体分配異常が起こりやすい哺乳動物の卵母細胞において、染色体分配異常の頻度を低減できることが期待されます。
補足説明
- 1.卵母細胞
雌由来の受精可能な生殖細胞である卵子の前駆細胞。卵母細胞は胎児期に形成され、長期の休眠期を経て排卵直前に卵子になる。 - 2.動原体、NDC80
動原体は複数のタンパク質複合体によって構成されるタンパク質構造体で、NDC80はその構成タンパク質の一つ。染色体を分配するために必要な微小管([4]参照)との接続形成やその監視を行う。 - 3.紡錘体(ぼうすいたい)
分裂期に形成される染色体を分配するための細胞内構造体。主に微小管([4]参照)によって構成される。 - 4.微小管、中心体
微小管は、チューブリンと呼ばれるタンパク質が重合して環状構造の長い円筒を形成したもの。重合の核となる構造を「微小管形成中心」と呼び、多くの動物の体細胞分裂では、細胞小器官である「中心体」が主にその役割を果たす。 - 5.染色体
ヒストンが結合したDNAが細胞分裂期に凝縮したもの。 - 6.MPS1
動原体に局在するリン酸化酵素。動原体タンパク質をリン酸化し、微小管接続を監視する機能を持つ。 - 7.減数分裂
真核生物において配偶子を形成するために2回の分裂が連続して起こる、配偶子形成特異的な細胞分裂。 - 8.PRC1
逆方向性微小管の架橋タンパク質で、体細胞分裂では染色体分配後の細胞質分裂に必要である。 - 9.ライブイメージング
生きた細胞や組織、個体の生命活動を経時観察すること。特に、GFPなどの蛍光タンパク質を用いて特定のタンパク質や細胞を標識し、蛍光顕微鏡でその動きや変化を詳細に観察する手法は、生命科学に欠かせない手法となっている。 - 10.質量分析
物質をイオン化し、その質量を検出することにより、ペプチドのアミノ酸配列や翻訳後修飾を決定する分析法。近年、タンパク質のリン酸化修飾を解析する主な手法の一つとなっている。
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、RIKEN Pioneering Project "Long-timescale Molecular Chronobiology"、日本学術振興会(JSPS)科学研究費助成事業学術変革領域研究(A)「動的な生殖ライフスパン:変動する生殖細胞の機能と次世代へのリスク(領域代表者:北島智也)」、同新学術領域研究(研究領域提案型)「染色体イメージングによる卵子インテグリティの予見(研究代表者:北島智也)」、同基盤研究(B)「哺乳類卵母細胞における紡錘体二極化の機構の解明(研究代表者:北島智也)」、同基盤研究(A)「人工動原体の構築による染色体分配の機構の解明(研究代表者:北島智也)」、同若手研究(B)「卵母細胞における新規の紡錘体二極性化機構の解明(研究代表者:吉田周平)」、同基盤研究(C)「哺乳動物卵母細胞における中心体非依存的な紡錘体二極性化機構の解明(研究代表者:吉田周平)」「動原体はどのようにマウス卵母細胞の紡錘体を二極性化するのか(研究代表者:吉田周平)」による助成を受けて行われました。
原論文情報
- Shuhei Yoshida, Reiko Nakagawa, Kohei Asai, Tomoya S. Kitajima, "MPS1 promotes timely spindle bipolarization to prevent kinetochore-microtubule attachment errors in oocytes", The EMBO Journal, 10.1038/s44318-025-00461-w
発表者
理化学研究所
生命機能科学研究センター 染色体分配研究チーム
技師 吉田 周平(ヨシダ・シュウヘイ)
研究パートタイマーⅠ 浅井 皓平(アサイ・コウヘイ)
チームディレクター 北島 智也(キタジマ・トモヤ)
無細胞タンパク質合成研究チーム
技師 中川 れい子(ナカガワ・レイコ)
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
