2025年6月17日
理化学研究所
東京大学
クローン性造血・遺伝要因・環境要因の複雑な関係を解明
-TP53遺伝子変異を伴うクローン性造血の幅広い影響を明らかに-
理化学研究所(理研)生命医科学研究センター 基盤技術開発研究チームの碓井 喜明 基礎科学特別研究員、桃沢 幸秀 チームディレクター(生命医科学研究センター 副センター長)、東京大学 大学院新領域創成科学研究科 メディカル情報生命専攻 クリニカルシークエンス分野の松田 浩一 教授らの共同研究グループは、日本の約14万人における、TP53遺伝子[1]変異を伴うクローン性造血について世界最大規模の評価を行い、その特徴や臨床的意義を明らかにしました。
本研究成果は、疾患のメカニズムの解明やクローン性造血に基づく臨床予後の評価などに貢献すると期待できます。
今回共同研究グループは理研で独自に開発したゲノム解析手法を用いて、バイオバンク・ジャパン[2]により収集された血液のDNAについて、血液細胞にゲノム異常が生じた現象であるクローン性造血の解析を行い、その特徴を明らかにしました。また、約10年間の追跡調査の情報に基づく解析の結果、血液のがんである骨髄系腫瘍やリンパ系腫瘍に加え、呼吸器疾患の死亡リスクも上昇することが示されました。さらに、それらの疾患の死亡リスクは特定の遺伝要因や環境要因が組み合わさった場合に異なることも明らかになりました。
本研究は、医学雑誌『Blood Cancer Discovery』オンライン版(6月17日付:日本時間6月17日)に掲載されました。
遺伝要因と環境要因の組み合わせで異なるTP53遺伝子変異を伴うクローン性造血の影響
背景
血液のがんでは血液細胞にゲノム異常が生じています。一方で、血液のがんが発症していない人においても加齢とともに血液細胞にゲノム異常が生じる現象が明らかになり、「クローン性造血」として近年注目を集めています。このクローン性造血は、血液のがんに加えて心血管疾患など幅広い疾患のリスクにも関連することが知られています注1)。また、TP53遺伝子変異を伴うクローン性造血はがん患者においてよく検出されることが知られています注2)。しかし、TP53遺伝子変異を伴うクローン性造血の保持者は他の遺伝子の変異と比較して少なく注3)、変異アリル頻度[3]が低い変異も含んだ大規模な評価は技術的に課題もあり、その幅広い影響については十分明らかになっていませんでした。
そこで本研究では独自の解析技術を用いることにより、上記の課題を克服してTP53遺伝子変異を伴うクローン性造血の特徴や臨床的意義を明らかにすることを目指しました。
- 注1)Jaiswal S et al. Age-related clonal hematopoiesis associated with adverse outcomes. N Engl J Med. 2014;371(26):2488-98.
- 注2)Evans MA, Walsh K. Clonal hematopoiesis, somatic mosaicism, and age-associated disease. Physiol Rev. 2023;103(1):649-716.
- 注3)Kessler MD et al. Common and rare variant associations with clonal haematopoiesis phenotypes. Nature. 2022;612(7939):301-309.
研究手法と成果
共同研究グループはまず、バイオバンク・ジャパンが保管する血液のがんを有していない140,597人のDNAを対象に、次世代シークエンサー[4]によって得られたデータを用いて、独自に開発した解析技術によりTP53遺伝子変異を伴うクローン性造血の評価を行いました。この解析技術により、変異アリル頻度が低い変異も含み、かつ、大規模サンプルの評価が可能となりました。その結果、421種類の変異を同定し、1,157人のクローン性造血の保持者を同定しました。クローン性造血の年齢ごとの保持割合を評価したところ年齢とともに高くなっていましたが、変異が含まれている程度を示す変異アリル頻度が低い場合、年齢とともに増加する傾向はより顕著になっていました(図1)。本研究では変異アリル頻度が低い変異も含めた評価ができたことによって、より多くの保持者が同定されたことを示しています。また、クローン性造血の保持者は血液以外のがんを有する人に多く認められましたが、血液以外のがんを有していない人においても同様に多く認められ、いずれも年齢とともに保持割合が増加していました(図1)。
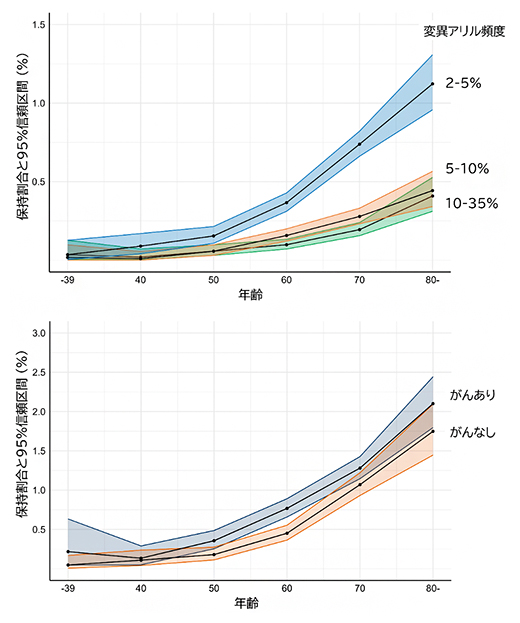
図1 本研究対象者におけるクローン性造血の各年代での保持割合
- 上)変異アリル頻度ごとに保持割合を表示。変異アリル頻度が低い場合、より保持割合が高くなっている。
- 下)血液以外のがんの有無ごとに変異アリル頻度2~35%の変異の保持割合を表示。がんを有さない人においても、高齢になるにつれ多くの保持者が存在している。
クローン性造血の臨床的意義の評価を行うため、血液サンプルを採取したのちに追跡調査を行った81,462人(追跡期間の中央値:約10年間)の予後について解析を行いました。図2はTP53遺伝子変異を伴うクローン性造血と統計学的に有意な関連を認めた疾患に関するハザード比[5]を示しています。この解析によって、TP53遺伝子変異を伴うクローン性造血は血液のがんである骨髄系腫瘍やリンパ系腫瘍に加えて、呼吸器疾患(間質性肺疾患、慢性下気道疾患、肺がん)の死亡リスクとも関連があることが明らかになりました。一方、他の遺伝子においては関連することが知られている、心血管疾患の死亡リスクとはTP53遺伝子に関しては有意な関連は認めませんでした。
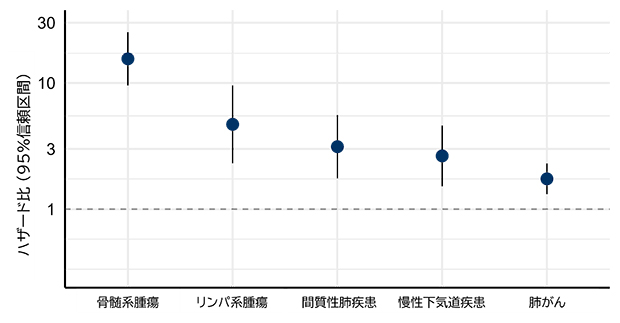
図2 TP53遺伝子変異を伴うクローン性造血の各疾患の死亡に関するハザード比
年齢・性別・喫煙歴・喫煙量・飲酒歴・飲酒量・BMI・併存疾患について調整し、統計学的に有意であった疾患について図示。死因については、厚生労働省管轄の人口動態調査の調査票情報を利用して独自に集計・分析を行っているため、厚生労働省が公表している統計などと一部一致しない場合がある。
さまざまな疾患の発症や経過には、遺伝要因や環境要因も影響を及ぼします。そこで、個々人の遺伝要因や環境要因によってクローン性造血の影響がどのように異なるかを解析しました。飲酒歴に関しては、アルコールの分解に関係するアセトアルデヒド代謝に関わるALDH2遺伝子の生殖細胞系列バリアント[6]を組み合わせて、アセトアルデヒドによる影響に着目して評価を行いました。その結果、アセトアルデヒドによる影響の受けやすさとクローン性造血の両方を有していた人は骨髄系腫瘍、喫煙歴とクローン性造血の両方を有していた人は呼吸器疾患の死亡リスクが、それぞれの要因を単独で有している場合よりも交互作用[7]を伴って一層高かったことが明らかになりました(図3)。媒介分析[8]の結果、その交互作用は、該当環境要因に由来していない機序により生じたクローン性造血との間に生じていることも示唆されました。
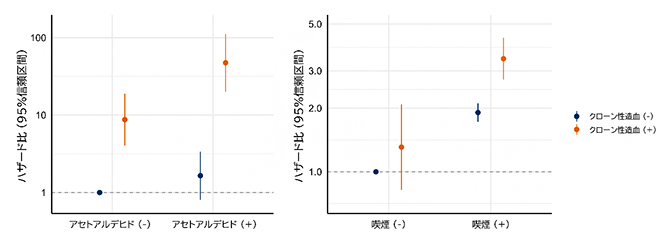
図3 遺伝要因・環境要因とクローン性造血を組み合わせた影響
- 左)飲酒由来のアセトアルデヒドの影響の受けやすさの有無でクローン性造血の骨髄系腫瘍死亡に関するハザード比を年齢・性別・喫煙歴・喫煙量・飲酒歴・飲酒量・BMI・併存疾患・ALDH2について調整して算出。アセトアルデヒド(+):アセトアルデヒド代謝に関わる遺伝要因であるALDH2 rs671 Lysのアリル(遺伝子型の違い)と飲酒歴の両方を有している人と定義。
- 右)喫煙歴の有無でクローン性造血の呼吸器疾患死亡に関するハザード比を年齢・性別・喫煙量・飲酒歴・飲酒量・BMI・併存疾患について調整して算出。
共にクローン性造血・環境要因単独の場合より両者が組み合わさった場合に影響が強くなっていることが示されている。死因については、厚生労働省管轄の人口動態調査の調査票情報を利用して独自に集計・分析を行っているため、厚生労働省が公表している統計などと一部一致しない場合がある。
多くの慢性疾患では炎症性サイトカイン[9]が関与していることが知られています注4)。そこで、炎症性サイトカインIL-6経路[9]の阻害に関与する遺伝要因として知られているIL6R遺伝子の生殖細胞系列バリアント注4)に注目しました。その結果、呼吸器疾患においては、IL6R遺伝子の生殖細胞系列バリアントを有している場合、TP53遺伝子変異を伴うクローン性造血の影響が弱い傾向にあることが明らかとなりました(図4)。このIL6R遺伝子の生殖細胞系列バリアントは、心血管疾患においてクローン性造血の影響を弱めることが示唆され、クローン性造血と心血管疾患との関係において炎症性サイトカインの寄与が示唆されるようになったものでもあります注5)。これらのことから、今回明らかになったTP53遺伝子変異を伴うクローン性造血が呼吸器疾患に及ぼす影響においても、炎症性サイトカインが重要な役割を担っている可能性が示されました。これらの結果は、疾患のメカニズムの解明やクローン性造血に基づく臨床予後の評価などに寄与するものと思われます。
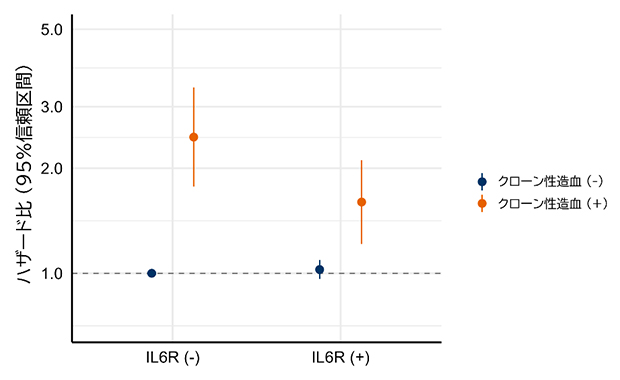
図4 喫煙歴者におけるクローン性造血と遺伝要因を組み合わせた呼吸器疾患死亡への影響
遺伝要因の有無でクローン性造血の呼吸器疾患死亡に関するハザード比を年齢・性別・喫煙量・飲酒歴・飲酒量・BMI・併存疾患について調整して算出。IL6R(+):IL6R rs2228145 Alaのアリル(遺伝子型の違い)を有している人。死因については、厚生労働省管轄の人口動態調査の調査票情報を利用して独自に集計・分析を行っているため、厚生労働省が公表している統計などと一部一致しない場合がある。
- 注4)Ferreira RC et al. Functional IL6R 358Ala allele impairs classical IL-6 receptor signaling and influences risk of diverse inflammatory diseases. PLoS Genet. 2013;9(4):e1003444.
- 注5)Bick AG et al. Genetic Interleukin 6 Signaling Deficiency Attenuates Cardiovascular Risk in Clonal Hematopoiesis. Circulation. 2020;141(2):124-131.
今後の期待
本研究では独自のゲノム解析技術を基に、TP53遺伝子変異を伴うクローン性造血について世界最大規模の評価を行いました。今回の研究成果により、変異やその保持者の特徴などが明らかになりました。さらに、特定の遺伝要因や環境要因とクローン性造血が組み合わさることで、臨床的な影響が異なることも分かりました。これらのメカニズムに着目することで新たな治療標的が同定される可能性もあります。
本結果は観察研究に基づく結果であるため、環境要因による影響を取り除くことでどれくらいのリスク低減につながるかも含めて、臨床現場に応用するにはさらなる検証が必要です。
今後、本研究の成果は、疾患のメカニズムの解明やクローン性造血に基づく臨床予後の評価など幅広い分野に寄与するものと期待されます。
補足説明
- 1.TP53遺伝子
ヒトがんにおいて最も変異頻度の高い遺伝子の一つ。TP53の遺伝子産物p53は、細胞内においてDNA修復や細胞周期の停止、アポトーシス(プログラムされた細胞死)などの細胞増殖サイクルの抑制を制御する機能を持つ。 - 2.バイオバンク・ジャパン
日本人集団約27万人を対象とした、世界最大級の疾患バイオバンク。日本医療研究開発機構(AMED)のゲノム医療実現バイオバンク利活用プログラム「利活用を目的とした日本疾患バイオバンクの運営・管理」において運営され、DNAサンプルや血清サンプルを臨床情報と共に保管し、研究者へ提供している。2003年から東京大学医科学研究所内に設置されている。 - 3.変異アリル頻度
該当領域のシークエンス配列の全体のうち変異がある割合を示したもの。 - 4.次世代シークエンサー
蛍光ヌクレオチドを使ったSequence by synthesis(シークエンス・バイ・シンセシス)に代表される手法を活用してDNAの塩基配列を読み出す装置であり、Sanger法と比較すると大幅に高いスループットを達成する。 - 5.ハザード比
リスクの指標の一つで、発症や死亡などイベントが起こるまでの時間も加味したリスクの上昇を表す。本研究では死亡に関するハザード比を示している。 - 6.生殖細胞系列バリアント
生まれつき持っている個々人のゲノム配列の違い。親から子へと受け継がれる遺伝情報。 - 7.交互作用
疾患の要因が複数あるとき、それぞれの要因が組み合わさり、影響が変化する現象。 - 8.媒介分析
暴露因子と結果との間に媒介因子が介在しているモデルを反実仮想(現実に反する想定)に基づいて検討する解析手法の一つ。本研究では媒介因子の影響と交互作用の影響を統合して評価する解析手法を用いている。暴露因子から結果に及ぼすそれぞれの影響を分けて定量化することが可能。 - 9.炎症性サイトカイン、IL-6経路
IL-6は、炎症が起きたときに免疫細胞などから放出される炎症性サイトカイン(タンパク質)の一つ。IL-6が細胞表面の受容体に結合すると、IL-6経路と呼ばれるシグナル伝達が起こり、免疫応答が活性化される。
共同研究グループ
理化学研究所 生命医科学研究センター
基盤技術開発研究チーム
チームディレクター 桃沢 幸秀(モモザワ・ユキヒデ)
(生命医科学研究センター 副センター長)
基礎科学特別研究員 碓井 喜明(ウスイ・ヨシアキ)
専門技術員 飯島 花枝(イイジマ・ハナエ)
上級テクニカルスタッフ(研究当時)岩﨑 雄介(イワサキ・ユウスケ)
テクニカルスタッフⅠ 遠藤 ミキ子(エンドウ・ミキコ)
がんゲノム研究チーム
チームディレクター 中川 英刀(ナカガワ・ヒデワキ)
東京大学 大学院新領域創成科学研究科 メディカル情報生命専攻
クリニカルシークエンス分野
教授 松田 浩一(マツダ・コウイチ)
研究支援
本研究は、日本医療研究開発機構(AMED)ゲノム創薬基盤推進研究事業「乳がん・大腸がん・膵がんに対する適切な薬剤投与を可能にする大規模データ基盤の構築(代表者:桃沢幸秀)」、同生命科学・創薬研究支援基盤事業「生体試料を用いた大規模機能ゲノミクス解析支援及びヒト免疫機能評価基盤の高度化(代表者:山本一彦)」、同革新的がん医療実用化研究事業「23がん種14万人を用いた遺伝・環境・生活習慣を統合した各個人の疾患リスクの推定(代表者:桃沢幸秀)」、同ゲノム医療実現バイオバンク利活用プログラム「利活用を目的とした日本疾患バイオバンクの運営・管理(代表者:松田浩一)」、日本学術振興会(JSPS)科学研究費助成事業研究活動スタート支援「血液細胞に獲得された体細胞変異の大規模評価系の確立(代表者:碓井喜明)」、同若手研究「クローン性造血の遺伝要因の評価を通じた関連疾患の解明(代表者:碓井喜明)」、安田記念医学財団若手癌研究助成「末梢血液細胞における体細胞変異と環境要因との関係の解明(代表者:碓井喜明)」、武田科学振興財団ビジョナリーリサーチ助成(スタート)「遺伝/環境要因を考慮した病態解明及び疾患リスク解明(代表者:碓井喜明)」、MSD生命科学財団がん領域研究助成【若手研究者】「環境要因関連疾患におけるクローン性造血の寄与の解明(代表者:碓井喜明)」、理化学研究所基礎科学特別研究員制度(碓井喜明)による助成を受けて行われました。
原論文情報
- Yoshiaki Usui, Mikiko Endo, Yusuke Iwasaki, Hanae Iijima, Hidewaki Nakagawa, Koichi Matsuda, Yukihide Momozawa, "Clinical Significance of TP53-Mutant Clonal Hematopoiesis Across Diseases", Blood Cancer Discovery, 10.1158/2643-3230.BCD-24-0355
発表者
理化学研究所
生命医科学研究センター 基盤技術開発研究チーム
基礎科学特別研究員 碓井 喜明(ウスイ・ヨシアキ)
チームディレクター 桃沢 幸秀(モモザワ・ユキヒデ)
(生命医科学研究センター 副センター長)
東京大学 大学院新領域創成科学研究科 メディカル情報生命専攻
クリニカルシークエンス分野
教授 松田 浩一(マツダ・コウイチ)
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
東京大学 大学院新領域創成科学研究科 広報室
Tel: 04-7136-5450
Email: press@k.u-tokyo.ac.jp
