理化学研究所(理研)環境資源科学研究センター 天然物生合成研究ユニットの高橋 俊二 ユニットリーダー、ヤフェン・ヨン 国際プログラム・アソシエイト(研究当時)、ソン・リュウ 客員研究員(研究当時)、坂井 克行 研究員、藤山 敬介 訪問研究員(研究当時、現 植物化学遺伝学研究チーム 基礎科学特別研究員)、髙木 海 テクニカルスタッフⅠ、化合物リソース開発研究ユニットの二村 友史 上級研究員(研究当時、現 化合物リソース開発研究ユニット 客員研究員)、長田 裕之 ユニットリーダー(研究当時、現 化合物リソース開発研究ユニット 客員主管研究員)らの国際共同研究グループは、微生物代謝産物で多様な生物活性を有するリベロマイシンA(RM-A)[1]生合成遺伝子クラスター[2]から見いだした酵素の機能改変によって、マラリア原虫や多発性骨髄腫細胞に対して効果があり、構造的に安定な新規リベロマイシン(RM)[1]誘導体を創出することに成功しました。
国際共同研究グループは、放線菌[3]「Actinacidiphila reveromycinica SN-593」のRM-A生合成遺伝子クラスター中のrevI遺伝子破壊株に対して、野生型とは異なる水酸化反応を触媒するように部位特異的変異を導入[4]したrevI遺伝子を形質転換することによって、二つの新規RM誘導体(17-hydroxy-RM-Tと17-hemisuccinyloxy-RM-T)の取得に成功しました。得られた化合物は酸性条件下でも安定性が向上していました。生物活性を評価した結果、いずれの化合物も細胞毒性が低減されていました。17-hydroxy-RM-Tはマラリア原虫に対して顕著な生育阻害活性を示しました。また、17-hemisuccinyloxy-RM-Tは多発性骨髄腫細胞に対して、水素イオン指数(pH)6の培養条件下で増殖抑制効果を示しました。今後、酵素反応の改変により、さらなるRM誘導体の創製と創薬シーズの導出が期待されます。
本研究は、科学雑誌『Chemical Science』オンライン版(6月23日付)に掲載されました。
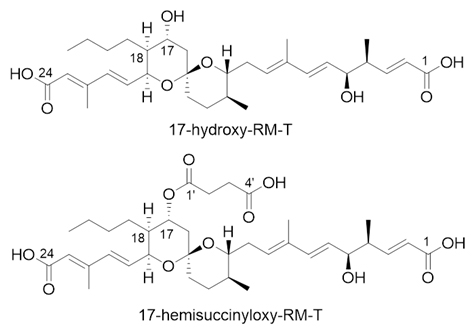
二つの新規RM誘導体の構造
背景
土壌中には多くの微生物が存在し、さまざまな二次代謝産物[5]が生産されています。その中には、抗生物質や抗がん物質など、有用な生理活性物質も含まれています。放線菌から単離された二次代謝産物の一つ、リベロマイシンA(RM-A)(図1上)は、6,6-スピロアセタール骨格(一つの酸素原子と五つの炭素原子から成る六角形の構造(6員環という)が、さらに二つのスピロ結合(二つの環が一つの原子で結合)している構造)、二つのポリエンカルボン酸、二つのアルキル基、およびヘミスクシニル基を含んでいます。また、破骨細胞選択的に細胞死(アポトーシス)を誘導する活性、腫瘍の骨転移抑制活性、抗歯周病作用、抗真菌活性など、さまざまな生物活性を示します。その分子標的は、真核生物のタンパク質合成の初期段階で転移RNA(tRNA)にイソロイシンを結合させる酵素であるイソロイシルtRNA合成酵素(IleRS)です。また、酸性条件下では、RM-Aに含まれる三つのカルボン酸のプロトン(水素イオン)解離が抑制されることにより、細胞膜透過性が向上することが知られています。
このように、酸性環境はRM-Aの高活性と関係しますが、一方で、酸性条件下では活性を失った5,6-スピロアセタール骨格を有するRM-B[1](図1中)へと変換されることも知られています。生合成[5]酵素を改変し、酸性条件下でも安定なRM誘導体を創出することができれば、医薬シーズの導出につながると考えられます。
そこで、国際共同研究グループはRM安定誘導体の創出に向けてRevI(シトクロムP450)[6]に注目しました。RevIは、ヘム[7]含有の酵素であり、位置・立体特異的に水酸基を導入することができます。天然物生合成において、水酸化反応と水酸基を足場とする修飾反応によって構造多様性を拡張します。RM-A生合成研究において、RM-T[1](図1下)の18番目の炭素の位置(C18位)に水酸基を導入するRevI反応は、ヘミスクシニル基の形成に不可欠なステップですが、C18位の修飾は、望ましくない構造変換を誘導します。以上の背景から、本研究では、水酸基が導入される位置を改変することで、6,6-スピロアセタール骨格の安定性を高めると同時に、新たな構造と生物活性を付与する天然化合物の生合成研究を着想しました。
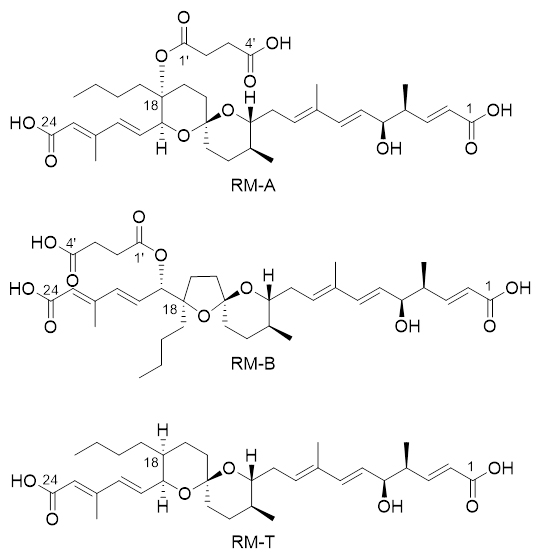
図1 RM-A、RM-B、およびRM-Tの構造
(上)RM-Aは6,6-スピロアセタール骨格(一つの酸素原子と五つの炭素原子から成る6員環が二つスピロ結合している構造)、二つのポリエンカルボン酸(二重結合を複数含むカルボン酸)、二つのアルキル基(-CH3、-CH2CH2CH2CH3)、およびヘミスクシニル基を含んでいる。(中)RM-Aは酸性条件下で5,6-スピロアセタール骨格を有するRM-Bに変換される。(下)RM-Tはrevl遺伝子破壊株に蓄積する生合成中間体。
研究手法と成果
国際共同研究グループは、①変異酵素のデザイン②新規水酸化体の生産と構造決定③RevI-A241Lと基質(RM-T)複合体のX線結晶構造解析④生物活性の評価──を行いました。
第一に、新規酵素反応の創出に向けて、変異候補となるアミノ酸残基を選定しました。まず、RevIとその反応の相手である基質(RM-T)の共結晶[8]構造およびRevI変異体とRM-Tの結合モデル構造を比較しました。活性中心のヘム鉄と基質の反応部位との距離から、新規の水酸化反応を触媒する可能性があるモデル構造を収集しました。次に、実際の反応を検証するために、大腸菌を用いて変異酵素を調製し、基質と混合して酵素反応を行い、反応産物を超高速液体クロマトグラフ質量分析装置(UHPLC-MS)[9]で分析しました。野生型のRevIは、C18位を水酸化し、RM-T1を生成しますが、変異酵素(RevI-A241L:241番目のアミノ酸をアラニン(A)からロイシン(L)に変換)からは異なる水酸化産物のピークが検出できました。さらに、変異酵素の酵素反応動力学定数[10]を解析したところ、野生型酵素の数値と同程度でした。そこで、放線菌「Actinacidiphila reveromycinica SN-593」を用いて新規水酸化体を生体内(in vivo)で生産することが可能と判断しました。
第二に、化合物の構造解析と生物活性評価を行うためには、解析に必要な精製化合物を取得する必要があります。そこでActinacidiphila reveromycinica SN-593のrevI遺伝子破壊株[11](ΔrevI)を活用して微生物生産を検討しました。すなわち、ΔrevIに、revI-A241L遺伝子を導入後、得られた形質転換体を培養し、蓄積する化合物の構造を解析しました。その結果、新規化合物17-hydroxy-RM-Tおよび17-hemisuccinyloxy-RM-Tであることが判明し、その生合成経路を以下のように推定しました(図2)。
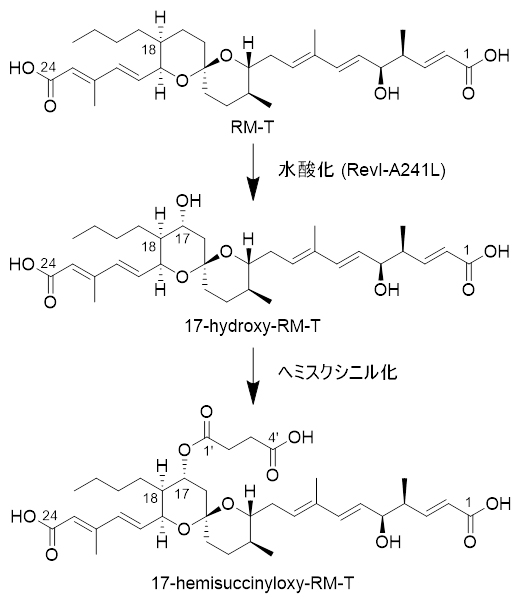
図2 Actinacidiphila reveromycinica SN-593を用いた新規RM誘導体の生産
Actinacidiphila reveromycinica SN-593のrevI遺伝子破壊株(ΔrevI)に、revI-A241L遺伝子を導入後、得られた形質転換体を培養し、蓄積する化合物の構造を解析した。RM-Tから17-hydroxy-RM-T、17-hemisuccinyloxy-RM-Tが生成された。RM-T→17-hydroxy-RM-T→17-hemisuccinyloxy-RM-Tは推定生合成経路。
第三に、位置立体選択的な水酸化の機構を明らかにするために、基質とRevI-A241L変異酵素の複合体の結晶化を行いました。その結果、2.13オングストローム(Å、1Åは100億分の1メートル)の分解能で共結晶構造を決定することに成功しました。RevI-A241Lの全体構造は、野生型RevIの構造と非常によく似ていましたが、基質結合様式は異なっていました(図3)。基質の17番目の炭素の位置(C17位)から活性中心のヘム鉄の距離は大きく変化していませんが、C18位の距離は野生型に比べて離れていることがC17位の選択的水酸化を促進する要因の一つと考えられました。次に、新規RM誘導体の安定性試験を行いました。従来のC18位が修飾されたRM類は、酸性条件下で6,6-スピロアセタール構造から5,6-スピロアセタール構造(不活性型)に変換しますが、17-hydroxy-RM-Tおよび17-hemisuccinyloxy-RM-Tは、安定性が向上していることが確認できました。
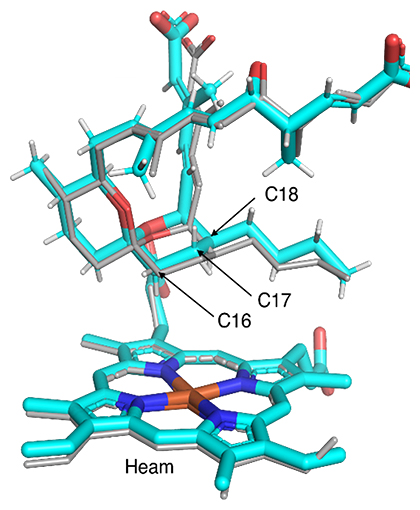
図3 RevI-RM-TおよびRevI-A241L-RM-Tの共結晶構造
野生型RevI(PDB(Protein Data Bank)の登録番号3WVS:灰色)とRevI-A241L変異体の共結晶構造(PDB登録番号9LN5;シアン)の重ね合わせ図。数字はRM-T構造中の炭素の位置を示す。RevI-A241L変異体では、C18位とヘム鉄(Heam)の距離が野生型RevIと比べ離れている。
最後に、マラリア原虫(Plasmodium falciparum)細胞質内のIleRSは、抗マラリア薬の標的として注目されていることから、RM誘導体の抗マラリア活性を評価しました。その結果、化合物RM-A、RM-T、17-hydroxy-RM-Tは、マラリア原虫の増殖を低濃度で抑制しました。興味深いことに、17-hydroxy-RM-Tは、細胞などの生育を阻害する効果の大きさを示すIC50値(50%阻害濃度)[12]は0.09マイクロモーラー(μM、1μMは100万分の1モーラー、1M=1mol/L)であり、RM-AおよびRM-Tと比較してヒト細胞株に対する細胞毒性が低く、新薬開発につながる可能性が示唆されました。
また、RM-Aは多発性骨髄腫に対して抗腫瘍活性を持つことが報告されています。そこで、RM誘導体の多発性骨髄腫の細胞株PCM6に対する細胞毒性を評価しました。17-hemisuccinyloxy-RM-Tは、RM-TおよびRM-Aと同等にpH6の培養条件下で増殖抑制効果を示し、IC50値は0.61μMでした。一方、17-hydroxy-RM-Tは最大濃度10μMまで活性を示しませんでした。また、RM誘導体は、低pH条件下で活性が高くなる傾向が確認できましたが、酸性条件下での細胞培養による評価が困難でした。将来的には生体での検証によって、新規RM誘導体の生物活性評価が期待されます。
今後の期待
多様な化学構造と生理活性を有する天然化合物は、薬剤開発において非常に重要です。現在までに、天然化合物およびその誘導体は、承認された治療薬の3分の1以上を占めています。天然化合物の生合成の鍵反応を理解し、改変酵素を活用することは、薬の種となる化合物の多様性の拡張につながり、生命科学・医薬分野に貢献すると考えられます。今後は、得られた成果を基にして、マラリア原虫のIleRSとRM誘導体との相互作用を詳細に解析し、医薬品としてさらなる評価を行うことが期待されます。
本研究成果は、国際連合が定めた17の目標「持続可能な開発目標(SDGs)[13]」のうち「3.すべての人に健康と福祉を」に大きく貢献するものです。
補足説明
- 1.リベロマイシンA(RM-A)、リベロマイシン(RM)、RM-B、RM-T
リベロマイシン(RM)は、放線菌([3]参照)「Streptomyces sp. SN-593(Actinacidiphila reveromycinica SN-593と再分類)」から単離されたポリケチド化合物。この一種であるリベロマイシンA(RM-A)は、破骨細胞に選択的に取り込まれ、標的分子のイソロイシルtRNA合成酵素の活性を阻害し、タンパク質合成を阻害することで、アポトーシスを誘導する。構造的特徴として、多くの不斉炭素中心を持つスピロアセタール環、トリカルボン酸を有している。構造が異なるRM誘導体にRM-BやRM-Tが報告されている。 - 2.生合成遺伝子クラスター
放線菌や糸状菌などの微生物二次代謝産物([5]参照)の生合成では、関連する全ての遺伝子がゲノム上に近接して存在し、クラスターを形成する。転写制御因子などにより、これらの遺伝子は協調的に制御され、効率よく二次代謝産物が生産される。多くの遺伝子クラスターは休眠しており有効活用が期待されている。 - 3.放線菌
土壌中など自然界に広く存在するグラム陽性(細菌染色法の一つ「グラム染色」で紫色に染まる)の真正細菌であり、複雑な構造を持つ二次代謝産物を生産する。人類は、それらの中から、医薬、農薬、動物薬などの生理活性を持つ物質を利用してきた。現在も医薬探索源として重要視されている。 - 4.部位特異的変異を導入
タンパク質を構成する特定のアミノ酸の改変を目的として、酵素遺伝子に変異を導入する実験手法。 - 5.二次代謝産物、生合成
生合成は生体内で必要な生体物を生成する過程。生物体を構成、維持する上で重要な物質を一次代謝産物、生育に必ずしも必須ではない物質を二次代謝産物と呼ぶ。微生物において、二次代謝産物の生合成に関わる遺伝子群はゲノム中のある特定の領域に並んで存在している。 - 6.RevI(シトクロムP450)
広く分布するヘムタンパク質の一種であり、生物の体内でさまざまな酸化反応を触媒する酵素である。この酵素は、生物の体内での代謝反応において重要な役割を果たし、特に脂肪酸代謝や薬物代謝、さまざまな生理活性物質の合成に関与している。 - 7.ヘム
鉄イオンを中心にポルフィリンという環状の有機化合物が取り囲んだ物質。生体内ではヘモグロビン、ミオグロビン、異物薬物代謝酵素(Revl)、ペルオキシダーゼ、電子伝達系酵素をはじめとするさまざまなタンパク質の補欠分子族(酵素の活性に不可欠な非タンパク質性の物質)として機能している。 - 8.共結晶
タンパク質とそのタンパク質に結合する化合物を混合して、両者の複合体を結晶化すること。共結晶の構造解析をすることで、タンパク質と化合物の結合様式に関する情報を得ることができる。 - 9.超高速液体クロマトグラフ質量分析装置(UHPLC-MS)
高速液体クロマトグラフィー(HPLC)の分離能、速度、感度を大幅に向上させた解析装置であるUHPLCユニットに、質量分析装置(MS)が組み合わされている。UHPLCユニットでは化学的特性の違い、MSユニットでは質量の違いを基に化合物を分離できる。そのため、複雑な混合物の中から目的化合物を素早く解析することが可能。UHPLC-MSはultra-high performance liquid chromatography-mass spectrometryの略。 - 10.酵素反応動力学定数
酵素と基質の相互作用や反応速度を示す数値。Km(ミカエリス定数)は、基質に対する酵素の親和性を示し、Vmaxは、酵素が基質で飽和したときの最大反応速度を示す。 - 11.遺伝子破壊株
特定の生物のゲノムから特定の遺伝子の機能を無効化した菌株。遺伝子の機能や役割の理解に役立つ。 - 12.IC50値(50%阻害濃度)
細菌や細胞などの生育を50%阻害する薬物の濃度。この値が小さいほど強い効果を持つことを示す。 - 13.持続可能な開発目標(SDGs)
2015年9月の国連サミットで加盟国の全会一致で採択された「持続可能な開発のための2030アジェンダ」にて記載された、2016年から2030年までの15年間で達成する国際目標。持続可能な世界を実現するための17の目標、169のターゲットから構成され、発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる(外務省ホームページから一部改変して転載)。SDGsはSustainable Development Goalsの略。
国際共同研究グループ
理化学研究所 環境資源科学研究センター
天然物生合成研究ユニット
ユニットリーダー 高橋 俊二(タカハシ・シュンジ)
国際プログラム・アソシエイト(研究当時)
ヤフェン・ヨン(Ya Fen Yong)
客員研究員(研究当時)ソン・リュウ(Song Liu)
研究員 坂井 克行(サカイ・カツユキ)
訪問研究員(研究当時)藤山 敬介(フジヤマ・ケイスケ)
(現 植物化学遺伝学研究チーム 基礎科学特別研究員)
テクニカルスタッフⅠ 髙木 海(タカギ・ヒロシ)
化合物リソース開発研究ユニット
上級研究員(研究当時)二村 友史(フタムラ・ユウシ)
(現 化合物リソース開発研究ユニット 客員研究員)
ユニットリーダー(研究当時)長田 裕之(オサダ・ヒロユキ)
(現 化合物リソース開発研究ユニット 客員主管研究員)
ケミカルバイオロジー研究グループ(研究当時)
研究嘱託(研究当時)清水 猛(シミズ・タケシ)
マレーシア科学大学
講師 ユージーン・ボーン・ベング・オング
(Eugene Boon Beng Ong)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業基盤研究(A)「天然化合物に生理活性を付与する生合成分子基盤の解明と新規酵素のデノボデザイン(研究代表者:高橋俊二、25H00924)」、同学術変革領域研究(A)「二次代謝産物の生合成における複合酵素反応と未知の基質チャネリング機構の解明(研究代表者:高橋俊二、25H01597)」による助成を受けて行われました。
原論文情報
- Ya Fen Yong, Song Liu, Katsuyuki Sakai, Keisuke Fujiyama, Hiroshi Takagi, Yushi Futamura, Takeshi Shimizu, Hiroyuki Osada, Eugene Boon Beng Ong, and Shunji Takahashi, "Biosynthesis of reveromycin derivatives by altering the regioselectivity of cytochrome P450revI", Chemical Science, 10.1039/D5SC01355K
発表者
理化学研究所
環境資源科学研究センター 天然物生合成研究ユニット
ユニットリーダー 高橋 俊二(タカハシ・シュンジ)
国際プログラム・アソシエイト(研究当時)ヤフェン・ヨン(Ya Fen Yong)
客員研究員(研究当時)ソン・リュウ(Song Liu)
研究員 坂井 克行(サカイ・カツユキ)
訪問研究員(研究当時)藤山 敬介(フジヤマ・ケイスケ)
(現 植物化学遺伝学研究チーム 基礎科学特別研究員)
テクニカルスタッフⅠ 髙木 海(タカギ・ヒロシ)
化合物リソース開発研究ユニット
上級研究員(研究当時)二村 友史(フタムラ・ユウシ)
(現 化合物リソース開発研究ユニット 客員研究員)
ユニットリーダー(研究当時)長田 裕之(オサダ・ヒロユキ)
(現 化合物リソース開発研究ユニット 客員主管研究員)
ケミカルバイオロジー研究グループ(研究当時)
研究嘱託(研究当時)清水 猛(シミズ・タケシ)
マレーシア科学大学
講師 ユージーン・ボーン・ベング・オング(Eugene Boon Beng Ong)
発表者のコメント
RM-A生合成に関与するP450(RevI)に変異を導入し、水酸化反応が改変された変異酵素の開発、合成生物学的手法による新規RM誘導体2種の創出に10年を要しました。これらの化合物は酸性下で高い安定性を示し、特にマラリア原虫に対する選択的な活性を示しました。本研究は、天然物の構造多様化と安定性向上、新規活性付与を同時に達成した研究例であり、タンパク質工学と合成生物学の融合させた創薬研究の新たな可能性を示すものです。共著者の皆さまによるご尽力に心より感謝申し上げます。(高橋俊二)
 左からユージーン・ボーン・ベング・オング、ヤフェン・ヨン、高橋 俊二
左からユージーン・ボーン・ベング・オング、ヤフェン・ヨン、高橋 俊二
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
