理化学研究所(理研)数理創造研究センター 儀保 伸吾 客員研究員、黒澤 元 専任研究員、数理展開部門の初田 哲男 部門長、京都大学 基礎物理学研究所の國廣 悌二 特任教授の共同研究グループは、私たちの睡眠と覚醒のタイミングをつかさどる「体内時計[1]」の周期が、温度に影響されない仕組みを、理論物理学の手法を用いて明らかにしました。
本研究の成果は、体内時計の仕組みを新しい視点から説明する理論的枠組みを提供するものです。
普通は温度が高くなると化学反応は速くなって周期も短くなりそうですが、体内時計は、温度が変わっても約24時間の周期を保ちます(「温度補償性[2]」)。なぜ温度にかかわらず体内時計が周期を一定に保てるのかは長年の謎でした。
今回、共同研究グループは、体内時計の数理モデル[3]を、理論物理学の手法であるくりこみ群法[4]を用いて解析し、遺伝子活性(遺伝子からつくられるmRNAの量)の時間的な変化の形(波形)が、高温になるとひずむこと(具体的には、mRNAの量が増える時間よりも減る時間の方が長くなること)が周期を安定化するカギであることを示しました。また、これまで発表された実験データを解析することで、高温になると波形のひずみが実際に大きくなることを実証しました。さらに、この波形のひずみは、体内時計が昼夜のリズム(光サイクル)に合わせるためにも重要であることを示しました。
本研究は、科学雑誌『PLOS Computational Biology』オンライン版(7月22日付)に掲載されました。
体内時計の仕組み: 高温で遺伝子活性の波形がひずむことで周期を保つという理論とその検証
背景
私たちの体の中には、1日を測るリズムをつくる「体内時計」があります。この体内時計は、さまざまな生化学反応がネットワークのようにつながって動くことで働いています。普通、生化学反応は温度が高くなると速くなります。しかしながら、体内時計の周期は、気温や体温が変わっても、ほぼ24時間のまま変わりません。この不思議な性質は「温度補償性」と呼ばれています。長年にわたって研究が行われ、さまざまな仮説注1~3)が提案されてきましたが、その仕組みはよく分かっていません。
これまでの研究で、儀保客員研究員と黒澤専任研究員は、体内時計の数理モデルを使って、周期を保つためには高温で体内時計の遺伝子活性(遺伝子発現量)の波形がひずむことが必要になることを理論的に示しました注1)。
しかし、体内時計の数理モデルはとても複雑で、どのようにひずむのかを詳しく調べるのは難しく、これまで波形のひずみ方は不明でした。また、高温で波形がひずむことの実験データによる裏付けはありませんでした。
体内時計にはもう一つ重要な特徴があります。それは、昼と夜の光のリズムに合わせて動く(同期する)という性質です。しかし、波形のひずみとこの同期の関係も解明されていませんでした。
- 注1)2019年2月21日プレスリリース「体内時計を安定化する新しい仕組みを発見」
- 注2)2017年6月9日プレスリリース「体内時計が温度に影響されない仕組み」
- 注3)2017年9月8日プレスリリース「体内時計が温度に依存しない仕組みを原子レベルで解明」
研究手法と成果
共同研究グループでは、理論物理学で使われる「くりこみ群法」を用いて、体内時計の数理モデルの周期や体内時計の遺伝子活性の波形について詳細に解析しました(図1)。
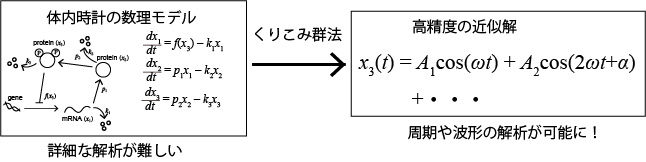
図1 くりこみ群法による数理モデルの解析
複雑な体内時計の数理モデルについて、くりこみ群法を用いて精度の高い近似解を導くことで、体内時計の周期や波形の詳細な解析を可能にした。
その結果、体内時計の周期が温度によらず一定に保たれるためには、高温で体内時計の遺伝子活性が「増加する時間」は短くなり、「減少する時間」は長くなる必要があることが分かりました(図2)。このような波形のひずみによって体内時計の周期が保たれるという仮説は、例えば「温度に対して安定な反応が存在することで周期が補償される」といった、これまで提案されてきた他の温度補償性メカニズムとも矛盾せず、複数の仮説を統一的に説明できる理論と考えられます。
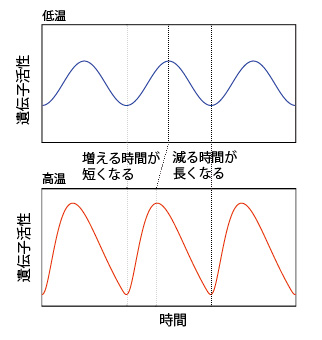
図2 体内時計の周期安定化を導く、遺伝子活性波形の理論予測
体内時計の周期が温度によらず一定のとき、高温における遺伝子活性は、低温時と比較して、増える時間が短くなる一方、減る時間が長くなる。
さらに、実際の実験データを用いて、体内時計の遺伝子活性の波形が温度によって変化するかどうかを検証しました。その結果、ショウジョウバエとマウスのデータにおいて、高温で波形が実際にひずんでいることを示しました(図3)。
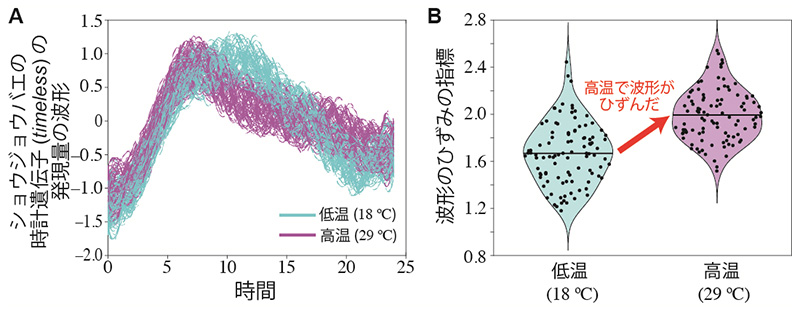
図3 実際の実験データに基づいた遺伝子活性の波形の温度による違い
(A)シミュレーションで再現したショウジョウバエの時計遺伝子活性の実験データ(Kidd et al.(2015)PNAS)と(B)(A)を解析して得た遺伝子活性における波形のひずみの変化。実際の実験データでも理論予測通り高温で波形のひずみが大きくなることを実証した。
また、遺伝子活性の波形のひずみが体内時計の同期に与える影響についても理論的に調べた結果、この波形がよりひずんでいると、体内時計は外部の20~28時間の周期的な刺激(明暗周期など)に同期しにくくなることが分かりました。体内時計の周期は多くの生物で24時間からわずかにずれているため、環境の24時間リズムと一致させるには外部サイクルとの同期が必要です。
これらの結果は、これまでに注目されていなかった「波形のひずみ」という指標が、体内時計の温度補償性と外部同期という体内時計の基本的性質の両方に重要であることを示唆しています。
今後の期待
今回の研究によって、遺伝子活性の波形のひずみが体内時計の周期の安定性や同期に重要であることが示されました。今後は、実際に測定された波形のひずみの情報を基に、体内時計の詳細な仕組みの解明が期待されます。
例えば、高温下では合成が速くなる一方で分解がそれほど速くならない場合、遺伝子活性の減少に時間がかかり、波形がひずむことが予想されます。こうした分子メカニズムについて、理論と実験の両面から探る研究が今後重要になると考えられます。
また、異なる体内時計を持つさまざまな生物種において、波形のひずみがどのように現れているかを調べることで、進化的な観点からの比較や新たな原理の発見につながる可能性があります。
さらに、今回調べた体内時計遺伝子活性の波形は、個人差や加齢によって変化する可能性もあります。実際、人の睡眠パターンは個人や年齢によって異なることが知られており、こうした変化の背景に波形の違いが関わっている可能性も考えられます。今後は、体内時計遺伝子活性の波形の変化を手掛かりに、どの生化学反応が変化しているのかを逆算的に推定するアプローチも期待されます。
本研究では、体内時計の数理モデルだけでなく、電気回路のモデル(van der Polモデル)や動物の個体数のモデル(Lotka–Volterraモデル)においても、それぞれのモデルの変数の振動波形のひずみが周期を長くすることを確認しました。例えば、捕食者と被食者の関係にあるヤマネコとカンジキウサギの個体数は、約10年周期でタイミングをずらして変動します。このとき、捕食やウサギの増加のスピードが大きいほど周期が短くなる傾向がありますが、周期が変わらなかったり長くなったりする場合には、個体数変化の波形がひずんでいることを意味します。
今後、くりこみ群法をさまざまな振動モデルに応用することで、生物系にとどまらず、より一般的な振動現象に共通する普遍的な性質の理解が進むと期待されます。
補足説明
- 1.体内時計
多くの生き物は、約24時間の周期で体のリズムを刻む「体内時計」を持っている。例えば、人間を外の明るさや時刻が分からない洞窟の中に置いても、睡眠と目覚めを約24時間の周期で何日も繰り返す。このように、まるで体の中に時計があるかのように振る舞う仕組みを「体内時計」と呼ぶ。生き物が示すこのような約24時間のリズムのことを「概日リズム(サーカディアンリズム)」という。これまでの研究から、体内時計の実体は、細胞の中で、遺伝子活性(遺伝子からつくられるmRNAの量)や、タンパク質のリン酸化レベル(化学的な修飾の強さ)が、約24時間のリズムで繰り返し変化することだと分かってきている。マイケル・ロスバッシュらのショウジョウバエを使った研究(2017年ノーベル生理学・医学賞受賞)では、あるタンパク質が自らをつくる遺伝子の働きを抑える仕組みが、このリズムの形成に必要であることが示された。同じ仕組みが哺乳類や植物でも共通して働いていると考えられている。 - 2.温度補償性
生物リズムの周期が温度の変化に対して安定していることを、「周期の温度補償性」と呼ぶ。多くの化学反応は、温度が高くなるほど速くなり、例えば細胞分裂の周期も、温度が高いほど短くなることが知られている(そのため、夏場に食べ物を外に置くと、細菌が細胞分裂で増えやすくなり、結果としてその食べ物は腐りやすくなる)。それに対して、体内時計の周期は、環境温度を高温や低温で固定しても、ほとんど変化しない。この温度補償性は、藍藻(らんそう)から植物、昆虫、哺乳類まで、幅広い生物で観察されている現象。恒温動物である哺乳類でも、例えば脳や肝臓の組織を体外に取り出して培養すると、環境温度が25℃でも35℃でも、体内時計の周期(遺伝子の活性変動などの周期)がほとんど変わらないことが知られている。 - 3.数理モデル
複雑な現象の一面を簡略化した形で表現し、微分方程式など数式を用いて記述したシステムのこと。例えば、体内時計の数理モデルでは、遺伝子活性(遺伝子からつくられるmRNAの量)や、タンパク質のリン酸化レベル(化学的な修飾の強さ)を変数として扱う。このモデルには、タンパク質が自らをつくる遺伝子の働きを抑える仕組みや、mRNAやタンパク質がつくられたり分解されたりする過程が含まれており、実際に観測される約24時間周期の遺伝子活性の変動を再現することができる。実際の研究では、体内時計に関わる100種類以上の遺伝子やタンパク質を組み込んだ詳細なシミュレーターから、必要不可欠と思われる変数だけを使った3変数の簡略モデルまで、さまざまなモデルが使われている。これらのモデルは、環境条件や個体差によって周期がどのように変化するかを調べたり、今回のように温度補償性の仕組みを明らかにしたりするために使われている。 - 4.くりこみ群法
本手法は、もともと量子電磁力学などにおける場の量子論の解析技法として発展してきた。本論文で採用しているのは、朝永振一郎(1965年ノーベル物理学賞受賞)らが構築したくりこみ理論および、それを基盤とした摂動的くりこみ群法を土台とし、常微分方程式および偏微分方程式における摂動解を再総和することで、大域的な時間領域に有効な近似解を導くように拡張された枠組みである。この手法は、共同研究グループの國廣特任教授によって1995年に体系化された。この枠組みでは、任意の時刻およびそこでの積分定数をそれぞれ場の量子論における「くりこみ点」および「くりこみ定数」と対応付けることができ、それが時間とともにゆっくりと変化する様子を「くりこみ群方程式」を用いて明示的に抽出できる。そのため、時間的に緩やかに変調する周期解の解析に適しており、本研究においても極めて有効な手段となっている。
研究支援
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業(CREST)「作用素論的データ解析に基づく複雑ダイナミクス計算基盤の創出(研究代表者:河原吉伸、JPMJCR1913)」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(C)「生物リズムと冬眠における周期の決定機構に関する数理・データ解析的アプローチ(研究代表者:黒澤元、JP21K06105)」「汎関数くりこみ群による量子多体系の密度汎関数理論の構築と第一原理計算(研究代表者:國廣悌二、JP19K03872)」「QCD相転移の実験的検証に向けたソフトモードダイナミクスの理論的研究(研究代表者:國廣悌二、JP24K07049)」、同学術変革領域研究(A)「冬眠生物に共通するメカニズムに関する数理・データ解析的アプローチ(研究代表者:黒澤元、JP24H02025)」による助成を受けて行われました。
原論文情報
- Shingo Gibo, Teiji Kunihiro, Tetsuo Hatsuda, Gen Kurosawa, "Waveform distortion for temperature compensation and synchronization in circadian rhythms: An approach based on the renormalization group method", PLOS Computational Biology, 10.1371/journal.pcbi.1013246
発表者
理化学研究所
数理創造研究センター
数理基礎部門
客員研究員 儀保 伸吾(ギボ・シンゴ)
専任研究員 黒澤 元(クロサワ・ゲン)
数理展開部門
部門長 初田 哲男(ハツダ・テツオ)
京都大学 基礎物理学研究所
特任教授 國廣 悌二(クニヒロ・テイジ)
発表者のコメント
理論物理学の方法を使うことで、これまでにできなかった詳細な解析が可能になりました。この研究は体内時計の仕組みに迫るだけでなく、さまざまな振動現象に普遍的な性質を解き明かすと期待しています。(儀保 伸吾)
 儀保 伸吾
儀保 伸吾
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
京都大学 広報室 国際広報班
Tel: 075-753-5729
Email: comms@mail2.adm.kyoto-u.ac.jp
