理化学研究所(理研)生命医科学研究センター ゲノム解析応用研究チームの寺尾 知可史 チームディレクター、デイビッド・オルテガ=レイエス 大学院生リサーチ・アソシエイト(研究当時、現 粘膜システム研究チーム 特別研究員)、粘膜システム研究チームの大野 博司 チームディレクターらの共同研究グループは、欧州でしか研究されてこなかったヒト遺伝子が腸内細菌叢(さいきんそう)[1]の構成に与える影響について、東京大学医学部附属病院の人間ドックを受診した集団で検討し、ヒト遺伝子と腸内細菌叢の新たな相互作用を発見しました。
本研究は、遺伝子変異の腸内細菌叢への影響を明らかにしただけでなく、これらの相互作用を正確に理解するためには標準化された手法が重要であると示したことで、今後の研究の指針となることが期待されます。
共同研究グループはまず、特定の細菌種と関連する遺伝子変異を同定しました。例えば、嗅覚に関与する嗅覚受容体の遺伝子であるOR6C1遺伝子の変異は腸内細菌の一種「バクテロイデス・ユニフォルミス(Bacteroides uniformis)」の増加と有意に関連しており、日本に在住するアジア人(集団)における腸内細菌の多様性や機能を形成する潜在的な遺伝的メカニズムが示唆されました。また、本研究は、頑健で再現性のある結果を得るための統計的厳密性の重要性、ならびにサンプル処理や解析方法の違いが研究結果に大きく影響することから、腸内細菌叢研究における手法の標準化の必要性を強調しています。
本研究は、科学雑誌『Frontiers in Microbiomes』(10月14日付:日本時間10月14日)に掲載されました。

腸内細菌の多様性や機能を形成する潜在的な遺伝的メカニズム
背景
腸内細菌叢は、人間の消化器系に存在する複雑な微生物群集であり、健康や疾病において重要な役割を果たしています。食事や薬剤などの環境要因が腸内細菌叢に影響を与えることは知られていますが、近年の研究では宿主の遺伝子もその構成に影響を及ぼすことが示されています注1)。例えば、双子を対象とした研究では、遺伝的類似性が共通の微生物群集をもたらすことが明らかになっています注2)。しかし、これらの研究の多くは欧州で行われており、日本を含む東アジアなどに住む他の民族集団における遺伝子と腸内細菌叢の関係については理解が十分に進んでいません注3)。
腸内細菌叢の研究は、その複雑さに加え、サンプルの保存方法や処理方法など外的要因の影響を受けやすく、結果の再現性が得られにくいという課題があります。さらに、腸内細菌叢のデータを統計的に解析することも容易ではありません。例えば、ある細菌種はごく一部の個体にしか存在しないため、そのデータは連続的な測定値というよりも「オン/オフ」の二値的な特徴として扱う必要があります。本研究では、このような二値的特徴を特別な統計モデルで扱うことで、より正確な解析を可能にしました。高度な遺伝解析技術と慎重な統計的手法を組み合わせることで、本研究は腸内細菌叢の構成を形成する複雑な相互作用の解明を目指しました。
- 注1)Kho ZY, Lal SK. The Human Gut Microbiome - A Potential Controller of Wellness and Disease. Front Microbiol. 2018; 9:1835.
- 注2)Goodrich JK, Waters JL, Poole AC, Sutter JL, Koren O, Blekhman R, et al. Human genetics shape the gut microbiome. Cell. 2014;159(4): 789-99.
- 注3)Davenport ER, Cusanovich DA, Michelini K, Barreiro LB, Ober C, Gilad Y. Genome-Wide Association Studies of the Human Gut Microbiota. PLoS One. 2015;10(11): e0140301
研究手法と成果
共同研究グループは、東京大学医学部附属病院予防医学センターを受診した20歳から75歳までの成人306人を対象とし、血液細胞の遺伝子および便サンプルを用いた腸内細菌叢の解析を行いました。データの品質チェックをして、296人分のデータと約1,300万個の遺伝的マーカーを選び、ショットガンメタゲノムシーケンシング法[2]を使って腸内細菌叢を解析し、227種類の細菌およびそれらに関連する機能的経路の同定と定量を行いました。
遺伝子と腸内細菌の関係を調べるため、ゲノムワイド関連解析(GWAS)[3]を使って一般的な遺伝的変異と細菌の存在量との定量的な関連を解析しました。具体的には、細菌の分布が正規分布[4]に近い場合は線形回帰分析[5]を適用し、まれな細菌や存在・非存在の二値的なパターンを示す細菌については、二値化手法としてロジスティック回帰分析[6]を用いました。この結果、腸内細菌叢に対する遺伝的影響を明らかにするために適切な統計処理が可能となりました。
GWASの最も注目すべき発見の一つは、PAX5遺伝子[7]の一つの遺伝的変異と、特定のクロストリジウム(Clostridiales)目細菌の存在との関連でした。この遺伝子変異を持つ人は持たない人と比較して、腸内にこの細菌を有する確率が約5倍高いことが分かりました。PAX5遺伝子は免疫細胞の発生に重要な役割を果たしており、免疫機能と腸内細菌との関連が示唆されます(図1)。しかし、この関連は、多数の遺伝的変異を解析する上で必要な多重検定補正(多くの検定に起こり得る過誤を防ぐための調整)を行った後には、統計的有意差が維持されませんでした。これはGWASにおける一般的な課題を浮き彫りにしています。多くの関連が当初は有意義なものと捉えられるものの、厳密な統計的補正を行うと真に有意な結果として残るものは減少し、生物学的な関連性を確認するためには慎重な解釈と実験による裏付けなどのさらなる機能的検証が必要です。
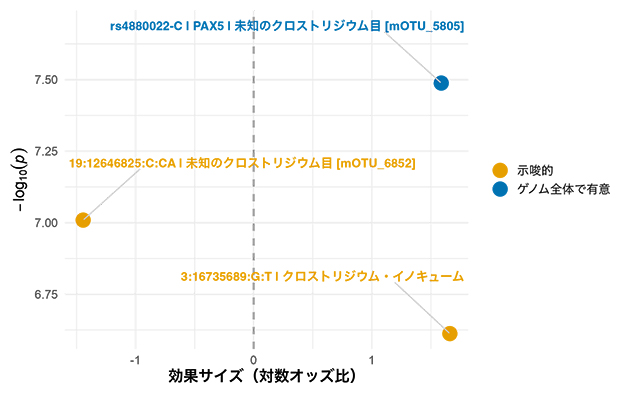
図1 二値型(GWAS)によって特定された腸内細菌と遺伝子の関連
図は、ヒトの特定の遺伝的変異が特定の腸内細菌の存在とどのように結び付いているかを示している。各点は、細菌種との関連を調べた遺伝的変異を表し、x軸(横軸)がその効果の大きさ、y軸(縦軸)が証拠の強さを示す。青い点は統計的に有意な関連を示し、オレンジの点は示唆的な関連を示す。最も注目すべき発見は、PAX5遺伝子の変異が未知のクロストリジウム(Clostridiales)目細菌の存在と強く関連していることである。オッズ比はある事象の起こりやすさの比率。
次に、共同研究グループは、特定の高影響遺伝子変異が多くの細菌種に及ぼす影響を調べるために、フェノームワイド関連解析(PheWAS)[8]を実施しました。この解析により、OR6C1遺伝子のフレームシフト変異[9]が、複雑な炭水化物の消化や健康な免疫系の維持に関与する有益な腸内細菌であるバクテロイデス・ユニフォルミス(Bacteroides uniformis)の増加と関連していることが明らかになりました。この変異は他のバクテロイデス(Bacteroides)属菌にも影響を及ぼす可能性が示されており、この重要な細菌群に対する広範な影響が示唆されます。興味深いことに、OR6C1遺伝子は嗅覚に関与する嗅覚受容体をコードしていますが、腸内でも何らかの役割を持つ可能性が示唆されました。
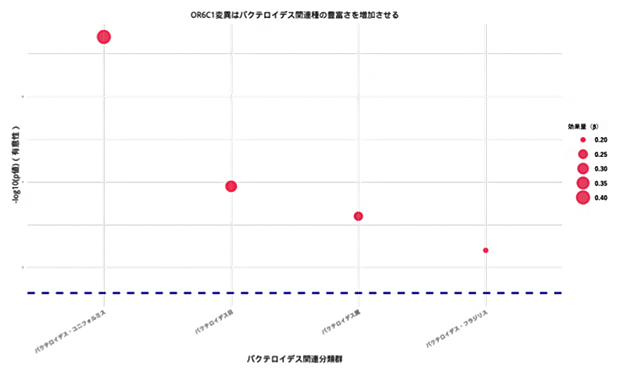
図2 OR6C1変異体(rs5798345-CA)がバクテロイデス(Bacteroides)に与える影響
OR6C1変異体(rs5798345-CA)は、バクテロイデス・ユニフォルミス(Bacteroides uniformis)の増加と有意に関連する(ベータ値(過誤の確率)=0.394、p(有意水準)≤4.78×10-8)。また、他のバクテロイデス(Bacteroides)属菌に対しても統計的にはやや弱いものの正の関連を示す。これらはすべて、この変異体の存在とバクテロイデス属菌の増加という点で一致している。
また、この研究では、解析手法の違いが腸内細菌叢研究の結果に大きな影響を与えることも明らかになりました。日本における既報の研究と比較したところ、主に便サンプルの保存方法やDNA抽出方法の違いにより、再現性が限定的であることが判明しました。これらの方法論の違いは、バクテロイデスやビフィズス菌(Bifidobacterium)などの主要な細菌群の存在量の測定値に大きな差異をもたらしました。このことは、腸内細菌叢研究の結果を信頼性高く比較するためには、標準化された測定プロトコルの確立が緊急に求められていることを示しています。
最後に、中国南東部や台湾、韓国、日本、シンガポールなど東アジアに定住してきた人種に多く見られ、アルコール代謝に影響を与えることで知られるALDH2遺伝子上の遺伝子多型(rs671)遺伝子変異が、炭水化物摂取とインスリン抵抗性(2型糖尿病のリスク因子)の関係性に影響を与えるかどうかを検討しました。その結果、rs671遺伝子変異を持つ人と持たない人では炭水化物の影響が異なる可能性が示唆され、これは腸内細菌叢や炎症性サイトカインの変化を介している可能性がありました。ただし、これらの結果はあくまで予備的であり、より大規模かつ多様な集団でのさらなる研究が必要です。
今後の期待
腸内細菌叢への遺伝的影響を研究するためには、研究者が一貫した方法論と慎重な統計解析を用いることが重要です。私たちの遺伝子は腸内にどの細菌が存在するかを大きく左右することが示唆されましたが、これらの発見の信頼性を高めるためには、存在・非存在の二値的な細菌だけでなく、量的に変動する細菌も正確に同定する必要があります。強力な統計手法を用いることで、これら異なるタイプの細菌を正しく解析し、結果の信頼性を高めることができます。また、サンプルの採取や処理方法による差異を減らすために、研究間で標準化された手順を用いることも不可欠です。遺伝と環境の両方が腸内細菌に影響を与えるため、複雑な関係性となっていますが、一貫した方法論はこれらをより深く理解する助けとなります。研究が進むにつれて、慎重かつ統一されたアプローチが、遺伝的発見を健康改善の新たな手段へとつなげる鍵となるでしょう。
共同研究グループは、本研究が微生物叢研究における方法論の標準化と統計的厳密性の重要性を強調し、将来の微生物叢研究の基盤を築くものと期待しています。
補足説明
- 1.腸内細菌叢(さいきんそう)
消化器系に生息する細菌などの微生物の集まり。 - 2.ショットガンメタゲノムシーケンシング法
環境中(腸内細菌を解析する場合はふん便)の微生物由来DNAを網羅的にシーケンシングすることで、微生物の種類のみならずその遺伝子機能を調べることが可能な解析方法。 - 3.ゲノムワイド関連解析(GWAS)
ヒトゲノム全体を対象にそのゲノムDNA配列を比較解析することで、特定の形質や疾患に関連する遺伝的変異を探索する研究手法。GWASはgenome-wide association studyの略。 - 4.正規分布
多くの値が平均付近に集中し、ベル型の曲線を描くデータの分布。 - 5.線形回帰分析
二つの変数間の関係を直線で表す統計手法。 - 6.ロジスティック回帰分析
一つ以上の要因から「はい/いいえ」の結果を予測する統計手法。 - 7.PAX5遺伝子
B細胞分化に必須の転写因子Pax5の遺伝子。さまざまなB細胞関連遺伝子の発現や免疫グロブリン遺伝子の再構成などに関わるB細胞生成のマスター遺伝子である。PAX5遺伝子の変異や転座はB細胞急性リンパ性白血病を引き起こすことが知られている。 - 8.フェノームワイド関連解析(PheWAS)
一つの遺伝子変異と多様な形質や疾患との関連を調べる研究。PheWASはphenome-wide association studyの略。 - 9.フレームシフト変異
タンパク質を構成するアミノ酸は三つのDNA塩基の組み合わせにより決まるが、フレームシフト変異とは一つないし複数の塩基が挿入あるいは欠失することでこの読み枠(コドン)がずれる遺伝子変異で、異なるアミノ酸配列に変わってしまうことでタンパク質に大きな変化をもたらすことが多い。
共同研究グループ
理化学研究所 生命医科学研究センター
ゲノム解析応用研究チーム
チームディレクター 寺尾 知可史(テラオ・チカシ)
大学院生リサーチ・アソシエイト(研究当時)デイビッド・オルテガ=レイエス(David Ortega-Reyes)
(現 粘膜システム研究チーム 特別研究員)
研修生 岩見 卓朗(イワミ・タクロウ)
上級技師 冨塚 耕平(トミヅカ・コウヘイ)
腎・代謝・内分泌疾患研究チーム(研究当時)
チームリーダー(研究当時)堀越 桃子(ホリコシ・モモコ)
(現 ゲノム解析応用研究チーム 客員主管研究員)
粘膜システム研究チーム
チームディレクター 大野 博司 (オオノ・ヒロシ)
特別研究員(研究当時)竹内 直志(タケウチ・タダシ)
上級研究員(研究当時)窪田 哲也(クボタ・テツヤ)
(現 粘膜システム研究チーム 客員研究員)
マイクロバイオーム研究チーム(研究当時)
研究員(研究当時)緒方 勇亮(オガタ・ユウスケ)
副チームリーダー(研究当時)須田 亙(スダ・ワタル)
(現 共生微生物叢研究チーム チームディレクター)
熊本大学 大学院生命科学研究部 代謝内科学講座
教授 窪田 直人(クボタ・ナオト)
虎の門病院
院長 門脇 孝(カドワキ・タカシ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業基盤研究(A)「エンハンサーの遺伝的発現制御の解明による免疫疾患解析(JP20H00462、研究代表者:寺尾知可史)」「宿主ー腸内細菌叢相互作用が宿主の病理に及ぼす影響の研究(JP22H00452、研究代表者:大野博司)、日本医療研究開発機構(AMED)難治性疾患実用化研究事業「シングルセル統合ゲノミクス解析が解き明かす強皮症の病態基盤の開発(22ek0109555、研究代表者:寺尾知可史)」、同ゲノム医療実現推進プラットフォーム・先端ゲノム研究開発「先天的/後天的構造多型に着目した免疫/精神疾患病態解明に関する研究開発(21tm0424220、研究代表者:寺尾知可史)」、同革新的がん医療実用化研究事業「体細胞モザイクのがん発症および予後因子としての意義解明の開発(21ck0106642、研究代表者:寺尾知可史)」、ムーンショット型研究開発事業「健康寿命伸長に向けた腸内細菌動作原理の理解とその応用(プロジェクトマネージャー:本田賢也、分担者:大野博司、22zf0127007)」の助成を受けて実施されました。
原論文情報
- David Ortega-Reyes, Tadashi Takeuchi, Yusuke Ogata, Takuro Iwami, Wataru Suda, Tetsuya Kubota, Naoto Kubota, Takashi Kadowaki, Kohei Tomizuka, Hiroshi Ohno, Momoko Horikoshi, Chikashi Terao, "Interplay between host genetics and gut microbiome composition in the Japanese population", Frontiers in Microbiomes, 10.3389/frmbi.2025.1635907
発表者
理化学研究所
生命医科学研究センター ゲノム解析応用研究チーム
チームディレクター 寺尾 知可史(テラオ・チカシ)
大学院生リサーチ・アソシエイト(研究当時)デイビッド・オルテガ=レイエス(David Ortega-Reyes)
(現 粘膜システム研究チーム 特別研究員)
粘膜システム研究チーム
チームディレクター 大野 博司(オオノ・ヒロシ)
 デイビッド・オルテガ=レイエス
デイビッド・オルテガ=レイエス
 大野 博司
大野 博司
 寺尾 知可史
寺尾 知可史
報道担当
理化学研究所 広報部 報道担当
お問い合わせフォーム
