2009年5月1日
独立行政法人 理化学研究所
生殖細胞誕生シグナルの解明と生殖細胞の試験管内誘導
―多能性幹細胞から始原生殖細胞が誕生するシグナル機構を解明、試験管内で再構成―
ポイント
- 発生6日頃の胚体外胚葉はBmp4シグナルでほとんど始原生殖細胞に分化
- 試験管内の誘導で胚体外胚葉から世界で初めて機能的な生殖細胞を生み出す
- マウスに移植した始原生殖細胞は、健常な精子に分化、健常な子孫を形成
要旨
独立行政法人理化学研究所(野依良治理事長)は、ほ乳類の代表的モデル生物であるマウスを用いて、精子および卵子の源となる始原生殖細胞の誕生に関与するシグナル機構を解明し、その原理に基づいて、試験管内で高い効率・再現性で、胚体外胚葉※1から始原生殖細胞を誘導することに世界で初めて成功しました。誘導した始原生殖細胞は、新生マウスの精巣に移植すると健常な精子に分化し、それらは健常な子孫を形成しました。これは、発生・再生科学総合研究センター(竹市雅俊センター長)哺乳類生殖細胞研究チームの斎藤通紀チームリーダー、大日向康秀研究員らによる成果です。
私たち人類を含む多細胞生物を構成する細胞群の中で、生殖細胞は、新しい個体を形成し、次世代に遺伝情報を継承しうる唯一の細胞系列です。研究チームはこれまで、ほ乳類の代表的モデル生物であるマウスを用いて、精子および卵子の源となる始原生殖細胞の誕生に関与する遺伝子群を明らかにしてきました。今回、胚体外胚葉でそれら遺伝子群の発現が誘導されるメカニズムを詳細に解析し、始原生殖細胞誕生のシグナル原理を明らかにしました。また、その原理に基づき、培養した胚体外胚葉から高い効率・再現性で、正しい遺伝子発現と正しい後成的ゲノム修飾※2を有する始原生殖細胞を誘導することに成功しました。さらに、誘導した始原生殖細胞は、マウス新生児の精巣に移植すると健常な精子に分化し、それらは健常な子孫を形成することを証明しました。
本研究の成果は、ES細胞をはじめとする多能性幹細胞から、正常に機能する生殖細胞を試験管内で誘導する実験の、非常に重要な基盤となります。多能性幹細胞からの生殖細胞系列の誘導は、生殖医工学、再生医学の発展に大きく寄与することが期待できます。
本研究成果は、米国の科学雑誌『Cell』(2009年5月1日号)に掲載されます。
背景
ヒトを含む多細胞生物は、ほぼすべての細胞が一代で死滅する、限りある存在です。生殖細胞は、世代を越えてゲノム情報を伝える特別な細胞で、有性生殖を行ってきた動植物において生命の永続性を保証し続けています。そこには少なくとも、①細胞レベルで必ず起こる老化現象を能動的にくい止め、幾世代にもわたり受け継がれてきた遺伝情報を理想的には完全な状態で維持する、②究極に分化した生殖細胞である卵子と精子が融合した際に、個体を形づくる発生プログラムが滞りなく進むように、生殖細胞自身の遺伝情報をプログラムする、という2つの基本的な仕組みが埋め込まれています。この2つの仕組みを解明し、その原理に基づいて生殖細胞の発生を再現することは、生物学の大きな目標となっています。しかし、この過程は、さまざまな基盤現象(運命決定、ゲノム再編、増殖、性決定、減数分裂、成熟)を伴う非常に複雑なもので、全過程の分子基盤を正確に理解し、再現するには、それぞれの過程を通した緻密(ちみつ)な研究が必要となります。
ES細胞を代表とする多能性幹細胞から、機能的に正しい生殖細胞を選択的に誘導することは、この目標達成の第一歩であると考えられます。これまで世界中のさまざまな研究者が、ES細胞から生殖系列の細胞を誘導する研究を行ってきました。その研究の究極の目標の一つは、厳しい倫理的制約をした上で、誘導した生殖細胞を不妊治療などの生殖医療や再生医療に用いることにあります。しかし、いまだ実験レベルですら機能的な(子孫を形成しうる)生殖細胞の作製に成功した例はありません。これは、生殖細胞の発生過程が十分に理解されておらず、ES細胞を起点として論理的に生殖細胞を誘導することが不可能であったためです。また、誘導された細胞がどの程度正しいものであるかを判断する基準が乏しかったことも原因と考えられています。
研究チームは、ほ乳類の代表的モデル生物であるマウスの発生過程で、生殖細胞と体細胞が分離する機構や、それに伴って生殖細胞が獲得する特性を理解することを研究の出発点としています。これまでに、生殖細胞だけが持つゲノム情報の再編・継承、全能性維持・再獲得の機構を理解するとともに、それらを再構成し、ES細胞を代表とする多能性幹細胞から生殖細胞系列を正確に誘導する研究に取り組んできました(2008年6月15日プレス発表、2008年7月12日プレス発表)。今回の研究では、始原生殖細胞を誘導するシグナル機構の解明とその再構成に挑みました。
研究手法
発生6日目頃のマウス胚は、胚体外胚葉(epiblast, Epi)、胚体外外胚葉(extraembryonic ectoderm, ExE)、胚体外臓側内胚葉(visceral endoderm, VE)から構成される円筒状の形態を呈しています(図1)。このうち、胚体外胚葉から、生殖細胞を含む体(胎児)を構成するあらゆる細胞が、形成されていきます。これまでの研究から、胚体外外胚葉や胚体外臓側内胚葉は、胚体外胚葉のパターン形成に関与するシグナルを発することが分かっています。すなわち、胚体外外胚葉や胚体外臓側内胚葉からのシグナルにより、胚体外胚葉のどの部分が、頭や心臓、手足、あるいは生殖細胞になるかが決まると考えられています。胚体外胚葉のパターン形成に関与するシグナル分子を人為的に欠損させたマウス(遺伝子ノックアウトマウス※3)を用いたこれまでの実験から、胚体外外胚葉から発せられるBmp4やBmp8bといったシグナル分子や、そのシグナルを伝達するSmadという因子が、精子や卵子の源となる始原生殖細胞の形成に必須であることが知られています。一方、研究チームはこれまでに、始原生殖細胞は、胚体外胚葉の最も近位部(胚体外外胚葉と接する位置)後方寄りに、Blimp1およびPrdm14という遺伝子を発現する細胞として形成されることを明らかにしてきました。今回、Bmp4やBmp8bを含む胚体外胚葉のパターン形成に関与するシグナル分子のノックアウトマウスで、Blimp1やPrdm14の発現がどのように影響されるのかを、それぞれのノックアウトマウスとBlimp1やPrdm14の発現を蛍光タンパク質の発現によりモニターできるトランスジェニックマウス※4(発現モニターマウス)を組み合わせる(交配させてその胚を観察する)ことで調べました。さらに、胚体外胚葉を試験管内で培養しBmp4やBmp8bなどのシグナル分子を添加することで、Blimp1やPrdm14の発現が誘導されるかどうかを検証しました。
研究成果
(1)始原生殖細胞を誘導するシグナル機構の解明とその再構成
ノックアウトマウスと発現モニターマウス交配実験の結果、始原生殖細胞の形成に必須な遺伝子であるBlimp1およびPrdm14の発現は、胚体外外胚葉からのシグナル分子Bmp4により直接誘導されることが分かりました。一方で、前方臓側内胚葉(anterior visceral endoderm, AVE)から発せられる後方化抑制シグナル(後方化抑制シグナルはBmp4も抑制する)を欠損する変異胚(AVEを欠損するノックアウトマウス)では、Blimp1およびPrdm14の発現が前方側さらには遠位部にも大きく拡大しており、正常胚でBlimp1およびPrdm14の発現が胚体外胚葉の後方に偏るのは、後方化抑制シグナルの影響であることが分かりました。さらに、胚体外外胚葉や胚体外臓側内胚葉を取り除き、胚体外胚葉だけを、血清やフィーダー細胞を含まない化学的に厳密に定義された培養条件で、Bmp4を加えて培養すると、ほとんどすべての胚体外胚葉細胞がBlimp1およびPrdm14を発現し、始原生殖細胞様細胞に分化することを突き止めました(図2上)。これらの結果は、発生6日目頃の胚体外胚葉細胞は、十分な量のBmp4シグナルを与えることで、ほとんどすべて始原生殖細胞に分化する能力を有することを示しました。
(2)誘導した始原生殖細胞様細胞は健常な精子に分化し、子孫を形成
胚体外胚葉から誘導した始原生殖細胞様細胞は、免疫蛍光染色※5やRT-PCR解析※6の結果、生体内の始原生殖細胞に特徴的な遺伝子発現や後成的ゲノム修飾を備えていることが分かりました。
さらに、誘導した始原生殖細胞様細胞が、生殖細胞として正しく機能するかどうかを検証するため、これらの細胞を、生殖細胞を持たない新生マウス※7(生後1週間)の精巣に移植しました。マウスの成長を待ち、その精巣を調べた結果、移植した誘導始原生殖細胞様細胞由来の精子(蛍光顕微鏡下で、緑色蛍光タンパク質GFPの発現を見ることにより識別できる)が形成されていることが分かりました。この精子は、正常卵子との顕微授精の結果、正しい発生を誘導し、健常で生殖能力を有する子孫を形成することを明らかにすることができました(図2下)。
この成果は、多能性幹細胞(この場合は胚体外胚葉)から機能的な生殖細胞を試験管内で誘導した世界で初めての成果となります。
今後の期待
本研究成果により、生殖細胞系列の細胞を試験管内で選択的に誘導する研究の論理的基盤が非常に強固なものとなったといえます。ES細胞やiPS細胞から生殖細胞を論理的に誘導することはこれまで困難でしたが、今回の結果は、ES細胞やiPS細胞をまず胚体外胚葉様細胞へ誘導させることができると、それらから始原生殖細胞様細胞も誘導できることを示しました。本研究で開発した実験系をさまざまな方向に展開することで、生殖細胞形成過程の試験管内再構成がさらに高い精度で行えるようになると期待できます。さらに、これらの研究が、生殖細胞の発生機構解明への重要な貢献をするとともに、究極的には、厳しい倫理的制約をした上で、誘導した生殖細胞が、不妊治療を含む生殖医療・再生医療に用いられる研究の基盤となると注目されます。
発表者
理化学研究所
発生・再生科学総合研究センター 哺乳類生殖細胞研究チーム
チームリーダー 斎藤 通紀(さいとう みちのり)
Tel: 078-306-3376 / Fax: 078-306-3377
お問い合わせ先
神戸研究推進部 広報国際化室南波 直樹(なんば なおき)
Tel: 078-306-3092 / Fax: 078-306-3090
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.胚体外胚葉
生殖細胞を含む体を構成するすべての細胞の前駆細胞となる細胞(図1参照)。 - 2.後成的ゲノム修飾
ゲノムの持つ遺伝情報は、第一義にはDNAの塩基配列(A, T, G, C)を指す。生体内のゲノムDNAは、ヒストンというタンパク質に巻きついた状態でコンパクトに折り畳まれた状態で存在している(このような構造をクロマチンと呼ぶ)。さらにこのヒストンやDNA自身が化学的修飾を受けることなどにより、遺伝子発現がさまざまに制御されている。このようなヒストンやDNAの化学的修飾を、塩基配列の1次情報に対し、後成的修飾と呼ぶ。生殖細胞は後成的ゲノム修飾を再編成することで、全能性の再獲得を行っていると考えられている。 - 3.遺伝子ノックアウトマウス
特定の遺伝子の機能を知るために、その遺伝子を人工的にゲノムから取り除いたマウス。ある遺伝子の機能を知るためには、その遺伝子を持たない動物(マウス)がどうなるのかを調べることが最も効率的である。そのような目的で作製された動物を遺伝子欠損(ノックアウト)マウスと呼ぶ。本研究では主に胎生期の遺伝子欠損マウス(遺伝子欠損マウス胚)を解析に用いた。マウスやヒトは、染色体(マウスは20本、ヒトは23本)を2セット持っている。これは両親から1セットずつ受け継いだものである。2本の染色体のうち、片方の染色体(アレルという)の遺伝子を欠損したマウス(ヘテロマウス)の雌雄を掛け合わせると、4分の1の確率で両方の染色体の遺伝子を欠損したマウス(ホモマウス)が得られる。胎生期の遺伝子欠損マウスの解析には、ヘテロマウスを掛け合わせた時のホモマウス胎仔を用いた。 - 4.トランスジェニックマウス
特定の遺伝子の機能や発現パターンを解析することを目的として、種々の遺伝子操作を行い、マーカー遺伝子を導入したマウス。本研究では、蛍光タンパク質が Blimp1および Prdm14遺伝子の発現を再現できるように設計したDNAを染色体に組み込み、 Blimp1および Prdm14遺伝子発現細胞を蛍光タンパク質で可視化したトランスジェニックマウスを作製し、使用した。 - 5.免疫蛍光染色
細胞や組織におけるタンパク質を検出するために広く用いられる手法。抗体の持つ特性を利用し、また抗体に蛍光色素を結合させて検出するため、免疫蛍光染色法と呼ばれる。検出したいタンパク質に対する抗体(1次抗体)を作製し、ホルマリンなどで固定した組織や、その切片に抗体を反応させる。すると抗体は、目的タンパク質にのみ結合する。抗体をあらかじめ蛍光色素などでラベルしておけば、タンパク質の存在するところだけが蛍光などを発するので、組織の中のどの細胞がそのタンパク質を発現しているか、あるいは細胞の中のどこにそのタンパク質が局在しているかを知ることができる。より広く用いられる方法としては、抗体を認識する抗体(2次抗体)を蛍光色素などでラベルして、1次抗体と反応させ、蛍光を顕微鏡などで検出する。 - 6.RT-PCR解析
ヒトを含めた多細胞生物では、ほぼすべての細胞が同じ遺伝情報(ゲノム)を保持している。私たちの生命が多様な細胞によって支えられているのは、それぞれの細胞種で働く遺伝子が異なるからである。遺伝子が働くためには、ゲノムDNAの中の特定の遺伝子をコードする部分をコピーすることにより、1次的な産物である「メッセンジャーRNA(mRNA)」が作られ、さらにそのmRNAに対応するタンパク質が作られなければならない。ある遺伝子からmRNAが作られることを「遺伝子が発現する」という。「どの遺伝子が、どの程度の量、発現しているか」という「遺伝子発現パターン」は細胞の個性を知るために有用な情報である。
遺伝子の1次的産物であるmRNAは、そのままでは分子生物学的な解析に不向きで、mRNAを鋳型にして、より解析に適したDNAへと変換して解析を行うことが一般的である。このmRNAからDNAへの変換をReverse Transcription(RT)と呼ぶ。一方、DNAの集団の中から、特定のDNAだけを増幅する技術をPolymerase Chain Reaction (PCR)と呼ぶ。これらの技術を利用して、ある細胞集団に発現しているmRNAをDNAに変換し、その中に存在するDNAをPCRにより検出する方法をRT-PCRと呼ぶ。この方法を用いると、ある細胞集団中に特定の遺伝子(たとえば Blimp1)が存在しているか否かを知ることができる。 - 7.生殖細胞を持たない新生マウス
古くから研究されてきた自然変異マウスの中に、ホモ(※3参照)にすると生殖細胞を形成しないマウスが複数系統存在する。その中の一つに W/ Wマウスという系統がある。このマウスの原因変異遺伝子は Kitという遺伝子で、生殖細胞や血液細胞、色素細胞などの発生に重要な因子であることが分かっている。ホモにすると色素細胞が形成されないことから毛色が真っ白になり、ホモ個体として識別できる。ホモ個体は生殖細胞の形成も起こらず、その精巣には基本的に生殖細胞は存在しない。従ってこの精巣に生殖細胞を移植し、精子が形成されると、その精子は基本的にドナー由来のものと判別される。始原生殖細胞は新生 W/ Wマウスの精巣に移植すると効率よく精子に分化することが知られている。
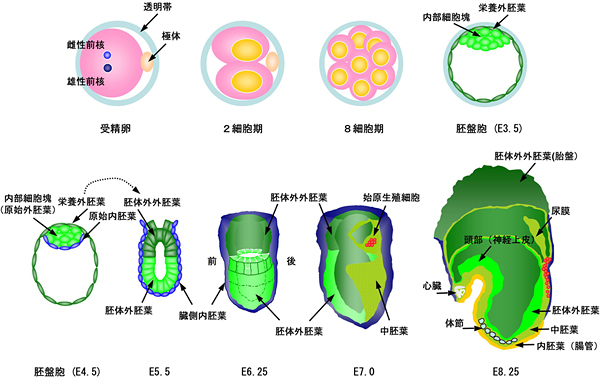
図1 マウスの発生初期と始原生殖細胞形成の模式図
マウスの発生は雌由来の卵子と雄由来の精子の結合によって開始する。マウスの初期胚において最初に分化する細胞は、8~16細胞期に現れる胚の外側を覆う栄養外胚葉である。栄養外胚葉は将来、胎仔側の胎盤を形成する。発生3.5日目(E3.5)になると胚は内腔を生じ、胚盤胞を形成する。内部の細胞は内部細胞塊と呼ばれる。E4.5には、内部細胞塊は原始外胚葉と原始内胚葉に分化する。原始外胚葉は分化多能性を維持し、将来胎仔を形成するすべての細胞の源となる。E5.5には原始外胚葉の内側の細胞は細胞死を起こし、胎児側の原始内胚葉である臓側内胚葉と接する一層の上皮様の構造、胚体外胚葉を形成する。始原生殖細胞は胚体外胚葉の最も近位部の後部側から生じ、原腸陥入に伴い、胚体外中胚葉尿膜基底部においてクラスターを形成する(E7.0)。その後、始原生殖細胞は遊走を開始し(E8.25)、内胚葉から生じた後腸を通ってE10.5頃に生殖隆起に入り、そこで生殖細胞としての成熟を遂げる。
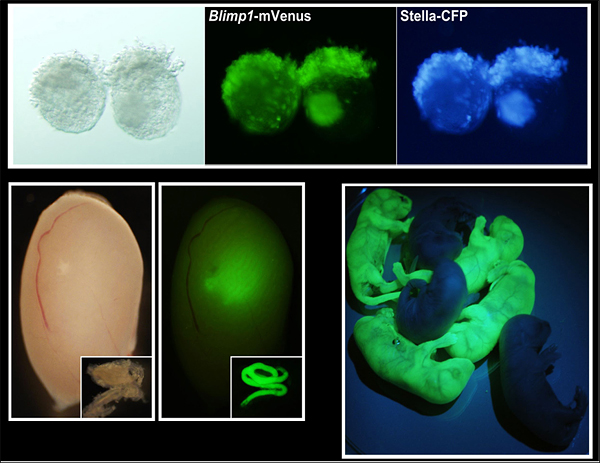
図2 胚体外胚葉より誘導された始原生殖細胞様細胞とその精子への分化、子孫形成
(上左)胚体外胚葉にBMP4を加えて、本研究により決定された条件下で132時間培養した状態。明視野の写真。
(上中、上右)生殖細胞で特異的に発現するBlimp1とstella遺伝子の発現を、蛍光タンパク質であるVenusとCFPによってモニターするトランスジェニックマウス由来の胚を用いて観察した。胚体外胚葉のほとんどが始原生殖細胞様になっていることが分かる。
(下左)誘導した始原生殖細胞様細胞を、生殖細胞が欠損している新生マウスの精巣に移植して10週間後の写真。緑色蛍光タンパク質GFPを発現する誘導始原生殖細胞様細胞由来の精子形成が行われているのが分かる。
(下右)形成された精子から生まれた新生マウス。精子は形成される過程で半数体となるため、半分がGFPを発現する。
