2009年11月12日
独立行政法人 理化学研究所
腸管免疫応答に重要な細菌認識受容体を世界に先駆けて発見
-効果的な感染症・アレルギーに対する経口ワクチンの開発に期待-
ポイント
- 腸管上皮細胞のM細胞で特異的に発現する「GP2」が、細菌受容体として機能発揮
- GP2による細菌の取り込みが、迅速に腸管免疫応答を誘導
- 粘膜免疫の主役「IgA」産生を誘導する経口投与の粘膜ワクチン誕生に道
要旨
独立行政法人理化学研究所(野依良治理事長)は、特殊な腸管上皮細胞として知られるM細胞※1で特異的に発現するGP2※2というタンパク質が、細菌などの抗原を積極的に取り込み、腸管免疫応答の誘導に重要な役割を果たす細菌受容体であることを世界に先駆けて明らかにしました。免疫・アレルギー科学総合研究センター(谷口克センター長)免疫系構築研究チームの大野博司チームリーダー、長谷耕二研究員や横浜市立大学大学院生命ナノシステム科学研究科免疫生物学研究室を中心とする共同研究グループ※3による研究成果です。
腸管内には、私たちの身体を構成するすべての細胞の数よりも、はるかに多い膨大な数の細菌が常在菌としてすみ着いています。さらに食事の際には、食べ物とともに病原性の微生物を含む種々の微生物が侵入してきます。そこで、体は、腸管免疫系と呼ばれる免疫系を発達させ、生体防御機能を高めてきました。腸管免疫系は、どのような微生物が腸管の中で活動しているかを常に監視し、必要に応じてこれらに対して適切に応答することで、病原体を排除したり腸内細菌バランスを維持したりしています。このシステムは「腸管の免疫監視」と呼ばれています。腸管免疫を担うリンパ組織(腸管関連リンパ組織)を覆う上皮細胞層には、M細胞と呼ばれる特殊な細胞が存在しています。このM細胞を介して腸管内の微生物の一部が免疫組織に取り込まれ、腸管免疫応答が誘導されると考えられていますが、その詳しいメカニズムについては長い間不明でした。
研究グループは、M細胞の表面にGP2というタンパク質が特異的に存在し、このGP2が腸内の常在菌である大腸菌や、病原菌であるサルモネラ菌を捕捉して、腸管の免疫組織に受け渡すことを明らかにしました。GP2の欠損したマウスでは、これらの細菌に対する適切な免疫応答が起こらないため、GP2は腸管の免疫監視に重要な分子であることが分かりました。さらに、このようなGP2の性質を制御することで、これまでほとんど成功していない、種々の病原性細菌やウイルス、さらにはアレルギー症状の軽減に効果的な、注射によらない「経口ワクチン」の開発が期待できます。
本研究成果は、科学雑誌『Nature』(11月12日号)に掲載されます。
背景
微生物や細菌などの異物と接する生体内外の境界は、皮膚や粘膜によって保護されています。体表面を覆う表皮は、重層する表皮細胞や角質層によって比較的堅牢な防壁を形成して、異物の侵入を食い止めています。一方、粘膜面の多くは、単層の粘膜上皮細胞で覆われているだけで、脆弱な防御機能しか持ち合わせていません。さらに、粘膜面の中でも特に腸管粘膜は、その主たる機能である栄養や水分の吸収効率を高めるために、約400m2にも及ぶとされる広い表面積を持ち、食物抗原や、食物とともに摂取される外来微生物、100兆個にも及ぶ腸内常在細菌叢などの異物に常にさらされています。実際、粘膜面は、多くの感染症を伴う病原微生物の初期侵入経路になっています。このため、腸管免疫系に代表される粘膜の免疫系は、これら病原体の感染から個体を守る際の最前線として最も重要な働きをしています。
腸管は、体内の全末梢免疫細胞の、実に60~70%を擁する体内最大の末梢免疫組織です。腸管免疫系は、脾臓や末梢リンパ節を中心とする全身免疫系とは異なる独自の免疫系を構築しています。この腸管免疫系は、パイエル板※4に代表される腸管関連リンパ組織を形成し、腸管内腔から上皮細胞層を介して直接抗原の供給を受け、免疫応答を引き起こします。腸管関連リンパ組織を覆う上皮細胞層には、M細胞と呼ばれる抗原取り込みに特化した細胞が存在し、腸管内の細菌などの抗原を盛んに取り込み、直下の免疫系細胞に受け渡し、腸管免疫応答の誘導に重要な働きをしています。しかし、M細胞は数が少なく、特異的なマーカー分子もないため、その分化や機能の解析はほとんど進んでいませんでした。
研究手法と成果
研究グループは、M細胞を含む腸管関連リンパ組織を覆う上皮細胞層に発現する遺伝子を網羅的に解析し、M細胞で特異的に発現する遺伝子群を同定し、その機能を解析する実験系を確立しました。その結果、M細胞で特に強く発現する遺伝子の1つとして、タンパク質GP2をコードするGP2遺伝子を同定しました。このGP2を特異的に認識する抗体※5を作製してマウスで組織染色を行った結果、GP2はM細胞で特異的に発現していることが判明しました(図1)。さらに、GP2はマウスのみならず、ヒトのM細胞にも特異的に発現していることが分かり、動物間で保存されたM細胞の共通マーカーであることを世界で初めて見いだしました。
GP2の抗体を麻酔下でマウスの腸管内に投与すると、M細胞表面のGP2に結合した抗体の一部を細胞内に取り込んで、顆粒状構造に蓄積することから、GP2がM細胞表面から細胞内への取り込み機能を持つ受容体であることを推測しました。そこで、GP2の精製タンパク質を用いて、種々の細菌との結合能を検討したところ、ヒトやマウスのGP2は、ともに大腸菌やサルモネラ菌と結合することが分かりました。さらに、GP2がどのような菌体表面成分と結合するかを遺伝子欠損した大腸菌・サルモネラ菌を用いて検討した結果、大腸菌やサルモネラ菌の表面に共通に存在するI型繊毛という構造体を特異的に認識することを突き止めました。
これらの結果は、GP2がM細胞表面で、大腸菌やサルモネラ菌の取り込みを担う受容体である可能性を示しています。そこで、その可能性を検証するために、GP2遺伝子を持たないマウス(GP2ノックアウトマウス※6)の腸管内に大腸菌を投与して、M細胞への結合・取り込みを観察したところ、正常マウスと比較して、GP2ノックアウトマウスでは大腸菌の結合・取り込みが極めて少ないことが分かりました(図2)。つまり、GP2と大腸菌の結合が、M細胞によるその後の菌の取り込みに必須であると考えられました。
研究グループは、GP2による細菌の取り込みが、その後の腸管免疫応答にも重要な役割を果たすと推測しました。そこで、病原菌であるサルモネラ菌をマウスに経口投与して、その免疫応答を、サルモネラ菌に対する抗体産生を指標に観察しました。その結果、GP2ノックアウトマウスでは、粘膜免疫応答※7に特徴的なIgA抗体や全身免疫応答※7の指標であるIgGの産生が、いずれも正常マウスと比べて大きく低下していました。一方、サルモネラ菌を体内(腹腔内)に直接注射し、全身免疫系を刺激した場合には、GP2ノックアウトマウスでも正常マウスと同等のサルモネラ菌に対するIgGの産生が見られました。抗原が供給されれば全身免疫応答は正常に機能したことから、GP2ノックアウトマウスの免疫系は、GP2が無いことで腸管内のサルモネラ菌が腸管免疫系へと正しく供給されず、その後の免疫応答が障害されることが分かりました(図3)。
このように、GP2は、M細胞上に特異的に発現し、大腸菌やサルモネラ菌などの細菌取り込み受容体として、腸内細菌抗原の監視と腸管免疫応答の誘導に重要な役割を果たしていることが明らかとなりました(図4)。
今後の期待
現在、感染症などの予防や治療に使われているワクチンは、そのほとんどが注射(予防接種)による体内への直接投与であり、IgG産生に代表される全身免疫応答しか誘導されません。一方、粘膜ワクチンでは、全身免疫応答に加え、IgA産生に代表される粘膜免疫応答も誘導されます。GP2は大腸菌やサルモネラ菌と結合し、腸管の免疫組織に受け渡すことで、それらに対する粘膜(IgA産生)および全身(IgG産生)免疫応答を誘導することが分かりました。そこで、GP2を標的として、ワクチンなどの任意の抗原分子を粘膜免疫系へと効率良く受け渡すことができると、これまで樹立の難しかったインフルエンザウイルスをはじめ、多くの病原体に対する効果的な、経口投与による粘膜ワクチンの開発につながると考えられます。さらに、アレルギー症状を軽減するワクチンの開発も期待できます。このように、本研究は予防医学の発展を通して、国民の健康増進に大きな利益をもたらす可能性を持っています。
発表者
理化学研究所
免疫・アレルギー科学総合研究センター
免疫系構築研究チーム チームリーダー
大学院生命ナノシステム科学研究科
免疫生物学教室 大学院客員教授
大野 博司(おおの ひろし)
Tel: 045-503-7031 / Fax: 045-503-7030
お問い合わせ先
横浜研究推進部 企画課Tel: 045-503-9117 / Fax: 045-503-9113
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.M細胞
M細胞は、パイエル板に代表される腸管関連リンパ組織を覆う上皮細胞層に点在する、特殊に分化した上皮細胞の一種である。腸管の粘膜上皮細胞の腸管内腔に面する細胞膜には、高さ約0.5mm、直径約0.1mmの細い棒状の微絨毛(顕微鏡で刷子の毛のように見えるため刷子縁とも呼称される)と呼ばれる構造でびっしりと覆われているが、M細胞ではこの微絨毛が未発達で、細胞表面が膜状(membranous)、あるいは小さなひだ状(microfold)に見えることから、その頭文字を取ってM細胞と呼ばれる。M細胞では、細胞膜から取り込んだ物質を、細胞質を通過して別の細胞膜領域からそのまま細胞外へと搬出する輸送系(トランスサイトーシス)が特に発達しており、この機構により、腸管内腔から細菌などの腸内抗原を積極的に腸管関連リンパ組織に供給することで、免疫監視に重要な役割を果たすと考えられてきた。しかしその機能や分化の分子機構の解析は最近までほとんど進んでいなかった。 - 2.GP2
glycoprotein 2の略。GP2は膵臓(すいぞう)の腺房細胞(膵臓の消化酵素を分泌する外分泌細胞)に発現する分子として、青山学院大学理工学部の福岡伸一博士により1990年に発見され、遺伝子欠損マウスも樹立されたが、その機能は長らく不明であった。理研免疫・アレルギー科学総合研究センター(RCAI)免疫系構築研究チームの長谷、大野らの研究から、腸管ではGP2がM細胞にのみ発現すること、さらに細菌受容体として機能することが明らかとなった。 - 3.共同研究グループ
理研RCAI免疫系構築研究チーム/横浜市立大学大学院生命ナノシステム科学研究科免疫生物学研究室(大野博司、福田真嗣、海老澤昌史、門倉一憲、中藤学)、理研RCAI免疫系構築研究チーム(長谷耕二、河野一也、藤村由美子、河野早弥賀、木村俊介、村上貴哉)のほか、東京大学医科学研究所(清野宏、野地智法、Gemilson Soares Pontes)、大阪大学大学院医学系研究科(戸邉亨)、福島県立医科大学医学部(和栗聡、矢橋あつ子)、東京女子医科大学消化器病センター(飯村光年、羽村公代)、青山学院大学理工学部(福岡伸一)、スタンフォード大学医学部(Anson W. Lowe)、東京大学大学院農学生命科学研究科(伊藤喜久治)の研究者各氏。 - 4.パイエル板
腸管関連リンパ組織は、リンパ球などが集まって組織的に形成されるリンパ組織構造である。パイエル板はその代表的な組織であり、例えばヒトでは小腸末端部にまとまって存在するのに対し、マウスでは小腸の全長にわたり、8~10個のパイエル板がほぼ等間隔で存在する。腸管関連リンパ組織を含む、粘膜系全体のリンパ組織を総称して粘膜関連リンパ組織と呼ぶ。これには口腔粘膜下に存在する扁桃などが含まれる。粘膜関連リンパ組織は、いわば全身免疫系におけるリンパ節に相当する。 - 5.抗体
別名免疫グロブリン(immunoglobulin; Igと略される)。Bリンパ球によって作られる、特定の異物抗原を特異的に認識して結合するタンパク質複合体。IgA、IgD、IgE、IgG、IgMに分類される。血液中に最も多く検出されるのはIgGだが、私たちの身体の中で最も多く産生されているのはIgAである。IgAはその大部分が腸管内や唾液中、母乳中などに分泌されて、体外環境との境界で生体防御に働くため、血中濃度はIgGより少ない。 - 6.ノックアウトマウス
遺伝子工学の手法により人為的に作られた、ある任意の遺伝子を欠失した突然変異マウス。機能未知の遺伝子のノックアウトマウスを作製・解析することにより、その遺伝子の機能を明らかにしたり、ヒトの遺伝性疾患の原因遺伝子を欠失した病態モデルマウスを作出して、その病態を詳しく解析し、新たな治療法の開発に用いたりすることができる。 - 7.粘膜免疫応答、全身免疫応答
全身免疫系では、皮膚などから体内に侵入した細菌などの抗原がリンパ節へと運ばれ、免疫応答を引き起こす結果、主としてIgG抗体が産生される(全身免疫応答)。これに対し、腸管免疫系では、粘膜面から取り込まれた抗原が、粘膜関連リンパ組織で主としてIgA産生を誘導する(粘膜免疫応答)とともに、一部は腸間膜に存在するリンパ節や脾臓にも運ばれ、IgG産生を誘導する。つまり、一般的なワクチン注射などで体内に直接打ち込まれた抗原ではIgGを中心とする全身免疫応答のみが発動するのに対し、経口ワクチンのように粘膜面から吸収される抗原に対しては、粘膜免疫応答と全身免疫応答の両者が誘導される、と考えられる。
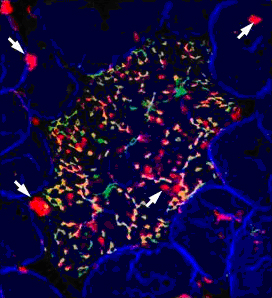
図1 マウスM細胞特異的なGP2の発現を示す組織染色像
マウス小腸粘膜組織のGP2(緑)、UEA-1(赤)およびアクチン線維(青)の染色像。UEA-1は植物由来のタンパク質で、従来マウスM細胞を検出する唯一の手段として使われてきたが、矢印で示すように、粘液を産生する上皮細胞である杯細胞も強く染色することから、M細胞特異的な試薬とはいえなかった。一方、GP2は腸管関連リンパ組織を覆う上皮細胞のM細胞(中央)だけで染色が認められ、その多くがUEA-1の染色と重なっていることから(緑+赤=黄色)、GP2はM細胞だけで発現していると考えられる。アクチンは組織の輪郭が分かるように用いた。
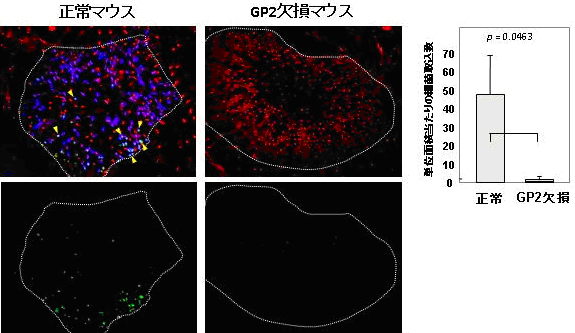
図2 GP2ノックアウトマウスにおける大腸菌取り込み障害
上段:GP2(青)、UEA-1(赤)、大腸菌(緑)の3重染色像。
下段:上段の写真の大腸菌(緑)のみを表示。
正常マウスでは、腸管関連リンパ組織(白点線で囲われた領域)を覆う上皮部位にGP2陽性のM細胞が見られ、そこに大腸菌(緑)が付着している。一方、GP2ノックアウトマウスでは、GP2の染色は見られず(UEA-1陽性細胞は見られるため、M細胞は欠失していないことが分かる)、それに伴い大腸菌(緑)もほとんど検出されない。
右のグラフ:複数のマウスにおける、腸管関連リンパ組織への大腸菌の付着数。
正常マウスと比較し、GP2ノックアウトマウスでは大腸菌の取り込みがほぼ完全に失われていることが分かる。
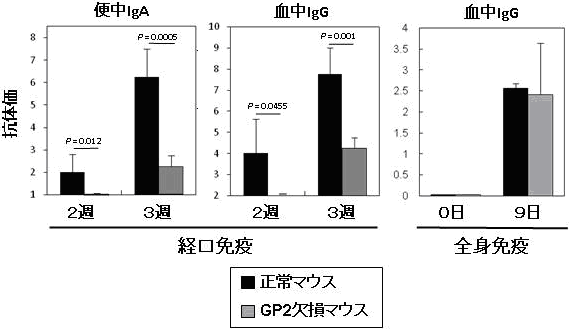
図3 GP2ノックアウトマウスにおける経口免疫応答の障害
正常マウスとGP2ノックアウトマウスに、サルモネラ菌を経口あるいは全身(腹腔内)に投与し、経時的に糞便中IgAや血中IgG抗体価を測定した。GP2ノックアウトマウスでは経口免疫応答に障害が認められる。
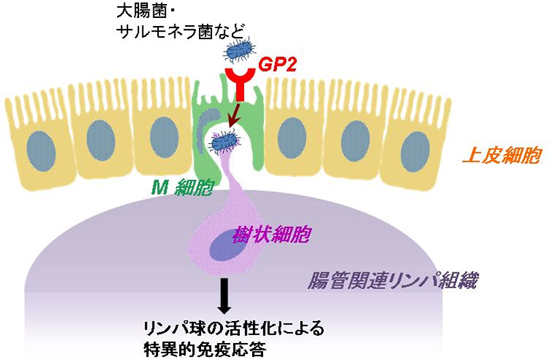
図4 研究で得た知見の模式図
M細胞上に発現するGP2と結合した大腸菌やサルモネラ菌などは、GP2依存的にM細胞に取り込まれ、さらに腸管関連リンパ組織に存在する樹状細胞などの免疫系細胞に受け渡される。細菌は樹状細胞中で消化分解され、抗原としてリンパ球を活性化することにより、特異的な免疫応答が誘導される。
