2012年6月6日
独立行政法人 理化学研究所
独立行政法人 国立がん研究センター
体を傷つけず、PETで難治性乳がんを診断
-診断と治療を同一薬剤で行うセラノスティックスの実現へ-
ポイント
- 悪性度の高いHER2陽性乳がんの原発巣、転移巣の分子イメージングに成功
- 抗体医薬の適合性診断を1回の静脈注射による非侵襲的なPET検査で行う
- 大腸がんなど他がん種への適用も検討開始
要旨
理化学研究所(野依良治理事長)と国立がん研究センター(堀田知光理事長)は、乳がん患者に投与した抗がん剤の体内での動きをPET(陽電子放出断層画像法)検査※1で調べ、治療の効果や転移の有無について体を傷つけず(非侵襲的)に診断する手法を開発しました。これは理研分子イメージング科学研究センター(渡辺恭良センター長)分子プローブ動態応用研究チーム渡辺恭良チームリーダーらと国立がん研究センター中央病院の田村研治医長らによる共同研究の成果です。
近年、がんの化学療法では、従来の抗がん剤に加えて、ホルモン療法や分子標的薬※2などの併用が推奨されています。中でも、がん化に関わる特定のタンパク質に作用する分子標的薬は、難治性のがんに有効な新薬として期待されていますが、厳密な患者適合性※3の診断が必要であることや、高い薬価、適切な投与法の未確立、効果・副作用の個人差など、普及に向けて解決すべき問題が残されています。特に、患者適合性と治療効果の判定のため、体を傷つける(侵襲的)針生検※4でがん組織の採取を行う場合があり、患者の大きな苦痛となっています。
研究グループは、転移・再発率の高いHER2陽性※5乳がんに高い効果を示す抗体医薬「トラスツズマブ※6」を、放射性同位体64Cu(半減期12.7時間)で標識して、従来のPET検査とほぼ同等の被曝量でトラスツズマブの体内動態を追跡することに成功しました。トラスツズマブ治療中患者14症例のPET臨床試験の結果、HER2陽性乳がんの原発巣に加え、骨、脳などへの転移や、治療に伴うがん組織の縮小をPET検査で確認しました。これは、治療薬そのものを放射性同位体で標識して可視化することで、診断、治療、予後観察という一連の医療行為を統合するセラノスティックス※7の実現を示唆します。今後、針生検に変わる非侵襲的なPET検査の確立に向け、画像診断の確実性の向上、他がん種への応用を進め、早期の実用化を図ります。
本研究成果は、文部科学省の国家基幹研究開発推進事業『分子イメージング研究戦略推進プログラム』により実施されたものであり、6月5日に米国シカゴで開催される第48回米国臨床腫瘍学会(Annual Meeting of the American Society of Clinical Oncology)で発表されます。
背景
日本における乳がん罹患率は増加しており、女性の部位別のがん罹患率第1位となっています(出典:全国がん罹患モニタリング集計2007年)。手術後に化学・ホルモン療法を組み合わせて、以前よりも高い生存率が得られるようになりましたが、肺、肝臓、骨など他の臓器への転移や再発率の高さが乳がんの難治性の要因として挙げられています。
乳がん症例の20~30%は、乳がん細胞の表面にHER2タンパク質と呼ばれる受容体タンパク質を多く持つHER2陽性乳がんで、このHER2タンパク質が乳がんの増殖や転移に関与していると考えられています。1998年、このHER2タンパク質を狙い撃ちする抗体医薬「トラスツズマブ(商標名ハーセプチン)」が米国で認可(日本では2001年)され、乳がん治療を大きく変えました。トラスツズマブは、HER2タンパク質に結合して乳がん細胞の増殖を抑えるため、HER2タンパク質やHER2遺伝子を過剰に持っているHER2陽性乳がんに対して、高い治療効果を示します。
乳がん患者がHER2陽性かどうかを調べる確実な方法は、針生検で侵襲的にがん組織を採取し、生化学的な方法で細胞を検査することです。しかし、がん組織の正確な採取が技術的に困難なことや、がんの進行や治療の経過に応じて針生検を複数回行うことが必要で、患者の大きな苦痛となっています。そのため、針生検に替わる非侵襲的でより正確なHER2陽性乳がんの検査方法の確立が期待されます。
現在、乳がんをはじめ、一般的ながんの早期発見に用いられているPET検査(FDG-PET)は、痛みを伴わずに悪性の腫瘍か良性の腫瘍かを見分ける方法として広く普及しています。しかし、FDG-PETではがん細胞の詳しい情報が得られず、患者適合性の検査には応用できません。研究グループは、診断と治療を同一薬剤で実施するセラノスティックスの考え方に基づき、トラスツズマブそのものをPETプローブとして用いて、体内のHER2陽性がん細胞を非侵襲的に画像診断する手法の開発に取り組みました。トラスツズマブの分子イメージングには、放射性同位体インジウム111(111In:半減期2.81日)を用いたSPECT※8、放射性同位体ジルコニウム89(89Zr:同3.25日)を用いたPET検査の先行報告があります。これらの例では、トラスツズマブが腫瘍組織に蓄積するのに多くの時間がかかることを考慮し、FDG-PETで用いるフッ素18(18F:同110分)よりも著しく半減期の長い放射性同位体を使用しています。また得られた診断画像の解像度も低く、検査の確実性、被曝量などの安全性が課題とされてきました。
研究手法と成果
研究グループは、より半減期の短い放射性同位体銅64(64Cu:半減期12.7時間)を用いる新しいPETプローブ「カッパー64・ドータ・トラスツズマブ(64Cu-DOTA-Trastuzumab)」を作製しました。64Cu-DOTA-Trastuzumabが生体内のHER2陽性細胞を検出するかを調べるため、HER2発現量の異なる2種類のヒト腫瘍を移植したマウスでPET検査を行ったところ、移植腫瘍にHER2の発現量を反映した強さのシグナルを認め、PETプローブとしての有用性を確認しました(図1)。また、PET撮像後に取り出した移植腫瘍の顕微鏡観察からも、64Cu-DOTA-TrastuzumabがHER2陽性細胞に結合していることを確認しました。
臨床試験では、既にHER2陽性であることが確認され、トラスツズマブで治療中の乳がん患者の協力を得ました。文書による臨床試験への参加同意が得られた患者14症例に対して、通常治療用量の100分の1以下※9に相当する64Cu-DOTA-Trastuzumabを静脈注射し、6、24、48時間後にPET検査を行いました。その結果、最小直径2.0cmまでの腫瘍を描出できることが分かり、ほとんどの症例でHER2陽性乳がんの原発巣に一致したシグナルを観察しました(図2)。転移巣の診断では、特に脳転移の描出に優れることが分かりました(図3左)。針生検でHER2陽性乳がんの肺転移が確定した症例では、転移巣の位置にシグナルを認め、針生検と画像診断の結果が一致することを確認しました(図3右)。また胸骨/縦隔リンパ節転移症例では、治療に伴いがん組織が縮小する様子を追跡できました(図4)。さらに、腎細胞がんとHER2陽性乳がんの両方のがんを有する症例(重複がん)では、HER2陽性脳転移巣が描出される一方、腎細胞がんではシグナルを認めず、今回のPET検査がHER2陽性腫瘍を特異的に検出することが分かりました。
今回のPET検査による被曝量は約5.3ミリシーベルト(mSv)であり、現在の標準的なPET検査(FDG-PET)の被曝量(約6.7mSv)とほぼ同等であることから、一般病棟や外来で実施可能な診断法として実用化が期待できます。また、PETプローブとして投与した抗体量も53~87マイクログラム(平均73.5マイクログラム)であり、生体に影響を及ぼさない1ミリグラム以下という超微量でも十分に撮像できることが分かりました。
今後の期待
今回開発したPETプローブ「64Cu-DOTA-Trastuzumab」は、原則、PET検査室をもつ医療施設であればどこでもHER2陽性乳がんの画像診断を可能にします。今後は、HER2陰性を含めた複数の乳がん患者の協力を得て臨床研究を重ね、実用化を目指します。
また、分子標的薬の患者適合性を検査するため、薬そのものをPETプローブ化し非侵襲的な画像診断を行う方法論は、トラスツズマブ以外の抗体医薬についても応用可能です。理研分子イメージング科学研究センターは現在、大腸がんの抗体医薬セツキシマブ(商標名アービタックス)のPETプローブ化に成功し、すでに動物実験での有効性を確認しています。これらの臨床応用により、さまざまながんの個別化医療を推進します。
発表者
理化学研究所
分子イメージング科学研究センター
センター長 渡辺 恭良(わたなべ やすよし)
独立行政法人国立がん研究センター
中央病院 乳腺科・腫瘍内科 通院治療室
医長 田村 研治(たむら けんじ)
お問い合わせ先
分子イメージング科学研究センター
広報・サイエンスコミュニケーター
山岸 敦(やまぎし あつし)
Tel: 078-304-7111 / Fax: 078-304-7112
報道担当
独立行政法人理化学研究所 広報室 報道担当
Tel:048-467-9272 / Fax:048-462-4715
独立行政法人国立がん研究センター 広報室
Tel: 03-3542-2511(代表)/ Fax: 03-3542-2545
補足説明
- 1.PET(陽電子放出断層画像法)検査
陽電子放出断層画像法(Positron Emission Tomography)による画像診断。ごく微量の放射線を出す放射性同位体を薬などの分子に組み込み、そこから出る放射線を測定することで、その分子の体内分布を見る方法。 - 2.分子標的薬
従来の抗がん剤は、増殖中の細胞が一般的に持つ性質を利用してがん細胞の増殖を抑制させるため、正常細胞にも強い副作用があった。これに対して、がん細胞の増殖に特に関与する分子だけに作用する薬剤を分子標的薬と呼ぶ。 - 3.患者適合性
分子標的薬は、特定の分子を持つがん細胞にしか作用しないため、特定の患者集団にしか高い有効性を示さない。そのため、投与にあたっては患者に適合するかどうかの厳密な判断が必要となる。 - 4.針生検
病理学的検査を行うため、針を用いて組織や体液を採取すること。分子標的薬の患者適合性判定にしばしば用いられる。 - 5.HER2陽性
HER2は細胞表面に存在する受容体タンパク質の一種で、細胞外に分泌された細胞増殖因子と結合し、細胞の増殖を活性化する。乳がん症例の20~30%にHER2タンパクの過剰発現がみられ、悪性度に関与していると考えられている。 - 6.トラスツズマブ
HER2タンパク質に結合する抗体を医薬品として改良したもので、HER2陽性腫瘍細胞の増殖を抑える働きを持つ。HER2陽性乳がんでは、抗がん剤との併用や手術後の化学療法として一般的に用いられている。商標名「ハーセプチン」。 - 7.セラノスティックス
therapeutics(治療)とdiagnostics(診断)の2つの単語を合わせた造語(Theranostics)。患者個人の病態を正確に把握し、適切な治療を選択することを一連の医療行為と見なす考え方。個別化医療の推進に不可欠とされる。 - 8.SPECT
単光子放出断層画像法(Single Photon Emission Computed Tomography)による画像診断。PETと同様、ごく微量の放射線を出す放射性同位体を薬などの分子に組み込み、そこから出る放射線を測定して、その分子の体内分布を見る方法。検査機器が安価であるため普及しているが、解像度や定量性ではPETに劣る。 - 9.通常治療用量の100分の1以下
被験者の安全を考慮し、PETプローブとして十分な濃度であり、かつ人体に薬理学的な効果を及ぼさない用量での検査を実施した。治療薬としての効果はない代わりに、副作用の影響も無視することができる。
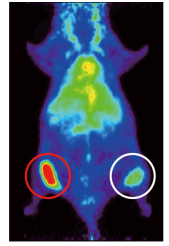
図1 ヒト腫瘍移植マウスにおけるトラスツズマブPETプローブの集積
マウスにHER2発現レベルの異なる2種類のヒト腫瘍細胞を移植し、64Cu-DOTA-Trastuzumabを用いてPET撮像したところ、HER2発現量の高い腫瘍に顕著なシグナルを観察し(赤丸)、HER2発現量の低い腫瘍では弱いシグナルを観察した(白丸)。なお胴体部の緑の部分は、肝臓への非特異的な蓄積によるもの。
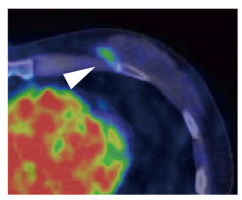
図2 HER2陽性乳がん原発巣におけるトラスツズマブPETプローブの集積
トラスツズマブを用いる術前化学療法中のHER2陽性乳がん患者に64Cu-DOTA-Trastuzumabを静脈注射しPET検査したところ、左乳房の原発巣の位置に一致したシグナルを観察した(矢頭)。左下の赤い部分は血中のシグナル(心臓内腔)を示す。
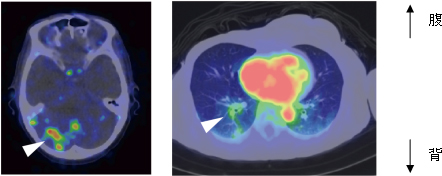
図3 HER2陽性乳がん転移巣でのトラスツズマブPETプローブの集積
64Cu-DOTA-Trastuzumabの体内動態を全身にわたって追跡したところ、3症例で脳転移が疑われるシグナルを観察した(写真左、矢頭)。また、針生検で肺転移が確定した患者では、肺転移巣に一致したシグナルを観察した(写真右、矢頭)。写真右の中央部の赤い部分は血中のシグナル(心臓内腔)を示す。
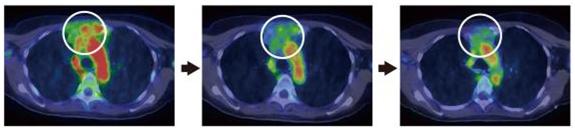
図4 トラスツズマブPETプローブで経過観察したトラスツズマブ治療の効果
胸骨および縦隔(左右の肺と胸椎、胸骨に囲まれた部分)に転移したHER2陽性乳がん患者に対するトラスツズマブ治療の効果を、64Cu-DOTA-Trastuzumabのシグナルで追跡した。治療が進むにつれて、HER2陽性腫瘍の縮小を確認した(白丸で囲んだ領域)。その下部は心臓内腔のシグナルを示す。左:治療前、中:治療第8サイクル(8週間)後、右:治療第16サイクル(16週間)後。
