ポイント
- 末梢組織の疑似ウイルス感染は、脳内での炎症性物質分泌を促進
- 発熱と疲労倦怠感は別のメカニズムで起きている
- 今後の研究進展で、疲労倦怠感の治療法の開発に期待
要旨
理化学研究所(理研、野依良治理事長)は、末梢からのウイルス感染を模擬したラットを用いて、脳内炎症によって疲労倦怠感が起きることを明らかにしました。これは、理研ライフサイエンス技術基盤研究センター(渡辺恭良センター長)細胞機能評価研究チームの片岡洋祐チームリーダー、大和正典研究員ら研究チームの成果です。
疲労には、肉体疲労や精神疲労、病気に伴う疲労などがあります。例えば、私たちがインフルエンザにかかると、発熱や筋肉痛とともに強い疲労倦怠感に襲われることがあります。近年では、疲労は脳で感じ、また、疲労による作業効率の低下にも脳が深く関わっていることが分かりつつあります。しかし、ウイルス感染による疲労倦怠感の発症に関する脳の仕組みについては、よく分かっていませんでした。
研究チームは、一過性の発熱や数日間続く自発的な活動(自発活動)の低下など、インフルエンザ感染症状を示す疑似ウイルス感染ラットを用い、それら急性症状の発症から疲労回復過程までの、脳内の炎症性物質[1]の変化を調べました。まず、発熱と疲労倦怠感の関係を調べたところ、ラットに発熱を抑える薬を投与しても、低下していた自発活動を回復できませんでした。このことから、発熱と疲労倦怠感は別のメカニズムで起きていると分かりました。次にラットの脳内を調べてみると、炎症性物質の1つである「インターロイキン-1β (IL-1β)[2]」が産生されており、神経炎症が起きていました。IL-1βの脳内の働きを抑えるために、脳にIL-1受容体の働きを阻害する物質「IL-1受容体アンタゴニスト[3]」を投与したところ、疑似感染後の自発活動の低下は起こらなくなりました。一方、ラット脳内にもともと存在しているIL-1受容体アンタゴニストの量を測定したところ、疑似感染後に大脳皮質[4]や海馬[5]を含む各領域で増えており、この内在性のIL-1受容体アンタゴニストの機能を阻害すると、低下した自発活動の回復が遅れることも分かりました。
これらの結果は、脳内でIL-1受容体アンタゴニストの産生に障害が起きると、一過性の感染や炎症が治癒した後も疲労倦怠感が軽減されず、慢性化する可能性を示唆します。今後、さまざまな病気に伴う疲労倦怠感の治療法の開発につながるものと期待できます。
本研究成果は、米国の科学雑誌『PLOS ONE』オンライン版(3月12日付け、日本時間3月13日)に掲載されます。
背景
疲労倦怠感は、患者が医療機関を訪れる主な理由の1つです。疲労倦怠感は過労や精神ストレス、病気など、さまざまな要因により引き起こされ、私たちの体の恒常性の乱れを知らせる重要なシグナルの1つと考えられています。これら原因別の疲労について、それぞれの動物モデルを開発し、分子・神経メカニズムを探索することは、一時的な疲労症状だけではなく、慢性化する病的な疲労倦怠感を引き起こすメカニズムの解明や、予防・治療法を開発することにつながります。
インフルエンザにかかると、私たちは発熱や筋肉痛とともに強い疲労倦怠感に襲われることがあります。また、肝炎などの治療でインターフェロン[6]投与を受けた患者が、発熱・筋肉痛・疲労感を訴え、時にうつ症状などの中枢神経症状を示すことも知られています。これらの知見から、ウイルスが気道粘膜などに感染すると免疫細胞がインターフェロンなどの炎症性物質を放出し、そのシグナルが脳機能に何らかの変化をもたらし、疲労倦怠感が引き起こされるものと考えられてきました。しかし、その詳細な脳内メカニズムは不明でした。
感染症の動物モデルとして、人工的に合成した2本鎖RNA「Poly I:C[7]」を末梢組織(腹腔)に投与されたラットは、インフルエンザ感染と同様に発熱と自発活動(回し車運動)の低下を示すことが知られています。今回の研究では、この疑似ウイルス感染ラットを用い、疲労症状と炎症性物質の関連を探りました。
研究手法と成果
研究チームは、Poly I:Cを腹腔投与したラットが、一過性に発熱(24時間以内に解熱)し、数日間続く自発活動の低下や摂食量の低下など、インフルエンザ感染に似たような症状を示すことを確認しました。発熱は、炎症性物質であるサイトカインの作用で脳血管内皮細胞に酵素「COX-2」が作られて起きることが分かっています。
まず、発熱と疲労倦怠感の関係を明らかにするため、Poly I:Cに加えて、COX-2の作用を阻害する薬剤「NS398」をラットに投与する実験を行いました。その結果、発熱は抑えられましたが、自発活動の低下についてはほとんど回復効果がありませんでした(図1)。つまり、発熱と疲労倦怠感とは異なる分子メカニズムによることが分かりました。
次に、研究チームはPoly I:C投与後のラット脳内の物質の変化を調べました。その結果、「インターロイキン-1b(IL-1b)」をはじめとする炎症性サイトカイン[8]と呼ばれる一群の炎症性物質の強い発現上昇が見られました。IL-1bはIL-1受容体と結合して初めて作用します。そこで、この受容体にIL-1bが結合することを阻害する「IL-1受容体アンタゴニスト」をラットの脳内に投与したところ、Poly I:C投与による自発活動の低下現象は全く起こらなくなりました(図2)。
IL-1受容体アンタゴニストは、生体の脳でも作られる内在性の分子です。実際にPoly I:C投与後のラット脳内のIL-1受容体アンタゴニストの量を測定したところ、大脳皮質や海馬を含む各領域で発現が増強していました。さらに、脳内でのIL-1受容体アンタゴニストの作用を抑制すると、自発行動の回復が遅れることも分かりました。
以上から、インフルエンザなどのウイルス感染に伴う疲労倦怠感は、脳内でIL-1bが産生されることが引き金となって起きること、また一方で、脳内で作られるIL-1受容体アンタゴニストがその作用に対抗して疲労倦怠感からの回復を促進していることが明らかになりました(図3)。
今後の期待
本研究のような疲労に関する脳科学研究によって、疲労倦怠感を引き起こす分子メカニズムが少しずつ明らかになりつつあります。今回の成果から、脳内で作られるIL-1受容体アンタゴニストの産生に障害が起きると、一過性の感染や炎症が治癒した後も、疲労倦怠感が軽減されずに長引いてしまう可能性が示されました。今後はこうした疲労倦怠感からの回復や慢性化に至る詳細なメカニズムに着目し、さまざまな病気に伴う疲労倦怠感の治療法の開発につなげていきたいと考えています。
原論文情報
- Yamato, M., Tamura, Y., Eguchi, A., Kume, S., Miyashige, Y., Nakano, M., Watanabe, Y., Kataoka, Y. "Brain interleukin-1βand the intrinsic receptor antagonist control peripheral toll-like receptor 3-mediated suppression of spontaneous activity in rats."
PLOS ONE, 2014, doi: 10.1371/journal.pone.0090950
発表者
理化学研究所
ライフサイエンス技術基盤研究センター 生命機能動的イメージング部門 イメージング機能研究グループ 細胞機能評価研究チーム
チームリーダー 片岡 洋祐(かたおか ようすけ)
お問い合わせ先
独立行政法人理化学研究所
ライフサイエンス技術基盤研究センター
チーフ・サイエンスコミュニケーター 山岸 敦(やまぎし あつし)
Tel: 078-304-7138 / Fax: 078-304-7112
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.炎症性物質
免疫細胞から分泌される炎症に関係する物質。特定の受容体を発現する細胞に情報伝達を行う。 - 2.インターロイキン-1β(IL-1β)
細胞が放出し、細胞間相互作用を担うタンパク質性因子(サイトカイン)の一種。免疫細胞によって生産・分泌され、受容体への結合を介して細胞の活性化,分化,増殖などさまざまな作用を示すタンパク質を総称してインターロイキンと呼ぶ。 - 3.IL-1受容体アンタゴニスト
拮抗物質。受容体と結合する性質はあるものの、その受容体が担う生理反応を起こさない物質。アンタゴニストが多量に存在すると、本来結合すべきサイトカインが受容体と結合できなくなるため、その作用を阻害する効果がある。 - 4.大脳皮質
大脳の表面に広がる神経細胞を多く含む灰白質(かいはくしつ)の層。知覚、思考、記憶など脳の高次機能をつかさどっている。 - 5.海馬
大脳辺縁系に属する脳の部位。脳の記憶や空間学習・空間認知に関わる。 - 6.インターフェロン
ウイルス感染で誘導される抗ウイルス系のサイトカイン。免疫反応や炎症反応に関わる。 - 7.Poly I:C
リボヌクレオチドであるイノシンとシトシンが重合した人工2本鎖RNA。動物の体内に投与すると、RNAウイルスが細胞に感染した時と同様の生体反応を引き起こす。 - 8.炎症性サイトカイン
炎症反応を制御するサイトカインの中でも、炎症症状を制御する働きをもつもの。
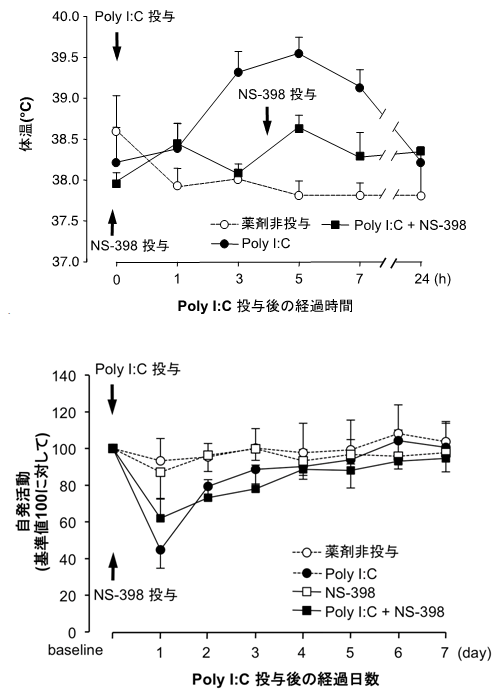
図1 Poly I:Cを末梢組織に投与したラットの発熱と自発活動の低下
- 上グラフ:Poly I:Cを末梢組織に投与したラットは、一過性の発熱を示す(●のグラフ)。発熱に関わる酵素COX-2の阻害剤(NS398)を、Poly I:C投与の5分前および4時間後の2回にわたって投与すると、発熱を抑えることができる(■のグラフ)。
- 下グラフ:Poly I:Cを末梢組織に投与したラットは、数日間続く自発活動の低下を示す(●のグラフ)。NS398の投与は、自発活動の回復に効果を示さない(■のグラフ)。
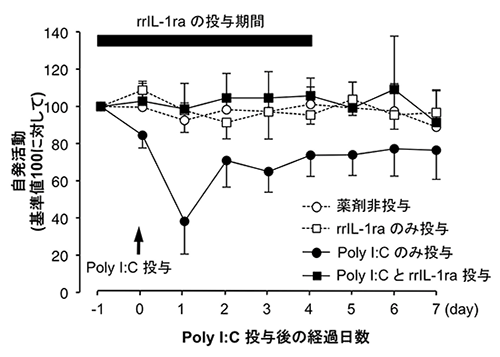
図2 IL-1受容体アンタゴニストの脳内投与は自発活動の回復を促進する
Poly I:Cを末梢組織に投与する前後5日間にわたってIL-1受容体アンタゴニスト(rrIL1-ra)を投与したラットは、自発活動の低下を全く示さなかった(■のグラフ)。
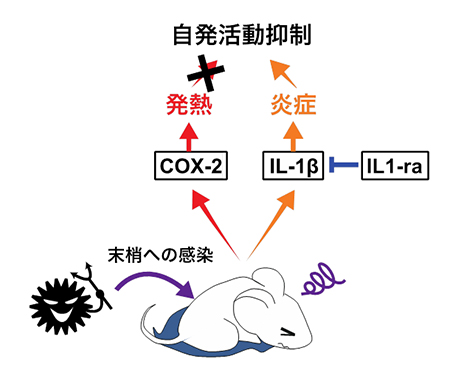
図3 末梢へのウイルス感染が疲労倦怠感を招く
今回の研究で示された、末梢へのウイルス感染がラットの自発活動を低下させる仕組み。Poly I:Cを末梢組織に投与したラットは、COX-2を介した発熱反応と、脳内でつくられたIL-1βを介した神経炎症を呈する。このうち、自発活動低下の引き金となるのは、発熱ではなく神経炎症である。また、脳内で作られるIL-1受容体アンタゴニスト(IL1-ra)は、IL-1βの作用に拮抗して自発活動低下からの回復を促進する。
