2014年4月29日
理化学研究所
幹細胞の多能性に関わるレトロトランスポゾン由来のRNA
-ジャンクDNAから転写されるRNAの新しい機能を発見-
ポイント
- iPS細胞やES細胞に特異的な、レトロトランスポゾン由来のRNAを発見
- 細胞周期や多能性の維持に関わる遺伝子を制御する可能性を示唆
- 幹細胞におけるRNA機能の理解、幹細胞を分化させる技術への応用に期待
要旨
理化学研究所(理研、野依良治理事長)は、これまで知られていなかった数千種類のRNAがiPS細胞やES細胞の核内で発現していることを見いだし、その一部が幹細胞に特徴的な多能性の維持に関与している可能性があることを明らかにしました。これは、理研ライフサイエンス技術基盤研究センター(渡辺恭良センター長)機能性ゲノム解析部門のピエロ・カルニンチ部門長、トランスクリプトーム研究チームのアレクサンダー・フォート研究員、橋本浩介研究員らと、理研統合生命医科学研究センター、米国 Joint Genome Institute、およびデンマークコペンハーベン大学との共同研究グループによる成果です。
近年、理研などが参加する国際共同研究[1]の成果により、細胞に存在するRNAにはタンパク質をコードしないncRNAが大量に含まれることが明らかになりました。ncRNAには、ゲノム上のレトロウイルスに由来する配列(レトロトランスポゾン[2])からの転写産物が多数含まれています。それらの一部は発生や細胞分化に関与していることが示唆されていますが、大半のレトロトランスポゾン由来RNAの生物学的な機能は不明です。また、ES細胞やiPS細胞の研究では、創薬、再生医療への応用と並行して、幹細胞に特有の転写制御ネットワークについて膨大な知見が積み重ねられてきました。しかし、そのほとんどはタンパク質をコードする遺伝子についての理解であり、ncRNAの役割はほとんど明らかになっていません。
共同研究グループは、幹細胞におけるncRNAの役割を調べるため、iPS細胞やES細胞、及びiPS細胞の樹立に用いられた細胞種について、理研独自の技術であるCAGE法[3]などにより網羅的な遺伝子発現解析を行いました。その結果、これまで知られていなかった幹細胞特異的な転写産物「NASTs(Non-Annotated-Stem-Transcripts)」が核内で多量に発現していることを見いだしました。NASTsはヒトとマウスあわせて1万種類以上存在し、約3分の1はレトロトランスポゾンの断片から転写が始まっていることが分かりました。これらのレトロトランスポゾンは細胞周期やクロマチン構造[4]に関わる遺伝子の発現調節領域となっている可能性があり、また、NASTsの一部はiPS細胞での多能性マーカー遺伝子[5]の発現を直接制御する機能を持つことが示唆されました。
ゲノムに存在するレトロトランスポゾン由来の配列は、大多数が機能を持たない「ジャンクDNA」とこれまで考えられてきました。ES細胞やiPS細胞において、レトロトランスポゾンの断片が活性化し、そこから転写されるRNAが多能性の維持に関与していることを示す今回の発見は、幹細胞においてncRNAが重要な役割を果たしていることを示唆します。今後さらにNASTsの機能を解明することで、幹細胞特有の転写制御ネットワークの理解が深まり、iPS細胞から目的細胞を効率よく分化させる方法の開発などへの応用が期待できます。
本研究は、日本学術振興会「最先端・次世代研究開発支援プログラム」等の支援を受けて行われ、成果は、米国の科学雑誌『Nature Genetics』に掲載されるに先立ち、オンライン版(米国時間4月28日付け:日本時間4月29日付け)で公開されます。
背景
米国を中心として組織され、理研が参加する国際プロジェクト「ENCODE」は、ヒトゲノムにコードされている全ての機能要素を解明することを目的に転写産物(RNA)の網羅的な解析を行い、ヒトゲノムの70%以上が転写されている事実を明らかにしました。また、理研が主宰する国際研究コンソーシアム「FANTOM」は、哺乳類のトランスクリプトーム[6]解析を行い、タンパク質をコードしないncRNAにはレトロトランスポゾンに由来する配列が多く含まれていることを明らかにしてきました。このような配列は、HIVのようなレトロウイルスがゲノムに組み込まれた後の残骸であると考えられていますが、その生物学的な機能は分かっていませんでした。
ES細胞やiPS細胞は、創薬、再生医療への応用が進められており、これらの幹細胞の性質を深く理解することがより重要な課題となっています。幹細胞に特有の転写制御ネットワークについての先行研究には、ncRNAの役割の解明も含まれていましたが、既知のncRNAだけを機能解析の対象としていたため、限られた知見しか得られていませんでした。今回共同研究グループは、CAGE法を始めとする複数のRNA解析技術を駆使し、さらに、細胞質に比べて分子数の少ない核内のRNAを濃縮して抽出することで、哺乳類の幹細胞に存在する全RNAの完全な解析を試みました。
研究手法と成果
多能性幹細胞のサンプルとして、ヒトおよびマウスから作られたES細胞(ヒト3種、マウス3種)とiPS細胞(ヒト2種、マウス3種)計11種を用いました。また分化した細胞のサンプルとして、iPS細胞の樹立に用いられた6種の細胞を対照に用いました。それぞれの細胞について、核内RNAと細胞質RNAを別々に調製し、CAGE法やRNA-seq[7]法など複数の手法を用いてトランスクリプトーム解析を行いました。その結果、これまで知られていなかった幹細胞特異的な転写産物「NASTs(Non-Annotated-Stem-Transcripts)」が核内で多量に発現していることを見いだしました。NASTsはヒトで3,042種、マウスで8,873種見つかり、両者で共通する配列は少ないものの、どちらも約3分の1はレトロトランスポゾンに由来する配列を含んでいました(図1)。特に、長鎖末端反復配列(Long Terminal Repeat:LTR[8])から転写されるNASTs が多く、これらのLTRは、DNAの相互作用やエンハンサー[9]活性の推定から、幹細胞においてクロマチン構造や細胞周期に関わる遺伝子の発現制御に関わっている可能性が示唆されました。
さらに、LTR由来のNASTsが幹細胞の多能性維持に果たす役割を調べるため、siRNA法[10]によるNASTの機能阻害実験を行い、Nanogなどの多能性マーカー遺伝子の発現が変化するかを調べました。マウスのiPS細胞で特に強く発現している77種のNASTsについてそれぞれ機能阻害実験を行ったところ、4種のNASTsの機能阻害で多能性マーカー遺伝子の発現が低下することを確認しました(図2)。この結果は、LTR由来のNASTsが、多能性維持に必須な転写制御ネットワークに直接関与していることを示唆します。
今後の期待
ヒトゲノムに存在するレトロトランスポゾン由来の配列は、ヒト進化の過程でレトロウイルスがゲノムに挿入した残骸であり、機能を持たない「ジャンクDNA」と考えられてきました。LTRに由来するRNAが幹細胞特異的に発現し、幹細胞の性質や多能性の維持に関与していることを示唆する今回の研究は、幹細胞生物学におけるncRNAの重要性を示すものです(図3)。今後さらにNASTsの機能を解明することで、幹細胞の理解、多能性を制御する転写制御ネットワークの解明が進み、iPS細胞などの幹細胞から目的の細胞を効率よく分化させる方法の開発などへの応用が期待できます。
原論文情報
- Alexandre Fort, Kosuke Hashimoto, Daisuke Yamada, Md Salimullah, Chaman A. Keya, Alka Saxena, Alessandro Bonetti, Irina Voineagu, Nicolas Bertin, Anton Kratz, Yukihiko Noro, Chee-Hong Wong, Michiel de Hoon, Robin Andersson, Albin Sandelin, Harukazu Suzuki, Chia-Lin Wei, Haruhiko Koseki, The FANTOM5 Consortium, Yuki Hasegawa, Alistair R.R. Forrest & Piero Carninci. "Deep transcriptome profiling of mammalian stem cells supports a regulatory role for retrotransposons in pluripotency maintenance". Nature Genetics, 2014, doi:10.1038/ng.2965
発表者
理化学研究所
ライフサイエンス技術基盤研究センター 機能性ゲノム解析部門
部門長 CARNINCI Piero(ピエロ・ カルニンチ)
研究員 橋本 浩介(はしもと こうすけ)
お問い合わせ先
独立行政法人理化学研究所
ライフサイエンス技術基盤研究センター
チーフ・サイエンスコミュニケーター
山岸 敦(やまぎし あつし)
Tel: 078-304-7138 / Fax: 078-304-7112
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.理研などが参加する国際共同研究
ENCODE(Encyclopedia of Human DNA Elements)は、ポストゲノム戦略として米国で立ち上げられたプロジェクトで、米国国立衛生研究所(National Institutes of Health:NIH)の国立ヒトゲノム解析研究所 (National Human Genome Research Institute)を中心として、2003年9月から正式に開始された計画。完全解読されたヒトゲノム上に、遺伝子の機能を担う領域をすべて書き込んで、全ヒトゲノム(DNA)の百科事典を作成することを目指している。
FANTOM(Functional ANnoTation Of Mammalian cDNA)は、哺乳動物の遺伝子を網羅的に機能注釈することを主眼とする国際的研究コンソーシアム。2000年に、理研ゲノム科学総合研究センター 遺伝子構造機能研究グループ(旧・オミックス基盤研究領域、現・予防医療・診断開発プログラムプログラムおよび理研ライフサイエンス技術基盤研究センター 機能性ゲノム解析部門)が中心となって結成した。現在は活動範囲を拡大し、ヒト細胞の多様性を理解するため、さまざまな種類のヒト細胞を使って、転写開始部位の系統的マッピングに取り組んでいる。オーストラリア、シンガポール、スウェーデン、南アフリカ、イタリア、ドイツ、ギリシャ、スイス、英国、米国などを含む全世界の20カ国から、114の研究チームが参加している。 - 2.レトロトランスポゾン
HIVなどのレトロウィルスのように、DNA→RNAへの転写と、RNA→DNAへの逆転写によって増殖する性質を持つ遺伝因子。ゲノム上のレトロトランスポゾンが転写されてRNAになり、さらに逆転写酵素によりDNAに戻ることでゲノム中を移動しコピー数を増やす。ヒトゲノムの進化の過程で、ほとんどのレトロトランスポゾンは不活性化されたと考えられている。 - 3.CAGE法
Cap Analysis of Gene Expressionの略。理研が独自に開発した方法で、耐熱性逆転写酵素やcap捕捉法を組み合わせて転写物の5’末端の塩基配列を決定する実験手法。この塩基配列を読み取ってゲノム配列と照らし合わせて、どこから転写が始まっているかを調べることができる。遺伝子の転写開始点をゲノムワイドに同定できる。 - 4.クロマチン構造
真核生物のゲノムDNAは、ヒストンなどのタンパク質と結合し、高度に凝縮した状態で存在する。この構造をクロマチン構造と呼ぶ。局所的なクロマチン構造の変化により、転写因子などの染色体DNAへの接近しやすさを制御する。 - 5.多能性マーカー遺伝子
多能性幹細胞の未分化性を決定する遺伝子。 - 6.トランスクリプトーム
細胞内の全DNAの塩基配列情報をさす「ゲノム」に対し、細胞内の全転写産物(全RNA)をトランスクリプトームと呼ぶ。その大半はタンパク質の情報を持たないノンコーディングRNA (ncRNA) であり、エピジェネティック制御やタンパク質合成制御、幹細胞性の制御などさまざまな機能に関わっている。 - 7.RNA-seq
RNA sequencingの略。組織や細胞で発現している全RNA(トランスクリプトーム)を解析する手法の1つ。mRNAやncRNAの断片的な配列情報(数10~数100塩基)を網羅的に取得し、ゲノム配列と対応させることで、遺伝子発現量の定量や新たな転写配列の発見を行う。 - 8.LTR
レトロウイルスに特徴的な、ウイルスゲノムの両端に位置する繰り返し配列。宿主ゲノムに挿入されると強い転写活性を発揮し、ウイルスゲノムの発現を促進する機能を持つ。ヒトゲノムに存在するレトロトランスポゾンにおいては、LTRの転写活性は抑制されている場合が多いと考えられている。 - 9.エンハンサー
遺伝子の上流や下流に位置し、遺伝子の転写効率を変化させるDNAの特定の配列のうち、転写効率を著しく高める部分をエンハンサー領域(配列)という。 - 10.siRNA法
短い2本鎖RNA(siRNA、small interference RNA)を細胞に導入し、任意の遺伝子の阻害をする実験手法。2本鎖RNAによって配列特異的にRNAが分解されるRNA干渉(RNAi、RNA interference)の原理に基づく。
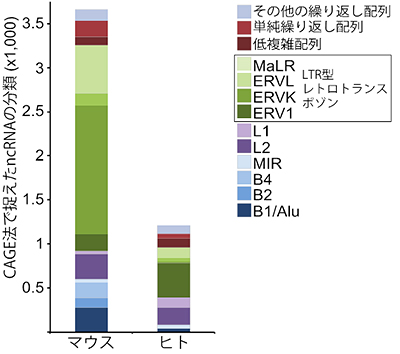
図1 NASTに存在する繰り返し配列
CAGE法で決定したRNA配列を既知のレトロトランスポゾンと比較し、分類したグラフ。MaLR、ERVL、ERVK、ERV1はLTR型のレトロトランスポゾンであり、マウスおよびヒトで頻繁に見つかった。
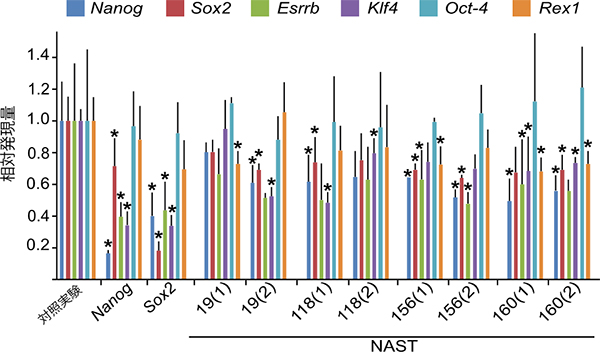
図2 NASTの機能阻害により発現が抑制された多能性マーカー遺伝子
マウスのiPS細胞で、siRNA法によりNASTsの機能阻害実験を行い、多能性マーカー遺伝子の発現変化を観察した。4種類のNASTsにおいて、Nanog遺伝子、Sox2遺伝子、Oct4遺伝子など複数の多能性マーカーの発現が低下することを確認した。
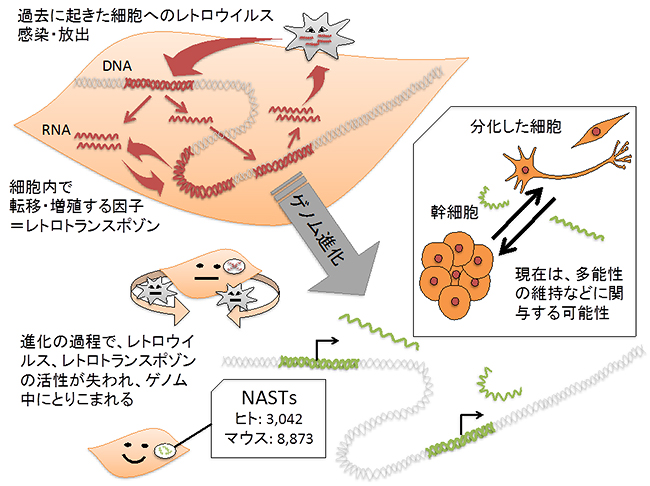
図3 哺乳類ゲノムにおけるNASTsの起源と、幹細胞における機能の推定
哺乳類の進化において、レトロウイルスの感染とレトロトランスポゾンの活発な転移がしばしば生じたと考えられている。現存生物には、その残骸がゲノムの広範囲にわたって存在しており、その一部はタンパク質をコードしないncRNAとして発現している。その中でもNASTsは、幹細胞の性質の制御に関わっている可能性がある。
