2015年10月29日
理化学研究所
肝細胞がんで活性化するレトロウイルス由来のRNA
-肝細胞がんの病態解明、診断マーカーへの応用に期待-
要旨
理化学研究所(理研)ライフサイエンス技術基盤研究センタートランスクリプトーム研究チームのピエロ・カルニンチ チームリーダーと橋本浩介研究員らの研究チームは、肝細胞がん[1]ではレトロウイルス[2]由来RNAの発現が活性化しており、がんの分化度や再発率などと関連していることを発見しました。
世界での肝臓がんによる死亡者数は全がん種の中で2位(日本では5位)で、国内の死亡者数は毎年3万人となるなど、その対策が重要な課題となっています注1)。肝臓がんの70~85%は、肝臓の細胞そのものががんになる肝細胞がんであり、ゲノム解析からがん化に関わる遺伝子の解明が進められています。近年、肝細胞がんでは転写を制御するタンパク質の遺伝子に変異があり、正常な転写ネットワークが破壊されている可能性が示唆されました。しかし、これらの解析はタンパク質をコードする遺伝子や一部のマイクロRNA(miRNA)[3]を対象としており、それ以外のノンコーディングRNA(ncRNA)[4]の解析はほとんど行われてきませんでした。
研究チームは、肝細胞がん患者から採取した肝臓組織を用いて、がん化した細胞とその周辺のがん化していない細胞からRNAを抽出しました。CAGE法[5]によりがん細胞特異的に発現するRNAの解析を行った結果、肝細胞がんで有意に発現が上昇する4,756個のncRNAを見いだし、その20%近くがレトロウイルスに由来するLTR配列[6]を含むことを明らかにしました。RNA発現データと臨床データを比較したところ、LTRの発現が強いほど再発のリスクが高いなど、肝細胞がんの病態との関連も分かりました。また肝細胞がんを発症するモデルマウスの解析においても、発現が上昇したncRNAのうち18.9%がLTRからの転写であり、肝細胞がんの進行とともにその発現が高くなることが観察されました。これらの結果から、LTR発現の活性化はヒトとマウスの肝細胞がんに共通の特徴であることが示されました。 肝細胞がんの発症メカニズムはまだ不明な点が多く、ncRNAの解析が今後の研究において重要な意味を持つことが予想されます。また肝細胞がん特異的なLTRの発現は、肝細胞がんの診断マーカー[7]としての応用も期待できます。
本研究は、米国の科学雑誌『Genome Research』(10月28日付け:日本時間10月29日)に掲載されます。
背景
世界での肝臓がんによる死亡者数は全がん種の中で2位(日本では5位)で、国内の死亡者数は毎年3万人となるなど、その対策が重要な課題となっています。肝臓がんの70~85%は、肝臓の細胞そのものががんになる肝細胞がんです。したがって、肝臓がんとは一般的には肝細胞がんを指します。肝細胞がんの主要な危険因子は肝炎ウイルス(B型およびC型)の慢性感染と飲酒であり、遺伝子の変異や、遺伝子発現制御の異常など、複数の段階を経て進行することが知られています。最近行われた肝細胞がんの全ゲノム解析から、転写を制御するタンパク質の遺伝子に変異があることが分かり、肝細胞がんでは正常な転写ネットワークが破壊されている可能性が示唆されました。しかし、これらの解析はタンパク質をコードする遺伝子や一部のマイクロRNA(miRNA)を対象としており、それ以外のノンコーディングRNA(ncRNA)の解析はほとんど行われてきませんでした。
研究チームはこれまで、理研の独自技術であるCAGE法を始めとする複数のRNA解析技術を駆使し、さまざまな細胞でのRNAの発現を網羅的・定量的に解析してきました。その成果の一つとして、進化の過程で細胞に感染したレトロウイルスに由来するLTR配列が、ncRNAとして発現していることを明らかにしています。また、ある種のLTRはES細胞やiPS細胞で特異的に発現し、多能性の維持に関わる機能を持つことが推測されています注2)。このことから、低い分化度や高い増殖能といった肝細胞がんの特徴はLTRの発現に由来している可能性があると考えられます。
注2)
2014年4月29日プレスリリース「幹細胞の多能性に関わるレトロトランスポゾン由来のRNA」
2015年3月11日プレスリリース「ncRNAの発現がiPS細胞とES細胞の違いを決める」
研究手法と成果
研究チームは、肝細胞がん患者から切除された肝臓組織を用い、がん化した細胞と、その周辺のがん化していない細胞に分けて、CAGE法によりそれぞれの細胞で発現するRNAの解析を行いました。がん化した細胞で発現が上昇しているRNAのうち、タンパク質をコードする遺伝子を調べると、肝細胞がんのマーカー遺伝子[7]として知られるGPC3が最も高く発現していることが確認できました。次にncRNAの配列を調べると、がん化した細胞で発現が上昇している4,756個のncRNAのうち、約20%(935個)がLTRから転写されていることが分かりました(図1左)。これらのLTRは元々肝臓で発現するようにプログラムされていなかったものであり、がん化による発現転写制御の異常により誤って発現するようになったと考えられます。そこで、これらのLTRが本来発現している組織を特定するために、935個のLTRのうち特に発現上昇が顕著であった43個を抽出し、FANTOM5[8]で得られた正常組織の発現データとの比較を行いました。その結果、これらのLTRは精巣や胎盤など生殖に関連する組織で本来発現していることが明らかになりました(図1右)。
次に、発現上昇が顕著であった4個のLTRについてqPCR[9]を行い、LTRの発現が患者個人ごとにどのように異なっているかを調べました。21名の患者について解析したところ、4個のLTRともに、半数前後の患者のがん組織で10倍以上の発現上昇が見られましたが、患者によっては2倍以下の発現上昇であることが分かりました(図2左)。そこで、LTRの発現上昇率が高いグループと低いグループに分類し、臨床データと比較を行いました。その結果、LTRの発現上昇率が高かった患者は、がんの悪性度がより高く、再発率も高いことが明らかになりました(図2右)。
研究チームはさらに、肝細胞がんを発症するモデルマウスについても同様の解析を行いました。その結果、がん細胞で発現が上昇したncRNAのうち18.9%がLTRからの転写であることが分かりました(図1右)。またモデルマウスにおける肝細胞がんの進行と、LTRの発現を追跡した結果、症状の進行とともに一部のLTRの発現が顕著に上昇していました(図3)。これらの結果は、LTRの活性化はヒトとマウスの肝細胞がんに共通の特徴であることを示しています。
今後の期待
肝細胞がんの発症メカニズムはまだ不明な点が多く、LTRがその解明の鍵となる可能性があります。今後、個々のLTRの発現を阻害や過剰発現などにより、LTRの発現とがん化の関係を明らかにしていきます。また、がんの進行とともに発現が変化するLTRは、肝細胞がんの新たなバイオマーカとしての利用も期待できます。
原論文情報
- Kosuke Hashimoto et al., CAGE profiling of ncRNAs in hepatocellular carcinoma reveals widespread activation of retroviral LTR promoters in virus-induced tumors, Genome Research (2015), doi: 10.1101/gr.191031.115
発表者
理化学研究所
ライフサイエンス技術基盤研究センター 機能性ゲノム解析部門 LSA要素技術研究グループ トランスクリプトーム研究チーム
チームリーダー CARNINCI Piero(ピエロ・ カルニンチ)
研究員 橋本 浩介(はしもと こうすけ)
 ピエロ・カルニンチ
ピエロ・カルニンチ
 橋本 浩介
橋本 浩介
お問い合わせ先
理化学研究所 ライフサイエンス技術基盤研究センター
広報・サイエンスコミュニケーション担当 山岸 敦(やまぎし あつし)
Tel: 078-304-7138 / Fax: 078-304-7112
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.肝細胞がん
肝臓がんの一種で肝細胞を由来とする悪性腫瘍で、肝臓がんの70~85%を占める。慢性肝炎、肝硬変が進行すると合併して発症する。主要な危険因子は慢性のB型、C型肝炎ウイスルの感染や飲酒など。 - 2.レトロウイルス
HIVなどのように、DNA→RNAへの転写と、RNA→DNAへの逆転写によって増殖する性質を持つRNAウイルス。ヒトゲノムには、過去に感染したレトロウイルスや、レトロウイルスがゲノム中で移動する性質を獲得したレトロトランスポゾンに由来すると考えられる配列が多数存在している。ヒトゲノムの進化の過程で、これらの配列の大部分は不活性化されたと考えられている。 - 3.マイクロRNA(miRNA)
細胞内に存在する長さ18~24塩基程度の1本鎖RNA。数百~数千の塩基の一次転写産物から段階的に切り出されて作られる。タンパク質へは翻訳されず、他の遺伝子の発現調節などの機能を担っている。 - 4.ノンコーディングRNA(ncRNA)
non-coding RNA。メッセンジャーRNA(mRNA)と異なり、タンパク質の設計図として用いられないRNAの総称。エピジェネティクス(塩基配列に依存しない遺伝子の調節機構)や転写、翻訳といった生物の活動の中枢をなす反応、幹細胞性の維持など、さまざまな働きに関与するncRNAが次々に報告されており、その重要性に注目が集まってきている。 - 5.CAGE法
CAGEはCap Analysis Gene Expressionの略。理研が独自に開発した手法で、耐熱性逆転写酵素やmRNAのCap構造を捕捉する技術を組み合わせて転写産物の5'末端の塩基配列を決定する実験手法。この塩基配列を読み取ってゲノム配列と照らし合わせて、どこから転写が始まっているかを調べることができる。遺伝子の転写開始点をゲノムワイドに同定できる。 - 6.LTR配列
レトロウイルスに特徴的な、ウイルスゲノムの両端に位置する繰り返し配列。宿主ゲノムに挿入されると強い転写活性を発揮し、ウイルスゲノムの発現を促進する機能を持つ。ヒトゲノムに存在するレトロトランスポゾンにおいては、LTRの転写活性は抑制されている場合が多いと考えられている。LTRとはLong Terminal Repeatの略。 - 7.診断マーカー、マーカー遺伝子
特定の疾患に特徴的な分子や遺伝子発現を病気の診断に用いる場合、これらを診断マーカーと呼ぶ。マーカー遺伝子は、特定の状態の細胞で特異的に発現する遺伝子のうち、細胞の正確な記述に利用できるものを指す。 - 8.FANTOM5
理化学研究所が中心となり結成した国際研究コンソーシアムFANTOMの第5期プロジェクト。FANTOM5には20カ国、100以上の研究機関が参加し、ヒトの主要な組織、初代培養細胞、細胞株を対象にゲノムワイドな解析を行った。185,000個のプロモーターと44,000個のエンハンサーの遺伝子制御活性を測定し、正常な細胞や細胞株の体系的な定義を得ることができた。
2014年3月27日プレスリリース「ゲノム上の遺伝子制御部位の活性を測定し正常細胞の状態を定義」 - 9.qPCR
定量PCR(quantitative PCR)。DNAを増幅するPCRの手法を用いて、サンプルに含まれているDNA量を測定する手法。本研究ではRNAを逆転写(reverse transcription、RT)して作られたcDNAをこの手法で測定することでRNA量を測定している(qRT-PCR)。
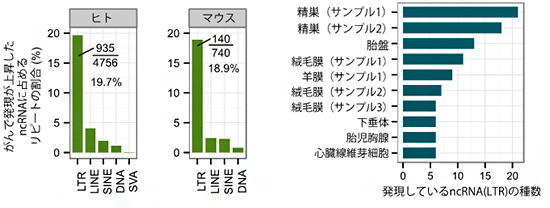
図1 がんで発現が上昇するLTRと、正常組織におけるLTRの発現箇所
左図:がん化した肝細胞で発現が上昇した4,756個のncRNAのうち、ウイルス由来配列の特徴であるリピート構造をもつものを分類したグラフ。935個がLTRから転写されたものであった。
右図:がん化の影響をうけて肝臓で発現してしまったLTRの本来の発現箇所を確認した。ほとんどが精巣や胎盤といった生殖に関連する組織で本来発現するものであった。
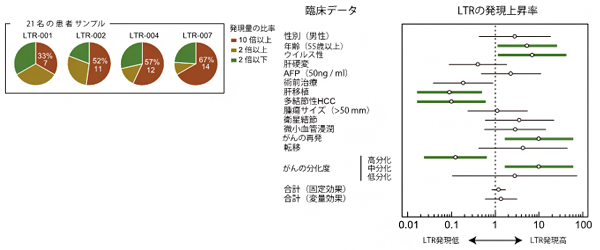
図2 患者ごとに異なるLTR発現量の上昇率
左図:4種類のLTRについて、21名の患者におけるがん細胞での発現上昇率を比較した。円グラフ内の茶色:10倍以上、黄土色:2倍以上、緑色:2倍以下の発現率であることを示す。
右図;LTRの発現上昇率と肝細胞がんの病態の関連性。LTRの発現が高いと、がんが再発したり、がんの悪性度が高かった(分化度が高くなかった)ことが分かる
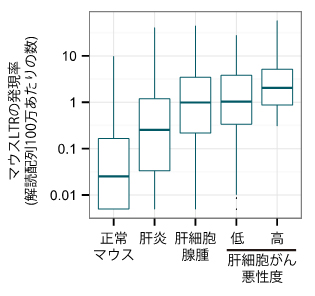
図3 肝細胞がんモデルマウスにおけるLTRの活性化
肝細胞がんモデルマウスで特に発現上昇率の高い140個のLTRについて、がんの進行度との関係を調べた。がんの進行にともない、LTRの発現が上昇していることが分かる。
