2016年4月18日
理化学研究所
大阪大学
京都大学
高輝度光科学研究センター
結晶を損傷しない新しいタンパク質結晶の輸送媒体を発見
-タンパク質の結晶構造解析で新薬創生に一歩近づく-
要旨
理化学研究所(理研)放射光科学総合研究センターSACLA利用技術開拓グループの菅原道泰特別研究員、岩田想グループディレクター(京都大学大学院医学研究科 教授)、大阪大学蛋白質研究所附属蛋白質解析先端研究センターの鈴木守准教授、京都大学大学院農学研究科の桝田哲哉助教、高輝度光科学研究センターXFEL利用研究推進室の登野健介チームリーダーらの共同研究グループ※は、X線自由電子レーザー(XFEL)施設「SACLA[1]」のX線レーザーを用いた「連続フェムト秒結晶構造解析(SFX)[2]」(1フェムト秒は1,000兆分の1秒)において、タンパク質結晶輸送媒体としてヒアルロン酸[3]が利用できることを発見しました。
これにより、SACLAのX線レーザーを用いたSFXでは試料の放射線損傷[4]の問題を解決でき、30マイクロメートル(μm、1μmは100万分の1メートル)サイズ以下のタンパク質微小結晶でも少量の試料消費量で、様々なタンパク質の立体構造(結晶構造)を決定できます。
共同研究グループは2014年、少量のタンパク質結晶を高粘度物質のグリースに混ぜてインジェクター(噴出装置)からゆっくりと押し出し、タンパク質結晶のX線回折を行うことができる「グリースマトリックス法」を開発しました。グリースマトリックス法では、従来の液状試料(10~100mgのタンパク質から得た結晶を含む液体試料)をインジェクターから噴出する「液体ジェット法」と比べ、回折実験に必要なタンパク質結晶の量を1/10~1/100(使用するタンパク質は1mg以下)に軽減できました。しかし、グリースマトリックス法には、グリースとタンパク質結晶を混合した際に、いくつかの試料で結晶に亀裂が入ったり、結晶が溶けてしまうといった問題がありました。
今回、共同研究グループは、タンパク質結晶輸送媒体としてヒアルロン酸水溶液を利用することでこの問題を解決しました。試料に応じて、ヒアルロン酸およびグリースを相補的に利用することで、創薬ターゲットとなる多様なタンパク質の結晶構造解析が可能になると期待できます。
本研究は、文部科学省 X線自由電子レーザー重点戦略課題「創薬ターゲット蛋白質の迅速構造解析法の開発」(研究代表者:岩田想)などの支援を受けて実施されました。
本成果は、英国の科学雑誌『Scientific Reports』に4月18日付でオンライン出版されます。
※共同研究グループ
理化学研究所 放射光科学総合研究センター
利用技術開拓研究部門
SACLA利用技術開拓グループ
特別研究員 菅原 道泰(すがはら みちひろ)
研究員 南後 恵理子(なんご えりこ)
上級研究員 田中 里枝(たなか りえ)
グループディレクター 岩田 想(いわた そう)(京都大学大学院医学研究科 教授)
XFEL研究開発部門
ビームライン研究開発グループ
データ処理系開発チーム
チームリーダー 初井 宇記(はつい たかき)
XFEL研究開発部門
ビームライン研究開発グループ
グループディレクター 矢橋 牧名(やばし まきな)
環境資源科学研究センター
バイオマス工学研究部門
酵素研究チーム
チームリーダー 沼田 圭司(ぬまた けいじ)
浦項工科大学校物理学科
准教授 Changyong Song(チャンヨン・ソン)
大阪大学蛋白質研究所附属蛋白質解析先端研究センター
准教授 鈴木 守(すずき まもる)
京都大学大学院農学研究科
助教 桝田 哲哉(ますだ てつや)
東京大学大学院
医学系研究科
研究員 井上 茂之(いのうえ しげゆき)
理学研究科
研究員 中根 崇智(なかね たかのり)
教授 濡木 理(ぬれき おさむ)
高エネルギー加速器研究機構物質構造科学研究所
特任准教授 湯本 史明(ゆもと ふみあき)
高輝度光科学研究センター
XFEL利用研究推進室
先端光源利用研究グループ
実験技術開発チーム
チームリーダー 登野 健介(との けんすけ)
先端計測・解析技術グループ 高度データ解析チーム
チームリーダー 城地 保昌(じょうち やすまさ)
先端計測・解析技術グループ 計測技術開発チーム
研究員 亀島 敬(かめしま たかし)
背景
タンパク質の立体構造を決定するには、タンパク質結晶にX線を照射したときに得られる回折イメージを解析する「X線結晶構造解析」が適しています。大型放射光施設「SPring-8[5]」の放射光[6]をX線結晶構造解析に用いる場合、一般にサイズが30マイクロメートル(μm、1μmは100万分の1メートル)以上のタンパク質結晶が必要です。しかし、30μm以上のタンパク質結晶を得るのは困難です。特に創薬などの研究用途で重要なヒトを含む動物由来のタンパク質は、結晶化できる十分な量を得るのが難しく、結晶も回折実験に適した十分なサイズに成長しません。また、実験中にタンパク質結晶が放射線損傷を起こすことも大きな問題でした。
X線自由電子レーザー(XFEL:X-ray Free-Electron Laser)は、SPring-8の放射光より10億倍も明るいため、サイズが30μm以下のタンパク質の微小結晶でも構造解析できます。
XFEL施設「SACLA」のX線レーザーは試料への照射時間が10フェムト秒(1フェムト秒は1,000兆分の1秒)以下という超短時間のため、タンパク質が壊れる前の微結晶の回折イメージを検出できます。このX線レーザーの特性を利用した主なタンパク質の構造決定法として、「連続フェムト秒結晶構造解析(SFX)」が注目されています。SFXではインジェクター(噴出装置)から噴出させた液状試料(多数の微小結晶を含む液体試料)にX線レーザーを照射し、各結晶からの回折イメージを連続的に収集します(液体ジェット法)。SFXは常温で行うことができるため、従来の低温条件下(100K、-173℃)で行う回折実験とは異なり、生理条件(生体内)に近い構造を得ることができます。しかし、この方法には10~100mgという大量のタンパク質から得た結晶が必要という問題がありました。
共同研究グループは2014年、タンパク質結晶を高粘度物質のグリースに混ぜ、インジェクターからゆっくりと試料を押し出し、さまざまなタンパク質結晶のX線回折実験を行うことができる「グリースマトリックス法」を開発しました注1)。グリースマトリックス法では、ゆっくりと試料を流すため、液体ジェット法の1/10~1/100に相当する1mg以下のタンパク質試料での構造決定が可能になりました。しかし、グリースとタンパク質結晶を混合した際に、いくつかの試料で結晶に亀裂が入ったり、結晶が溶けてしまうといった問題がありました。
今回、共同研究グループは、この問題を解決するため新たな結晶輸送媒体を探索しました。
注1)2014年11月11日プレスリリース「連続フェムト秒結晶構造解析のための結晶供給手法を開発」
研究手法と成果
共同研究グループはまず、結晶輸送媒体としてグリースとは性質が異なる高粘度で水溶性のアガロース[7]などのハイドロゲル[7]を試してみました。しかし、水溶性の媒体は浸透圧により結晶に損傷を与えることが問題でした。そこで、さまざまなハイドロゲルを調査した結果、ヒアルロン酸がタンパク質結晶に損傷を与えにくいことが分かりました。
次にヒアルロン酸水溶液に微小なタンパク質結晶を混ぜてSFXを行いました。測定するタンパク質に選んだのは、結晶サイズ5~10μmのプロテイナーゼKと7~10μmのリゾチームです。測定波長はともに1.77オングストローム(Å、1Åは100億分の1メートル)で実験を行ったところ、それぞれ回折分解能[8]2.3Åの回折データセットを収集できました。測定時間は約1時間で、構造解析に利用可能な20,000~30,000枚の回折イメージを収集でき、プロテイナーゼKとリゾチームの結晶構造の決定に成功しました。その1例としてプロテイナーゼKの結晶構造を図に示します。
さらに、従来のグリースマトリックス法で結晶輸送媒体として使用していた鉱物油ベースのグリースを合成油ベースのグリースに変更してみました。合成油ベースのグリースは、鉱物油ベースのグリースに比べて、グリースに由来して回折イメージ上に現れるノイズ(散乱バックグランドノイズ)がより低いという特徴があります。そして、ヒアルロン酸水溶液の場合と同じように、2つのタンパク質の結晶を用いて測定波長1.77Åで実験を行ったところ、回折分解能2.3Åで結晶構造を決定することができました。また、合成油ベースのグリースとヒアルロン酸を使用した際の結果を比較したところ、ヒアルロン酸の方が散乱バックグランドがさらに低いことを確認しました。これら散乱バックグランドノイズの低い結晶輸送媒体を使用することで、結晶からの弱いシグナルも検出することができました。これにより、SACLAのX線レーザーを用いたSFXでは、結晶輸送媒体としてヒアルロン酸、および合成油ベースのグリースを使うことで、結晶構造の決定に十分な精度の回折イメージを収集できることを実証しました。
今後の期待
現在、結晶輸送媒体としてヒアルロン酸、およびグリースを用いて,さまざまなタンパク質のSFXを行っています。これら得られた実験結果から、測定するタンパク質結晶に適した媒体を事前に選択できるよう調査を進めています。
今後、ヒアルロン酸、およびグリースを相補的に利用することで、創薬ターゲットとなる膜タンパク質[9]を中心とした多様なタンパク質の構造解析が期待できます。これまで解析が困難であった創薬ターゲットタンパク質の構造を決定することで、タンパク質立体構造情報に基づく薬剤設計が行えるため、短期間での創薬に大きく貢献します。
原論文情報
- Michihiro Sugahara, Changyong Song, Mamoru Suzuki, Tetsuya Masuda, Shigeyuki Inoue, Takanori Nakane, Fumiaki Yumoto, Eriko Nango, Rie Tanaka, Kensuke Tono, Yasumasa Joti, Takashi Kameshima, Takaki Hatsui, Makina Yabashi, Osamu Nureki, Keiji Numata & So Iwata., "Oil-free hyaluronic acid matrix for serial femtosecond crystallography", Scientific Reports, DOI: 10.1038/srep24484
発表者
理化学研究所
放射光科学総合研究センター 利用技術開拓研究部門 SACLA利用技術開拓グループ
特別研究員 菅原 道泰(すがはら みちひろ)
グループディレクター 岩田 想(いわた そう)
大阪大学蛋白質研究所附属蛋白質解析先端研究センター
准教授 鈴木 守(すずき まもる)
京都大学大学院農学研究科
助教 桝田 哲哉(ますだ てつや)
高輝度光科学研究センターXFEL利用研究推進室
チームリーダー 登野 健介(との けんすけ)
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
補足説明
- 1.SACLA
理研と高輝度光科学研究センター(JASRI)が共同で建設した日本初のX線自由電子レーザー(XFEL:X-ray Free-Electron Laser)施設。加速器の中で電子の固まりを正確な制御の下で一斉に振動させ、その電子の固まりからX線レーザーを発生させるX線発生装置。2006年度から5年間の計画で建設・整備を進めた国家基幹技術の1つ。2011年3月に完成し、SPring-8 Angstrom Compact free-electron LAser の頭文字を取ってSACLAと命名された。 - 2.連続フェムト秒結晶構造解析(SFX)
FXはSerial Femtosecond Crystallographyの略。多数の微結晶を含む液体などをインジェクター(噴射装置)から噴出しながら、X線レーザーを照射し結晶の構造を解析する手法。配向の異なる多数の微小結晶からの回折イメージを連続的に収集する。 - 3.ヒアルロン酸
2つの糖(N-アセチルグルコサミンとグルクロン酸)を構成単位とする単純な直鎖高分子で、ほとんど全ての動物が細胞外マトリックスとして用いており、代替物質が存在しない。高分子はらせん状によじれているので曲がりにくく、水溶液中では空間いっぱいに拡がり、絡み合った網目のようなランダム構造を作るとともに大量の水分を保持する。 - 4.放射線損傷
X線の持つエネルギーによって、X線と相互作用した分子が壊れること。X線との相互作用で分子が壊れる場合だけでなく、分子が壊れる過程で生じる電子や、壊れた分子から生成する反応性の高い分子が観察対象の分子と化学反応する場合もある。一般的にタンパク質結晶の放射線損傷は、X線と水の相互作用をきっかけに、X線照射後ピコ秒(1ピコ秒は1兆分の1秒)の時間スケールで、水から生成する反応性の高い分子がタンパク質と化学反応することで起きる。 - 5.SPring-8
兵庫県播磨科学公園都市にある世界最高の放射光を生み出す、理研の大型放射光施設。その運転管理と利用者支援は高輝度光科学研究センター(JASRI)が行っている。SPring-8の名前はSuper Photon ring-8 GeVに由来する。 - 6.放射光
相対論的な荷電粒子(電子や陽電子)が磁場で曲げられるとき、その進行方向に放射される電磁波。放射光は明るく、指向性が高く、また光の偏光特性を自由に変えられるなどの優れた特徴を持つ。 - 7.アロガース、ハイドロゲル
水に良くなじむ物質によりナノサイズの3次元網目構造が形成されると、網目の中に閉じ込められた水分子は流動性を失い、系全体は固体状になる。このような物質をハイドロゲルと呼ぶ。身近な例として、寒天・ゼリー・豆腐・こんにゃくなどが挙げられる。アロガースは、寒天の主要な多糖成分である中性多糖。 - 8.回折分解能
タンパク質を構成しているアミノ酸の平均的な直径は5Å程度である。そのため、多くの場合、2Åの回折分解能で取得したデータから得られる構造で、各アミノ酸側鎖の配向などを鮮明に見ることができる。 - 9.膜タンパク質
生体膜を構成しているタンパク質で、全ゲノムをコードするタンパク質の3分の1を占める。生体膜の表面にあるタンパク質と内部に埋もれたタンパク質がある。生体膜の表面に付着しているものを膜表在性タンパク質、内部に埋もれているものを膜内在性タンパク質と呼ぶ。外界からの刺激に反応する受容体、イオンポンプなどの輸送体など、環境からの刺激を強く受けるタンパク質であるため、創薬の重要なターゲットとされ、高効率な構造・機能解析法の創出が待たれている。
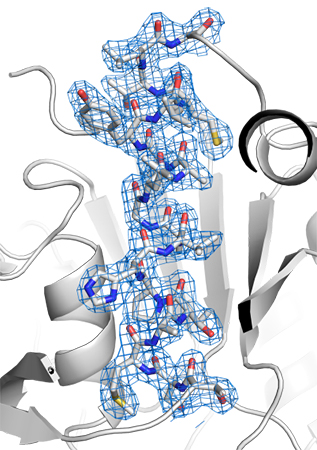
図 ヒアルロン酸を用いて決定したプロテイナーゼKの結晶構造
結晶輸送媒体として、高粘度のヒアルロン酸水溶液を用いて、1.77Åの波長でSFXを行い、プロテイナーゼKの結晶構造決定に成功した。図中の青色のメッシュは電子密度、メッシュ内スティックモデルの黄色は硫黄原子、青色は窒素原子、赤色は酸素原子、および灰色は炭素原子を示す。
