要旨
理化学研究所(理研)バイオリソースセンター遺伝工学基盤技術室の廣瀬美智子テクニカルスタッフⅡ、長谷川歩未テクニカルスタッフⅡ、持田慶司専任技師、小倉淳郎室長らの共同研究グループ※は、ゲノム編集技術を用いて野生マウスを穏やかな性質のマウスに改変することに成功しました。
実験用マウスの特長として、豊富なゲノム情報、多数の遺伝子改変系統、容易な取り扱いなどが挙げられます。一方で、実験用マウスの限られた遺伝的多様性を補うために、野生マウス系統の利用が進んでいます。野生マウスは、実験用マウスの亜種または近縁種です。しかしこれまで、野生マウスは遺伝子改変ができず、またその俊敏さにより日常の取り扱いも難しいという欠点がありました。
共同研究グループは2012年以降、バイオリソースセンターに保存される野生マウス系統の発生工学技術の開発を進め、多くの系統で体外受精、胚凍結、胚移植技術の確立に成功しています。そこで今回は、これらの発生工学技術とゲノム編集技術を組み合わせ、遺伝子改変野生マウスの開発を試みました。改変する遺伝子として、「馴化[1]」に関連すると考えられている「アグーチタンパク質の遺伝子」を選びました。アグーチタンパク質は被毛と脳に分布しています。このため、ゲノム編集技術によりアグーチタンパク質遺伝子が働かない野生マウスを作り出したところ、被毛が野生色から黒色に変化しました。また、行動解析試験の結果、人を恐れなくなる傾向が認められ、一部のマウスは人の手に乗るまでに馴化しました。この行動変化には、ドーパミン作動性神経細胞の制御の変化が関与している可能性が示されました。一方、血清生化学値など他の表現型には変化がなく、健康であることが確認されました。
本研究により開発された野生マウス系統はその取り扱いの容易さにより、今後、マウスの実験に広く用いられると期待できます。また、さまざまな遺伝子改変を行うことで、通常の実験用マウスでは作製できない新しい疾患モデルが誕生すると予想されます。さらに、これまで実験的に解析が難しかった、動物の毛色と行動・性質の関連についても明らかにされる可能性があります。
本研究成果は、英国のオンライン科学雑誌『Scientific Reports』(2月14日付け)に掲載されます。
本研究は、日本学術振興会 科学研究費補助金 新学術領域研究「核移植技術を用いた生殖サイクルのエピジェネティクス変化の解析」の支援を受けて行われました。
※共同研究グループ
理化学研究所 バイオリソースセンター
遺伝工学基盤技術室
テクニカルスタッフⅡ 廣瀬 美智子(ひろせ みちこ)
テクニカルスタッフⅡ 長谷川 歩未(はせがわ あゆみ)
専任技師 持田 慶司(もちだ けいじ)
研究員 的場 章悟(まとば しょうご)
特別研究員 畑中 勇輝(はたなか ゆうき)
専任研究員 井上 貴美子(いのうえ きみこ)
室長 小倉 淳郎(おぐら あつお)
マウス表現型解析開発チーム
開発研究員 金田 秀貴(かねだ ひでき)
開発技師 山田 郁子(やまだ いくこ)
開発研究員 古瀬 民生(ふるせ たみお)
チームリーダー 若菜 茂晴(わかな しげはる)
疾患ゲノム動態解析技術開発チーム
チームリーダー 阿部 訓也(あべ くにや)
宮崎大学 テニュアトラック推進機構
准教授 本多 新(ほんだ あらた)
帯広畜産大学 畜産生命科学研究部門
助教 後藤 達彦(ごとう たつひこ)
名古屋大学大学院生命農学研究科 生殖科学研究室
教授 束村 博子(つかむら ひろこ)
准教授 上野山 賀久(うえのやま よしひさ)
背景
実験用マウスは、現在世界中で最も広く実験に用いられている哺乳動物です。マウスは実験動物として、数多くの優れた特長を持っています。例えば、繁殖能力が高く世代交代期間も短いため、育種改良や実験用個体数の確保が容易です。また、100年以上にわたる遺伝学実験への応用により、近交系[2]を始めとするさまざまな種類の系統が作り出され、また豊富なゲノム情報も蓄積されています。さらに、1980年代に開発されたトランスジェニックマウス[3]およびノックアウトマウス[4]などの遺伝子改変技術は、マウスの医学生物学における実験動物としての価値を一気に高めました。しかし、これまでの実験用マウスの育種は、一定の遺伝子背景の中で行われてきたため、その遺伝的多様性は限られています。そこで、世界中に分布する野生マウスの豊富な遺伝子プールが注目され、現在、その利用が拡大しています。
野生マウスは、実験用マウスの亜種または近縁種です。理研バイオリソースセンターでも約50系統の近交系野生マウス系統が維持されており、世界中に提供されています。その中で最も広く用いられているのは、故森脇和郎氏(前理研バイオリソースセンター センター長)が樹立した「MSM/Ms系統(MSM系統)」です。静岡県三島市で捕獲された野生マウスに由来し、欧米で育成されてきた多くの実験用近交系マウスよりも小型で、がんや肥満になりにくいという特性を持っています。しかし、野生由来の俊敏性により取り扱いが容易でなく、遺伝子改変個体の作製が難しいという欠点を持っていました。
共同研究グループは、MSM系統を始めとする野生マウスの安定的保存と提供のために、2013年までにほぼ全ての野生マウス系統の過剰排卵[5]、体外受精、受精卵凍結保存、胚移植技術などの発生工学技術を確立しました。今回は、これらの技術を利用し、ノックアウトMSM系統の樹立を目指すとともに、その遺伝子改変により野生MSMマウスの俊敏性を抑制することを試みました。
研究手法と成果
共同研究グループはノックアウトMSM系統を作り出すために、「CRISPR/Cas9法[6]」と呼ばれるゲノム編集技術を応用しました。この方法は、細菌や古細菌に発達した適応免疫システムを利用したもので、多くの生物種でゲノム配列の任意の場所を編集できることが知られています。マウスでは、受精卵を用いたCRISPR/Cas9法により、ノックアウトマウスが作製できることが報告されています。そこで、共同研究グループは、自ら開発した過剰排卵および体外受精技術によりMSM系統の受精卵を多数作製し、CRISPR/Cas9法を試みました。
ターゲットとする遺伝子として、「アグーチタンパク質の遺伝子」を選びました。この遺伝子を選んだ理由の一つに、アグーチタンパク質が代表的な被毛色を制御するタンパク質のため、生まれた野生マウスの被毛色の変化(主に黒色に変化)によりノックアウトがすぐに分かるという利点が挙げられます。もう一つの理由は、アグーチタンパク質遺伝子が家畜や野生動物の毛色との関係から、「馴化」に関係する遺伝子の一つであると推察されていることです。例えば、黒いキツネは、通常の茶色のキツネよりも人を恐れないことが報告されています。したがって、野生マウスのノックアウトならではの表現型の変化が期待できます。
アグーチタンパク質遺伝子ノックアウト用のCRISPR/Cas9 DNAを導入したMSMマウス受精卵から3匹の子どもが生まれましたが、全て黒色でした(図1)。これは、目的の遺伝子にホモ変異[7]が導入されたことを示しています。これらのマウスから変異マウス系統を樹立し、表現型解析[8]を行ったところ、被毛色以外の解剖学的所見および血清・尿生化学値には、元のMSMマウスとの差は認められませんでした。しかし行動解析を行ったところ、1日の明期[9]に活動をする傾向、そして人を忌避しない傾向が認められました(図2)。これらは、通常の実験用マウスに多くみられる性質です。
さらに、行動の制御に重要な働きをする中脳[10]の遺伝子発現を調べたところ、ドーパミン[11]の細胞内への再回収を促進するドーパミントランスポーター[12]遺伝子Slc6a3の発現が上昇していることが分かりました。また、この遺伝子領域では、H3K27me3抑制性ヒストン[13]の蓄積が低下していました。これらのことから、このノックアウトMSMマウスの行動変化には、ドーパミン作動性神経細胞の制御の変化が関与している可能性が示されました。
今後の期待
本研究は、ゲノム編集技術が野生マウスにも応用できることを示しました。今後、貴重な遺伝資源である野生マウスにさまざまな遺伝子改変を行うことで、通常の実験用マウスでは作製できない新しい疾患モデルが誕生すると予想されます。
また、今回作出されたノックアウトMSM系統は、その取り扱いの容易さから、遺伝子改変野生マウス作出や遺伝子多型(遺伝子の個体差)を利用した研究に広く使われ、マウスを用いた医学生物学に新しい局面を開くと期待できます。これまで実験的に解析が難しかった、動物の毛色と行動・性質の関連についても明らかにされる可能性があります。
原論文情報
- Michiko Hirose, Ayumi Hasegawa, Keiji Mochida, Shogo Matoba, Yuki Hatanaka, Kimiko Inoue, Tatsuhiko Goto, Hideki Kaneda, Ikuko Yamada, Tamio Furuse, Kuniya Abe, Yoshihisa Uenoyama, Hiroko Tsukamura, Shigeharu Wakana, Arata Honda, Atsuo Ogura, "CRISPR/Cas9-mediated genome editing in wild-derived mice: generation of tamed wild-derived strains by mutation of the a (nonagouti) gene", Scientific Reports, doi: 10.1038/srep42476
発表者
理化学研究所
バイオリソースセンター 遺伝工学基盤技術室
テクニカルスタッフⅡ 廣瀬 美智子(ひろせ みちこ)
テクニカルスタッフⅡ 長谷川 歩未(はせがわ あゆみ)
専任技師 持田 慶司(もちだ けいじ)
室長 小倉 淳郎(おぐら あつお)
 (左から)廣瀬美智子、持田慶司、長谷川歩未
(左から)廣瀬美智子、持田慶司、長谷川歩未
報道担当
理化学研究所 広報室 報道担当Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部お問い合わせフォーム
補足説明
- 1.馴化
生物が新しい環境に適応・順応すること。今回の場合、野生由来の俊敏で警戒心の強い性質から実験動物にみられる扱いやすい性質へと変化がみられたことをいう。 - 2.近交系
兄妹交配を20世代以上継続して維持している系統。理論上、系統内の全ての個体は同じ遺伝子組成を持つ。 - 3.トランスジェニックマウス
遺伝子改変マウスの一種。人為的操作により外来遺伝子を導入したマウス。 - 4.ノックアウトマウス
遺伝子改変マウスの一種。遺伝子操作により標的遺伝子を欠損させたマウス。特定の遺伝子を破壊しそれにより生じた個体の変化から、その遺伝子の機能を明らかにしたり、ヒト疾患のモデルマウスとして用いることができる。 - 5.過剰排卵
ホルモンを投与することにより、自然排卵数よりも多い卵子を得ようとする方法。通常、マウスではeCG(ウマ血清性性腺刺激ホルモン)とhCG(ヒト胎盤性性腺刺激ホルモン)を組み合わせて用いるが、MSMマウスでは、eCGの代わりにインヒビンというホルモンに対する抗体を投与して過剰排卵をできる。 - 6.CRISPR/Cas9法
ゲノム上の標的領域と相補的なsgRNA(single guide RNA)とCas9ヌクレアーゼの二つにより、ゲノム改変を行うゲノム編集技術の一つ。sgRNAのデザインや作製が簡便な上、技術的開発も進められており、さまざまな生物のゲノム改変で最も多用されている。特に、受精卵や初期胚でも、効率よく特異的に標的配列に二重鎖切断を導入することができるため、ES細胞やiPS細胞のない生物種にも利用できる。さらに、母方由来と父方由来の両方の遺伝子を同時に標的破壊できるほど効率が高いため、一気にホモ接合ノックアウト生物が得られるのも特長となっている。
CRISPR-Cas9はクリスパーキャスナインと読む。 - 7.ホモ変異
哺乳類の体細胞には、父方母方それぞれに由来する染色体がペアで存在する。よって、常染色体(XおよびY性染色体以外の染色体)上の遺伝子は、父方および母方の2つ遺伝子座からなる。この両方の遺伝子座に変異が入っていることをホモ変異という。劣性遺伝の変異は、ホモ変異になることで、表現型が現れる。ホモは、英語のhomozygousの略。 - 8.表現型解析
理研バイオリソースセンターマウス表現型解析開発チーム(マウスクリニック)では、ヒト疾患病態の理解に基づいて、さまざまな表現型の検査項目(形態、行動、血算・生化学、剖検等)を解析し、マウス系統の表現型を網羅的に明らかにすることができる。 - 9.明期
実験動物の飼育室は照明の点灯時間を調整して、1日24時間を明期と暗期に分けることが多い。マウスは本来、夜行性であるが、実験用マウスは明期における活動量が増える。 - 10.中脳
大脳と脊髄、小脳を結ぶ伝導路となっている。反射運動や行動など、さまざまな神経活動を調整している。 - 11.ドーパミン
神経伝達物質の一つ。運動調節、ホルモン調節、快の感情、意欲、学習などに関わる。 - 12.ド-パミントランスポーター
ドーパミン作動性シナプスにおいて、細胞外に放出されたドーパミンを細胞膜上に再回収する。その活動は神経伝達の効率を左右する。 - 13.H3K27me3抑制性ヒストン
DNAを巻き付ける核タンパク質であるコアヒストンは、球形のカルボキシル末端と、直鎖状のアミノ末端(ヒストンテール)からなっている。ヒストンテールは、その構成するアミノ酸がアセチル化やメチル化修飾を受けることで、そのヒストン部位の遺伝子発現を調整している。H3K27me3は、H3ヒストンテールの27番目のアミノ酸であるリジンにメチル基が三つ結合している修飾状態であり、遺伝子の発現を抑制することが多い。
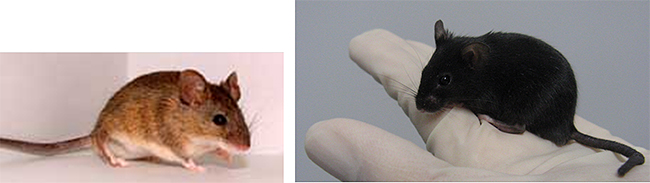
図1 遺伝子改変前のマウスと遺伝子改変後のマウス
左:遺伝子改変前の野生MSMマウス。理研バイオリソースセンターホームページより転載。
右:アグーチタンパク質遺伝子ノックアウトMSMマウス。アグーチタンパク質遺伝子ノックアウトMSMマウスは黒色に変化した。また、人の手に乗ったままになる個体も現れた。
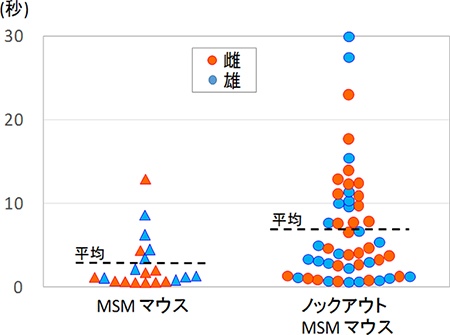
図2 Stay-on-hand testの結果
馴化の程度を測るために、手に乗っている時間を測定した(Stay-on-hand test)。アグーチタンパク質遺伝子ノックアウトMSMマウスは、人の手の上に乗っている時間が有意に長いことが分かる。
