理化学研究所(理研)放射光科学研究センターイメージング開発チームの眞木さおり研究員、生体機構研究グループの米倉功治グループディレクターらの共同研究チーム※は、クライオ電子顕微鏡[1]を用いた単粒子解析法[2]と放射光を用いたX線結晶構造解析[3]を組み合わせ、細胞内に流れ込む水素イオンをエネルギーとしてさまざまな生命活動に利用する膜タンパク質[4]の3次元構造の決定に成功しました。これにより、膜タンパク質がダイナミックに構造を変化させることで活性化する新しい作動機構を発見しました。
このダイナミックな構造変化は、他の膜タンパク質でも機能の制御などに利用されている可能性が考えられます。同様の手法を用いて、さまざまなタンパク質などの生体分子の機能発現に伴う構造変化を解析することで、より詳細な作動機構の解明につながると期待できます。
今回、共同研究チームは、クライオ電子顕微鏡と放射光の両者を組み合わせ、膜タンパク質ExbB/ExbD複合体の構造解明に取り組みました。その結果、イオンの通り道が塞がった状態の5量体のリング状の構造が、6量体のリングに変化することで水素イオンの通り道が開き、イオンの流れを駆動力に利用できる状態へと変わることが分かりました。これまで、膜タンパク質のこのような大きな形態の変化は知られていません。また、ExbB/ExbD複合体の中央にあるサブユニットが回転することにより化学物質や栄養素の輸送に必要な力学的エネルギーが発生する可能性が示されました。ExbB/ExbDが関わる輸送系は抗生物質の輸送やウイルスの菌内への侵入にも利用されるため、細菌特異的に作用する薬の開発も期待できます。
本研究成果は、米国のオンライン科学雑誌『eLife』(4月17日付け)に掲載されます。
※共同研究グループ
理化学研究所 放射光科学研究センター
XFEL研究開発部門 ビームライン研究開発グループ イメージング開発チーム
研究員 眞木 さおり(まき さおり)
利用技術開拓研究部門 生体機構研究グループ
グループディレクター 米倉 功治(よねくら こうじ)
特別研究員(研究当時) 松岡 礼(まつおか れい)
特別研究員(研究当時) 山下 良樹(やました よしき)
パートタイマー(研究当時) 田中 麻衣子(たなか まいこ)
パートタイマー 岩蕗 文恵(いわぶき ふみえ)
福井大学 医学部
講師 清水 啓史(しみず ひろふみ)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究C「プロトン駆動力変換機構に関わる細菌ExbB-ExbD-TonBの構造研究(研究代表者:眞木さおり)」、基盤研究B「イオン駆動力供給体の電子線とX線による作動機構の解明(研究代表者:米倉功治)」などの支援を受けて行われました。
背景
原核生物から高等動物に至るまで、細胞膜で仕切られた細胞の内と外との水素イオンの濃度の差は、生命活動の根源的なエネルギーの源となります。例えば、このエネルギーを使って、アデノシン三リン酸(ATP)[5]合成、栄養素の輸送、合成したタンパク質の輸送、薬剤の取り込みや排出、運動の駆動などが行われています。このイオンの濃度差は、脂質でできた細胞膜をイオンが透過できないことにより保たれています。細胞膜に埋まっている膜タンパク質を通してイオンが流れると、これを駆動力として種々の反応が進行します。「ExbB」と「ExbD」と呼ばれる膜タンパク質は複合体を形成して、水素イオンを透過するイオンチャネル[6]となります。そして、細菌がさまざまな化学物質や栄養素を輸送する際に駆動力を与える役割を担っています。また、ExbB/ExbDが関わる輸送系は、ウイルスの細胞内への侵入に利用されることも知られています。そのため、この膜タンパク質の立体構造を解明することは、細菌に特異的に作用する薬の開発につながると期待されます。
生体分子の立体構造を決める手法として最も一般的な「X線結晶構造解析」では、対象のタンパク質の結晶を作製することが必要です。しかし、重要な生命機能を担う膜タンパク質や巨大なタンパク質複合体の場合、結晶作製は非常に難しく、構造解明が遅れています。
一方、クライオ電子顕微鏡の「単粒子解析」では、タンパク質溶液を急速に凍結した試料を電子顕微鏡で撮影し、得られた2次元の分子像からコンピュータで、その立体構造を再構成することができます。この手法では結晶を必要とせず、生理的な溶液中のタンパク質の立体構造を明らかにできますが、これまで高い空間分解能の信号を記録する撮像装置が存在せず、詳細な構造情報を得ることはできませんでした。しかし、この数年の急速な技術革新により、理想的な試料からはX線結晶構造解析に匹敵する高い空間分解能で構造が決定できるようになりました。今回明らかにされた構造を例に、技術革新前と後の構造を比較すると、技術革新後は格段に精細な構造が可視化できることが分かります(図1)。
研究手法と成果
共同研究チームは、大量に発現、精製したタンパク質溶液を薄い氷に凍結し、放射光科学研究センターのクライオ電子顕微鏡でスクリーニングを行いました。単粒子解析に適した凍結試料を、最新のカメラを備えた米国カリフォルニア大学サンフランシスコ校の電子顕微鏡とイギリスの放射光施設Diamond Light Sourceの共用電子顕微鏡で撮影し、得られた像から単粒子解析を行いました(図1下)。並行して、試料の結晶化を進め、大型放射光施設「SPring-8[7]」の強力なX線によるX線結晶構造解析を進めました。X線結晶構造解析からはExbBの詳細な構造を、単粒子解析からは空間分解能はやや劣るが結晶格子に縛られないExbB/ExbD複合体の構造を、それぞれ得ることができました。両者を組み合わせた結果、ExbB/ExbD複合体の詳細な構造と活性化の機構の解明に成功しました(図2)。
X線結晶構造解析からは、ExbBの6量体のリング状構造が決定できましたが、ExbDに関する構造情報を得ることができませんでした。これは、ExbD分子は柔軟性が高く、結晶構造解析の前提となる構造のそろった同一状態が結晶中で保たれていなかったこと、また、結晶中へのExbDの収まりが悪く、多くのExbD分子が結晶から除かれてしまったことが原因と考えられました。
一方、クライオ電子顕微鏡の単粒子解析からは、ExbDの3量体がExbBの6量体に取り囲まれた状態で存在していることが分かりました。ExbDの3量体は、水素イオンの通路を形成し、機能に重要な役割を果たす部位を持っています。単粒子解析法では、同じ立体構造をとる分子像を選択することができ結晶格子に縛られない分子構造が得られるという長所があります。今回の発見は、この長所が反映された結果といえます。
また、単粒子解析では、ExbBの5量体とExbDの単量体からなる構造も得られました(図3右)。さらに、この5量体の構造はイオン透過活性が低下する低いpH(pH 5.4)で多く形成され、逆に、6量体の構造はイオン透過活性が上昇する高いpH(pH 7 - 8)で多くなることが明らかになりました。
実験を進め、脂質膜中でタンパク質が並んだ2次元の結晶を作製し、画像解析したところ、より生理的な環境に近い状態においても5量体と6量体の両者が含まれることも分かりました。また、水素イオン透過を計測するなど種々の解析を行った結果、この二つの構造が相互に変換することが示され、この形態変化が実際に起こっていることが明らかになりした。これまで、機能発現の制御のため、膜タンパク質がこのように大きく変化することはこれまで知られていませんでしたが、以上の実験により、このイオンチャネルの活性制御にはダイナミックな構造変化が起こることが示されました(図3)。
細胞膜は流動性が高いため、このようにタンパク質が大きく形態を変えることができると考えられます。また、5量体と6量体の変換は、ExbBの分子間の反発力がpHにより変化し、pHの高いときには分子間の距離が離れた6量体が安定化され、pHが低いときには分子間がより密な5量体が安定化されることが示されました。
活性化状態の構造では、ExbBの6量体リング構造に取り囲まれExbDの3量体が収まり、水素イオンの通路を形成します(図2、3)。ExbDはリング内に非対称に配置し、周りのExbBは隣のサブユニットに対して生体膜に垂直に少しずつずれた、らせん状に並ぶことが分かりました。この配置から、水素イオン流が渦を巻くことで回転力が生じ、ExbDの3量体がリング内を回転運動する力学的エネルギーに変換されると考えられます。これにより、化学物質や栄養素の輸送が実現されます。
先に述べたように、X線結晶構造解析は、結晶中の分子の構造が同一であることが必要で、結晶中の個々の分子の構造の違いは原理的に可視化できません。一方、クライオ電子顕微鏡で得られる画像には、そのタンパク質が取り得るさまざまな構造状態の分子像が混在します。それらの画像を分類しそれぞれ3次元再構成することができれば、ここで示したように分子の機能発現に伴う構造、構造変化を実験的に明らかにすることが可能になります。
今後の期待
解析したExbB/ExbDなどのイオンチャネルは、分子量が大きくない膜タンパク質であるためクライオ電子顕微鏡像のコントラストが低く、単粒子解析による構造解析が最も難しい試料でした。本研究では、このような構造解析が困難な試料からでも、活性化状態と不活性化状態における二つの異なる構造が解析できることが示されました。
今後、機能発現に伴う多数の中間体の構造解析から分子の動きを可視化できれば、生体分子のより詳細な作動機構の解明につながります。実際、本研究によって、これまで知られていなかった膜タンパク質のダイナミックな形態変化という新しい現象が明らかになりました。同様の動きは、他の膜タンパク質でも機能の制御などに利用されている可能性が考えられます。このような研究を通じて、実際に薬剤が機能していく段階や過程を可視化することで、新しい創薬技術の創出へと発展することも期待できます。
原論文情報
- Saori Maki-Yonekura, Rei Matsuoka,Yoshiki Yamashita, Hirofumi Shimizu, Maiko Tanaka, Fumie Iwabuki, and Koji Yonekura, "Hexameric and pentameric complexes of the ExbBD energizer in the Ton system", eLife, 10.7554/eLife.35419
発表者
理化学研究所
放射光科学研究センター XFEL研究開発部門 ビームライン研究開発グループ イメージング開発チーム
研究員 眞木 さおり(まき さおり)
放射光科学研究センター 利用技術開拓研究部門 生体機構研究グループ
グループディレクター 米倉 功治 (よねくら こうじ)
 眞木 さおり
眞木 さおり
 米倉 功治
米倉 功治
報道担当
理化学研究所 広報室 報道担当
Tel: 048-467-9272 / Fax: 048-462-4715
お問い合わせフォーム
産業利用に関するお問い合わせ
補足説明
- 1.クライオ電子顕微鏡
タンパク質などの生体分子を、水溶液中の生理的な環境に近い状態で、電子顕微鏡で観察するために開発された手法。まず、試料を含む溶液を液体エタン(約-170℃)中に落下させ急速凍結し、アモルファス(非晶質、ガラス状)な薄い氷に包埋する。これを液体窒素(-196℃)冷却下で、電子顕微鏡観察する。電子顕微鏡内の真空中で試料は氷中に保持でき、また、冷却することで電子線の照射による損傷を減らせる。Jacques Dubochetは氷包埋の手順を作り、2017年度のノーベル化学賞の受賞者の一人に選ばれた。 - 2.単粒子解析法
電子顕微鏡で撮影した多数の生体分子の像から、その立体構造を決定する構造解析手法。結晶を作製しなくても分子の構造が得られるが、特殊な形態の試料を除いて、到達できる空間分解能(細かい構造を可視化できる指標)が高くできないことが問題であった。しかし、この状況はここ数年で大きく進展し、理想的な試料ではX線結晶構造解析に匹敵する分解能の構造が決定され、原子モデルの構築ができるようになってきた。この進展は、主として電子線直接検出型の量子検出効率のよい高速カメラの開発と、統計に基づく画像解析アルゴリズムの導入によりもたらされた。2017年度のノーベル化学賞の受賞者の一人、Joachim Frankにより単粒子解析法の基礎が作られた。 - 3.X線結晶構造解析
生体分子の立体構造を決める手法として最も一般的な手法。精製したタンパク質試料に塩、添加化合物の種類、濃度、pH、温度などの条件を探索して、分子が規則正しく並んだ結晶を作製する。得られた結晶にSPring-8などの放射光施設の強力なX線を照射し、散乱されて得られた回折パターンの強度情報から、立体構造を計算し、原子モデルを構築する。この手法では、数マイクロメートル~百マイクロメートル(μm、1μmは100万分の1メートル)サイズの良質な結晶が必要とするが、結晶化が非常に難しい試料も多い。 - 4.膜タンパク質
細胞膜を構成しているタンパク質で、全ゲノムがコードするタンパク質の3分の1を占める。細胞膜の表面にあるタンパク質と内部に埋もれたタンパク質がある。細胞外のシグナルを捕える受容体、細胞膜を介して物質の出入を担うチャネルやポンプ、細胞同士の結合に関わる接着分子など、生命活動に重量な役割を果たす。疾病に関連しているものも多く創薬の重要なターゲットとされるが、結晶化が難しく構造解析が最も進んでいない。 - 5.アデノシン三リン酸(ATP)
アデノシンに三つのリン酸基が結合したもので、加水分解により得られるエネルギーが生命活動に利用されている。殆どの生物でATPが使われている。 - 6.イオンチャネル
生体内では細胞の内外にさまざまなイオンが存在するが、その濃度は細胞の内外で差がある。細胞膜などの生体膜上にあり、細胞の内外のイオンの濃度差を調節する分子のうち、イオンを濃度勾配に従って透過させるものをイオンチャネルという。 - 7.SPring-8
理研が所有する、兵庫県の播磨科学公園都市にある世界最大かつ最高性能の大型放射光施設。SPring-8の名前はSuper Photon ring-8 GeVに由来する。放射光(シンクロトロン放射)とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する細く強力な電磁波のこと。SPring-8では、遠赤外から可視光線、軟X線を経て硬X線に至る幅広い波長域で放射光を得ることができるため、原子核の研究からナノテクノロジー、バイオテクノロジー、産業利用や科学捜査まで幅広い研究が行われている。タンパク質の結晶構造解析の分野でも、大きな成果を上げている。

図1 クライオ電子顕微鏡による単粒子解析の比較
膜タンパク質ExbB/ExbD複合体の構造解析。タンパク質やその複合体を含む溶液を急速凍結し、アモルファスな薄い氷に包埋する。液体窒素で冷却した状態の試料を電子顕微鏡で撮影する(左)。得られた顕微鏡像から、多くの分子像(赤丸)を集め電子線の投影方向の似た分子像を分類することで、2次元のクラス平均像を得る(中央)。さまざまな向きの2次元像を基に、3次元構造を計算で構築する(右)。上段はクライオ電子顕微鏡の技術革新前、下段は新しいカメラが導入された技術革新後の構造解析例。左上段の分子像(赤丸)がにじんでいるように見えるのに対して、左下段ではシャープである。これを反映して2次元平均像(中央)と3次元再構成(右)で、格段に精細な構造が可視化できる。
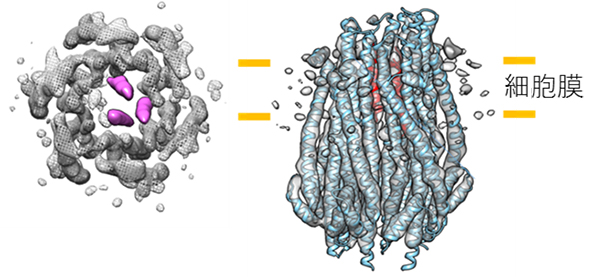
図2 ExbB/ExbD複合体の6量体の構造
- 左) クライオ電子顕微鏡の単粒子解析で得られた構造を、”細胞膜に垂直な方向から”見た図。中央の桃色の三本のαヘリックスはExbDに由来し、水素イオン透過とその駆動力の活用に重要な機能を持つ。その周りは、ExbBの各サブユニット(灰色の網目)に相当する。
- 右) “細胞膜に水平な方向から”見た図に、クライオ電子顕微鏡の単粒子解析した構造にX線結晶構造解析で得られた原子モデルを重ねて表示した。X線結晶構造解析では、外側のExbBの6量体の構造(水色)のみしか得られなかった。クライオ電子顕微鏡の構造をもとに構築したExbDのモデル(赤色)も重ねて表示している。ExbBの各サブユニットは、膜に垂直な方向に少しずつずれ、らせん状に配置するなど、結晶構造との違いも明瞭になった。
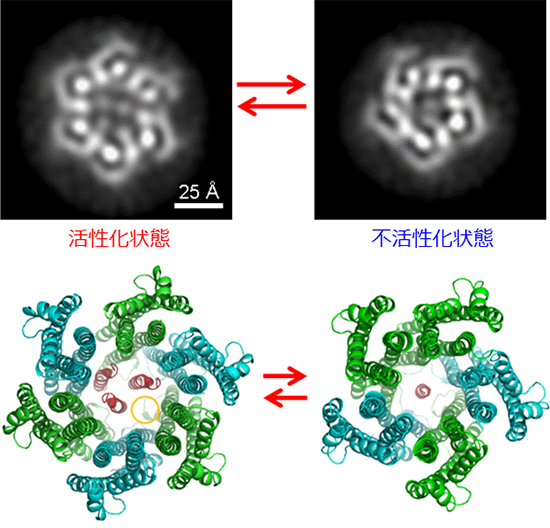
図3 ExbB/ExbD複合体の6量体と5量体の構造変化による活性制御の機構
上段はクライオ電子顕微鏡の分子像の2次元平均、下段はその原子モデル。左の活性化状態(ExbBの6量体とExbDの3量体)では、黄色の丸で示した水素イオンの通り道が形成されるが、右の不活性化状態(ExbBの5量体とExbDの単量体)では、水素イオンが透過するスペースは存在しないことが分かる。なお、1Å(オングストローム)は100億分の1メートル。
