理化学研究所(理研)開拓研究本部岩崎RNAシステム生化学研究室の岩崎信太郎主任研究員、陈明明国際プログラム・アソシエイト、七野悠一基礎科学特別研究員、水戸麻理テクニカルスタッフI、斉藤大寛研修生、袖岡有機合成化学研究室の袖岡幹子主任研究員、闐闐孝介専任研究員、藤原広一特別研究員(研究当時)、生命機能科学研究センター翻訳構造解析研究チームの伊藤拓宏チームリーダー、髙橋真梨技師、環境資源科学研究センター生命分子解析ユニットの淺沼三和子技師らの国際共同研究グループは、抗がん作用を持つ植物由来の翻訳阻害剤「ロカグラミドA」の標的タンパク質として、翻訳開始因子[1]「DDX3[2]」を新たに同定しました。
本研究成果は、今後、ロカグラミドAの作用効果のより高いがん細胞を予測することにつながると期待できます。
現在、ロカグラミドAは有効な抗がん剤として研究が進められており、標的である翻訳開始因子「eIF4A[2]」に結合することで翻訳を阻害し、がん細胞の増殖を抑制することが分かっています。
今回、国際共同研究グループは、ロカグラミドAの標的タンパク質に蛍光標識を導入することで、eIF4Aに加えてDDX3を同定しました。さらに、その作用メカニズムの理解から、通常の翻訳阻害剤とは異なり、ロカグラミドAの細胞増殖抑制効果はDDX3およびeIF4Aの発現量が多いがん細胞ほど高いことが分かりました。
本研究は、科学雑誌『Cell Chemical Biology』の掲載に先立ち、オンライン版(12月8日付:日本時間12月9日)に掲載されました。

ロカグラミドAの標的(左)とがん細胞増殖抑制効果(右)
背景
近年、抗がん作用を持つ「ロカグラミドA」という翻訳阻害剤が注目を集めています。ロカグラミドAは、新型コロナウイルス感染症(COVID-19)の原因ウイルスであるSARS-CoV-2に対する抗ウイルス作用(ウイルス増殖抑制効果)も持つことが明らかになりつつあります注1)。
ロカグラミドAは、アグライア(Aglaia odorata、和名:樹蘭)という植物が産生する二次代謝産物[3]であり、標的タンパク質である翻訳開始因子「eIF4A」に結合することで翻訳を阻害し、がん細胞の増殖を抑制します。これまで、ロカグラミドAはeIF4A以外のタンパク質も標的とすることが示唆されつつも、その詳細は分かっていませんでした。また、ロカグラミドAは特定のがん細胞に対してより効果的に作用することが知られていましたが、それがどのような性質の細胞なのかは未解明のままでした。
- 注1)Gordon et al., Nature 583(7816):459-468. (2020); Müller et al., BioRxiv doi: 10.1101/2020.11.24.389627
研究手法と成果
国際共同研究グループはまず、ロカグラミドA(RocA)にO-NBD(ニトロベンゾオキサジアゾール)と呼ばれる特殊な反応基を結合させた化合物(RocA-O-NBD)を有機合成しました。O-NBD基は、近くのタンパク質のリジン残基と反応し、蛍光性のN-NBD基へと変化します。この性質を利用し、RocA-O-NBDはその分子の近くに存在するロカグラミドAの標的タンパク質に蛍光標識を導入することができます(図1A)。また、蛍光標識された標的タンパク質は質量分析法[4]により同定できます。
実際に、RocA-O-NBDをウサギ網状赤血球抽出液中で反応させたところ、翻訳開始因子としてeIF4Aに加えて「DDX3」を新たに同定しました(図1B)。また、培養細胞でDDX3をノックダウン[5]したところ、ロカグラミドAによる細胞増殖抑制の効率が減少することが分かりました。
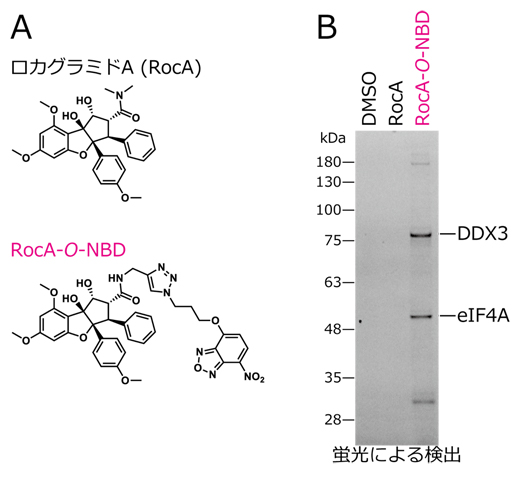
図1 RocA-O-NBDによる翻訳開始因子DDX3の同定
- A)ロカグラミドA(RocA)とRocA-O-NBDの化学構造。RocA-O-NBDは、その分子の近くに存在するRocAの標的タンパク質に蛍光標識を導入できる。
- B)RocA-O-NBDによって蛍光標識されたタンパク質の検出結果。質量分析により、eIF4AとDDX3が同定された。
eIF4AやDDX3はRNA結合タンパク質[6]ですが、RNA配列特異性[6]を持ちません。しかし、ロカグラミドAと結合したeIF4Aには、アデニン(A)やグアニン(G)塩基が連続した配列(ポリプリン配列)に対する新しいRNA配列特異性が生じます。これにより、ポリプリン配列を持つRNAからの翻訳が阻害されます。同様のことがDDX3にも生じていることが分かりました。
また、アグライアからRNAを単離し、次世代シーケンサー[7]を用いた解析によりトランスクリプトーム[8]を再構築することで、アグライアのDDX3遺伝子の塩基配列を明らかにしました。そして、アグライアDDX3には特異的な点突然変異[9]が生じていることが分かりました。この点突然変異をヒトDDX3に付与するとロカグラミドAが作用できなくなることから、アグライアは進化上、ロカグラミドAの標的タンパク質の遺伝子に変異を獲得することで、ロカグラミドAが自分自身を攻撃しないように翻訳開始因子を変化させたことが明らかになりました。
通常の翻訳阻害剤は、その標的タンパク質の量が多いほど翻訳阻害効果が弱まります。しかし、ロカグラミドAはその逆で、標的タンパク質の量が多いほどRNAに結合するeIF4AおよびDDX3が多くなり、結果的に翻訳阻害効果が高まることが分かりました(ドミナントネガティブ作用)。このことから、ロカグラミドAが作用しやすいがん細胞では、その標的であるeIF4AおよびDDX3が過剰発現している可能性が考えられました。そこで、数種のがん細胞を調べたところ、ロカグラミドAの作用効果はeIF4AおよびDDX3の発現量と相関することが明らかになりました(図2A,B)。
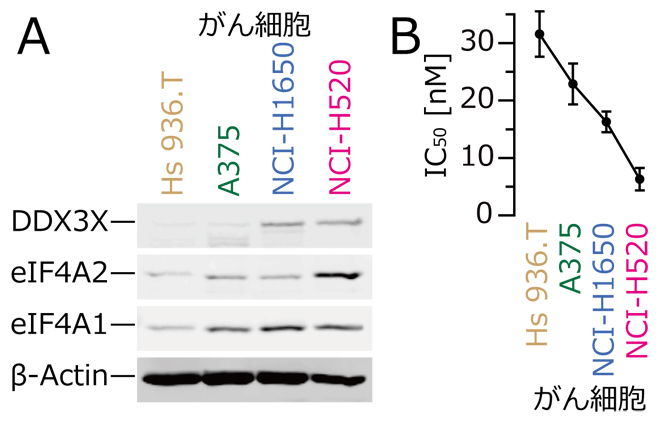
図2 がん細胞におけるロカグラミドA標的タンパク質の発現とがん細胞増殖抑制効果
- A)Hs 936.TとA375はヒト皮膚がん細胞、NCI-H1650とNCI-H520はヒト肺がん細胞。各がん細胞におけるeIF4A1、eIF4A2、DDX3(X)タンパク質の発現量の違い。右の列のがん細胞ほど発現量が多かった。
- B)ロカグラミドAによる細胞増殖抑制効果は、がん細胞ごとに異なる。ロカグラミドAの効果の程度をIC50(50%阻害濃度)で表した(数字が小さいほど、阻害効果が高い)。標的タンパク質の発現量が高いがん細胞ほど、よく増殖抑制を受けることが分かった。
今後の期待
現在、ロカグラミドAは抗がん剤として有望視されている小分子化合物です。本研究でその標的タンパク質と作用メカニズムが明らかになったことにより、より効果の期待できるがん細胞を予測することが可能になりました。今後は、事前にがん細胞の性質を調べることにより、ロカグラミドAが効きやすいかどうかを事前に診断できるようになると期待できます。
補足説明
- 1.翻訳開始因子
翻訳の開始に必須なタンパク質群を指す。特に、真核生物の翻訳開始因子はeukaryotic translation initiation factor(eIF)と略される。タンパク質合成装置であるリボソームをmRNA上に集める役割を持つ。 - 2.eIF4A、DDX3
どちらも翻訳開始因子の一つであるDEAD-box型RNA結合タンパク質。mRNAの5非翻訳領域に結合し、RNAの二次構造を解きほぐすなどの機能により、翻訳開始を促進すると考えられている。 - 3.二次代謝産物
生物体を構成、維持する上で重要な物質を一次代謝産物と呼ぶ。一方、生育そのものには必要とされない代謝産物を二次代謝産物と呼び、抗生物質などが含まれる。 - 4.質量分析
物質をイオン化し、そのイオンを検出することにより、原子や分子の質量を推定する分析法。 - 5.ノックダウン
小分子RNAなどの手法により、遺伝子の発現が抑制されること。 - 6.RNA結合タンパク質、RNA配列特異性
RNAに結合するタンパク質は大きく分けて、決まったRNAの配列に結合するもの(RNA配列特異的)とRNAの配列によらず結合するもの(RNA配列非特異的)が存在する。RNA配列特異性を持つRNA結合タンパク質は、決まった種類のRNAのみを制御できる。 - 7.次世代シーケンサー
DNAの塩基配列を決定するための装置で、DNA断片の塩基配列を同時並行的に、かつ高速・高精度に決定できる。 - 8.トランスクリプトーム
ゲノムDNAを鋳型としてRNA分子が合成されることを転写(トランスクリプション)と呼び、転写の結果合成されたRNA分子のことを転写産物と呼ぶ。細胞中にはさまざまなRNA分子がそれぞれの量で存在している。このようなRNA分子の総体を、転写産物を表す「トランスクリプト」に総体を表す接尾語「オーム」をつなげて「トランスクリプトーム」と呼ぶ。 - 9.点突然変異
ゲノム塩基配列中で一塩基のみ変異したもの。点変異ともいう。
国際共同研究グループ
理化学研究所
開拓研究本部
岩崎RNAシステム生化学研究室
主任研究員 岩崎 信太郎(いわさき しんたろう)
国際プログラム・アソシエイト 陈 明明(ちぇん みんみん)
基礎科学特別研究員 七野 悠一(しちの ゆういち)
テクニカルスタッフI 水戸 麻理(みと まり)
研修生 斉藤 大寛 (さいとう ひろのり)
袖岡有機合成化学研究室
主任研究員 袖岡 幹子(そでおか みきこ)
専任研究員 闐闐 孝介(どど こうすけ)
特別研究員(研究当時) 藤原 広一(ふじわら こういち)
生命機能科学研究センター
翻訳構造解析研究チーム
チームリーダー 伊藤 拓宏(いとう たくひろ)
技師 髙橋 真梨(たかはし まり)
環境資源科学研究センター
技術基盤部門 生命分子解析ユニット
技師 淺沼 三和子(あさぬま みわこ)
カリフォルニア大学サンフランシスコ校 Department of Cell and Tissue Biology Helen Diller Family Comprehensive Cancer Center
助教授 スティーブン・フロー(Stephen N. Floor)
カリフォルニア大学バークレー校 Department of Molecular and Cell Biology
助教授 ニコラス・インゴリア(Nicholas T. Ingolia)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金若手研究A「翻訳開始因子パラログによる選択的翻訳の網羅的解析(研究代表者:岩崎信太郎)」、同新学術領域研究「Chasing translation along the time by novel ribosome profiling(研究代表者:岩崎信太郎)」、同新学術領域研究「ピコルナウイルスの2Aペプチドの終止コドン非依存的翻訳終結の構造基盤(研究代表者:伊藤拓宏)」、同新学術領域研究「ウイルスが引き起こす非標準的な翻訳機構の構造基盤(研究代表者:伊藤拓宏)」、同基盤研究B「HCV IRESによるリボソーム・ハイジャックの分子機構(研究代表者:伊藤拓宏)」、同挑戦的研究(萌芽)「重力による翻訳制御の網羅的解析研究(代表者:岩崎信太郎)」、同学術変革領域研究(B)「新規Disome-Seq法: パラメトリックなリボソーム渋滞の網羅的探索(代表者:岩崎信太郎)」、同基盤研究(C)「がん細胞イメージングを目指した共有結合型蛍光プローブの開発(代表者:闐闐孝介)」、同基盤研究(C)「光照射による蛍光基NBD脱離を利用したNBD標識ペプチドの同定(代表者:淺沼三和子)」、同特別研究員奨励費「基本翻訳因子パラログに潜む選択性を利用した環境適応機構(代表者:七野悠一)」、日本医療研究開発機構(AMED)AMED-CREST「生理活性代謝物と標的タンパク質同定のための基盤技術の創出(代表者:袖岡幹子)」、武田科学振興財団ライフサイエンス研究継続助成「抗がん作用をもつ翻訳阻害剤Rocaglamide Aの作用機序の解明(研究代表者:岩崎信太郎)」による支援を受けて行われました。
原論文情報
- Mingming Chen, Miwako Asanuma, Mari Takahashi, Yuichi Shichino, Mari Mito, Koichi Fujiwara, Hironori Saito, Stephen N. Floor, Nicholas T. Ingolia, Mikiko Sodeoka, Kosuke Dodo, Takuhiro Ito, and Shintaro Iwasaki, "Dual targeting of DDX3 and eIF4A by the translation inhibitor rocaglamide A", Cell Chemical Biology, 10.1016/j.chembiol.2020.11.008
発表者
理化学研究所
開拓研究本部 岩崎RNAシステム生化学研究室
主任研究員 岩崎 信太郎(いわさき しんたろう)
国際プログラム・アソシエイト 陈 明明(チェン ミンミン)
基礎科学特別研究員 七野 悠一(しちの ゆういち)
テクニカルスタッフI 水戸 麻理(みと まり)
研修生 斉藤 大寛(さいとう ひろのり)
開拓研究本部 袖岡有機合成化学研究室
主任研究員 袖岡 幹子(そでおか みきこ)
専任研究員 闐闐 孝介(どど こうすけ)
特別研究員(研究当時) 藤原 広一(ふじわら こういち)
生命機能科学研究センター 翻訳構造解析研究チーム
チームリーダー 伊藤 拓宏(いとう たくひろ)
技師 髙橋 真梨(たかはし まり)
環境資源科学研究センター 技術基盤部門 生命分子解析ユニット
技師 淺沼 三和子(あさぬま みわこ)
 岩崎 信太郎
岩崎 信太郎
 陈 明明
陈 明明
 七野 悠一
七野 悠一
 水戸 麻理
水戸 麻理
 斉藤 大寛
斉藤 大寛
 袖岡 幹子
袖岡 幹子
 淺沼 三和子
淺沼 三和子
 闐闐 孝介
闐闐 孝介
 藤原 広一
藤原 広一
 伊藤 拓宏
伊藤 拓宏
 髙橋 真梨
髙橋 真梨
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
