理化学研究所(理研)生命医科学研究センター免疫細胞治療研究チームの清水佳奈子上級研究員、藤井眞一郎チームリーダー(科技ハブ産連本部創薬・医療技術基盤プログラム副プログラムディレクター)らの共同研究グループは、ヒトの体内に存在する季節性コロナウイルス[1]に対する「記憶免疫キラーT細胞[2]」が認識する抗原部位を発見し、その部位が新型コロナウイルス(SARS-CoV-2)のスパイクタンパク質[3](Sタンパク質)領域にも強く交差反応[4]することを示しました。
本研究成果は、SARS-CoV-2の重症度診断、ワクチン効果診断、治療薬の開発に貢献すると期待できます。
今回、共同研究グループは、日本人に多いヒト白血球型抗原(HLA)[5]タイプのHLA-A*24:02に結合するSARS-CoV-2のSタンパク質中のエピトープ[6]の同定に成功しました。季節性コロナウイルスに対する記憶免疫キラーT細胞は、このエピトープを交差認識し、SARS-CoV-2に対して抗ウイルス効果を示します。HLA-A*24:02を持つ健常人の多くがこの交差反応性キラーT細胞を持っているのに対し、造血器腫瘍患者では少ないことが分かりました。しかし、造血器腫瘍患者でも効率よくキラーT細胞を誘導できるエピトープ群が集中する「ホットスポット」があることを見つけ、世界で初めて同定しました。このホットスポットエピトープでSARS-CoV-2感染細胞を刺激すると、眠っていた季節性コロナウイルスに対する記憶免疫キラーT細胞が極めてよく反応します。
本研究は、科学雑誌『Communications Biology』オンライン版(12月2日)に掲載されました。
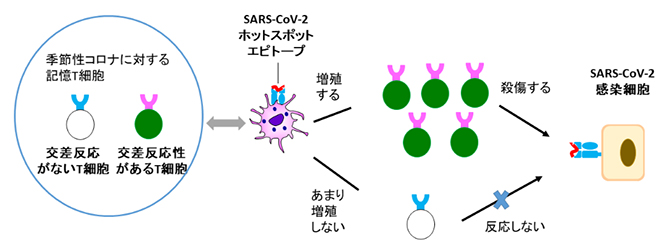
交差反応性T細胞のSARS-CoV-2感染に対する役割
背景
2020年以降、新型コロナウイルス(SARS-CoV-2)による新型コロナウイルス感染症(COVID-19)のパンデミック(世界的大流行)が続いています。SARS-CoV-2の表面に存在するスパイクタンパク質(Sタンパク質)を使ったメッセンジャーRNA(mRNA)ワクチンなどが開発され、明確な効果が示されているものの、終息にはまだ至っていません。一方で、日本人のCOVID-19の感染者数や死亡者数の割合は欧米に比べて低いことが知られていますが、その理由は不明です。
一般にウイルス感染症では、抗体がウイルスの体内侵入を防御しますが、ウイルスが体内に侵入した場合は、免疫細胞の「CD8陽性細胞傷害性T細胞(以下、キラーT細胞)」が活躍します。キラーT細胞は、感染細胞上でヒト白血球型抗原(HLA)に提示された抗原の一部(かけら)を認識し、感染細胞を全て破壊することで、重篤化を防いでいます。この抗原のかけらは「エピトープ(抗原決定基)」と呼ばれるウイルスの特定の構造単位で、数個のアミノ酸などからなる配列(ペプチド)です。従って、重篤なCOVID-19を防ぐにはエピトープを見つけることが重要です。しかし、これまでエピトープの探索は主に欧米人で行われており、日本人に多いHLAのタイプである「HLA-A*24:02」と親和性の高いエピトープに関するT細胞の反応性の詳細は不明でした。
ヒトコロナウイルスにはSARS-CoV-2のほかに、季節性の感染(いわゆる風邪)をもたらす「季節性コロナウイルス(HKU1、OC43、NL63、229E)」と、過去に重篤な症状を伴うMERS(中東呼吸器症候群)ウイルス(MERS- CoV)、SARS(重症急性呼吸器症候群)ウイルス(SARS-CoV-1)が存在します。私たちは季節性コロナウイルスには感染経験があるため、その「記憶免疫キラーT細胞」が体内に存在しています。しかし、その記憶免疫キラーT細胞がSARS-CoV-2やその変異株に対しても殺傷効果を示す、つまり「交差反応」をするかどうかは検証されていませんでした。その理由には、季節性コロナウイルスのエピトープには候補が多いことや、末梢血に含まれるT細胞が少ないためにキラーT細胞を増幅させることが難しいことなどが挙げられます。
研究手法と成果
エピトープの同定
共同研究グループは、SARS-CoV-2のSタンパク質領域に存在するエピトープに着目し、まずインシリコスクリーニング[7]により、HLA-A*24:02に親和性の高い6種類のエピトープ候補(それぞれ9個のアミノ酸からなるペプチド)を選び出しました。そして、これまで使用してきたがんに対するT細胞評価系を改良してSARS-CoV-2に対する解析系を樹立し、6種類の中から最も有力なエピトープとして、Pep#3(QYIペプチド:QYIKWPWYI)を同定しました(図1左)。さらに、同定したQYIペプチドがHLA-A*24:02を持つ健常人の末梢血から80%以上という高い確率でキラーT細胞を誘導できること、また誘導されたキラーT細胞がサイトカイン[8]を産生したり、細胞傷害活性を示したりすることが分かりました(図1右)。
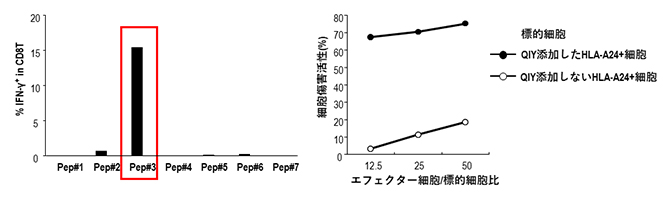
図1 エピトープの同定(左)と誘導されたキラーT細胞の細胞障害活性(右)
- 左)HLA-A*24:02陽性健常人の抹消血を用いて、HLA-A*24:02と親和性が高いと予測された6種類のウイルス抗原ペプチド(Pep#1~#6、#7はコントロール)のどれがキラーT細胞を効率的に誘導できるか検証した。その結果、Pep#3(QYIペプチド)が最も有力であることが分かった。
- 右)QYIペプチドを添加したHLA-A*24:02陽性細胞はキラーT細胞を誘導し、細胞傷害活性を示した。
興味深いことに、SARS-CoV-2由来のQYIペプチド(エピトープ)は、他の四つの季節性コロナウイルス(HKU1、OC43、NL63、229E)が該当するペプチドのアミノ酸配列と高い相同性を持つことも分かりました(図2)。これは、季節性コロナウイルスの既感染の結果生じた記憶免疫キラーT細胞が、SARS-CoV-2由来のQYIペプチドにも交差反応する可能性を示しています。
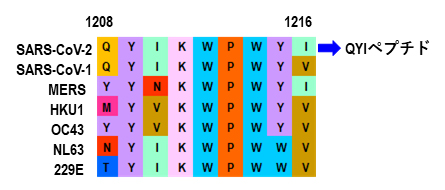
図2 QYIペプチドと他のコロナウイルスの該当するペプチドのアミノ酸配列との相同性
SARS-CoV-2由来QYIペプチドは、SARS-CoV-1のほかに季節性コロナウイルス(HKU1、OC43、NL63、229E)やMERS由来該当ペプチドとも相同性が高いことが分かった。Qはグルタミン、Yはチロシン、Iはイソロイシン、Kはリシン、Wはトリプトファン、Pはプロリン、Vはバリン、Nはアスパラギン、Tはトレオニンを示す。
白血病や悪性リンパ腫など造血器腫瘍患者は、COVID-19のハイリスク群であるといわれています。そこで、健常人と造血器腫瘍患者においてSARS-CoV-2由来QYIペプチドに対するキラーT細胞の反応性(誘導効率)を調べたところ、健常人では18人中15人(83.3%)が反応したのに対し、造血器腫瘍患者では27人中4人(14.8%)しか反応しませんでした(図3)。この結果は、造血器腫瘍患者では、病気の進行、あるいは化学療法によりキラーT細胞の免疫が健常人に比べて極めて低下していることを示しています。
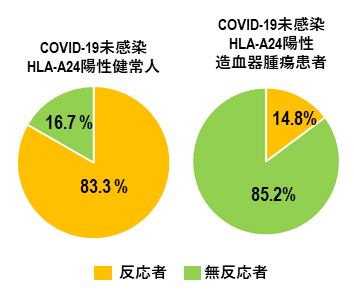
図3 QYIペプチドに特異的キラーT細胞の誘導効率
健常人(左)に比べて造血器腫瘍患者(右)は、QYIペプチドに反応するT細胞の保有率(黄色)が極めて低い。
さらに、SARS-CoV-2由来QYIペプチド以外で、季節性コロナウイルスとの相同性が比較的高く、かつHLA-A*24:02に対する親和性が高いエピトープをSARS-CoV-2のSタンパク質領域で探しました。すると、QYIペプチドの周辺にエピトープ群が集中する「ホットスポット」が存在することが分かりました。実際に、このホットスポットに対応する長いペプチド(27アミノ酸)を用いて、健常人および造血器腫瘍患者におけるキラーT細胞の反応性を調べたところ、健常人では100%、造血器腫瘍患者でも65%がホットスポットに反応することが明らかになりました。
キラーT細胞の交差反応性の検証
SARS-CoV-2と季節性コロナウイルスのエピトープ(ペプチド)に対するキラーT細胞の交差反応性を検証するために、QYI ペプチド反応性キラーT細胞株(HLA-A*24:02陽性健常人および造血器腫瘍患者)にSARS-CoV-2由来QYIペプチドと季節性コロナウイルス由来該当ペプチドをそれぞれ添加し、交差反応性を調べました。遺伝学的特徴により、7種類のヒトコロナウイルスはアルファコロナウイルス(229E、NL63)とベータコロナウイルス(SARS-CoV-2、SARS-CoV-1、MERS、HKU1、OC43)の二つに分類されます。QYI ペプチド反応性キラーT細胞株は、SARS-CoV-2と同じグループのベータコロナウイルス(HKU1、OC43)に対し83~100%の人が、別グループのアルファコロナウイルス(229E、NL63)に対しても58~67%の人が反応することが分かりました。
また、SARS-CoV-2由来QYIペプチドおよび季節性コロナウイルス由来該当ペプチドとキラーT細胞の機能的アビディティー(結合力)を定量的に調べました。ペプチド濃度の希釈系列(7段階)を作製し、キラーT細胞の反応性をインターフェロンガンマ(IFN-γ)[9]の産生で定量し、キラーT細胞の50%効果濃度(EC50)[10]を求めたところ、SARS-CoV-2と季節性コロナウイルスに対するEC50はほぼ同等の値であることが分かりました(図4)。この結果は、SARS-CoV-2交差反応性キラーT細胞が季節性コロナウイルスとSARS-CoV-2の両方に対して機能的に同等な結合力を持つこと、つまり健常人に存在する季節性コロナウイルスに対する記憶免疫キラーT細胞が至適条件下でSARS-CoV-2に反応し得ることを示しています。
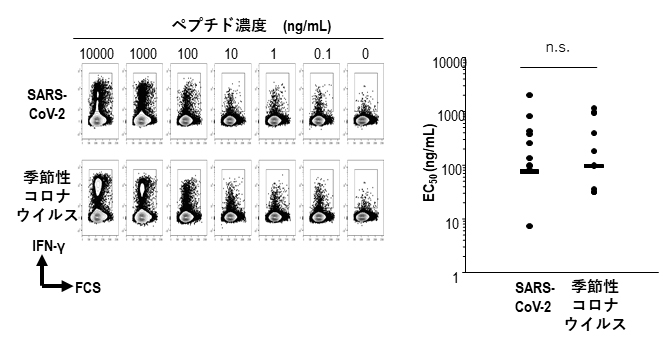
図4 QYIペプチド反応性キラーT細胞の交差反応性
SARS-CoV-2由来QYIペプチドおよび季節性コロナウイルス由来該当ペプチドの7段階の希釈系列(0~10,000ng/mL)を作製し、SARS-CoV-2と季節性コロナウイルスに対するキラーT細胞の反応性を調べた。QYIペプチド反応性キラーT細胞は、QYIペプチドにも季節性コロナウイルス由来ペプチドに対してほぼ同等の50%効果濃度(EC50)を示すことから、季節性コロナウイルスに対する記憶免疫キラーT細胞は十分にSARS-CoV2に反応することが分かった。
さらに、T細胞表面に存在するT細胞受容体(TCR)[11]における1細胞レベルでの交差反応性を検証するために、4人(健常人3人、造血器腫瘍患者1人)から4種のTCR遺伝子をクローニングし、別のTCRを発現していないT細胞株へ遺伝子を導入しました。ヒトコロナウイルス間での交差反応性を同様に評価したところ、四つのTCRのタイプはそれぞれの人でペプチド認識パターンが異なっていました。TCR1はヒトコロナウイルス由来の全てのペプチドによく反応するのに対し、TCR2はSARS-CoV-1とSARS-CoV-2由来のペプチドにしか反応しませんでした。TCR3はベータコロナウイルスのSARS-CoV-1、SARS-CoV-2とアルファコロナウイルス(NL63、229E)由来のペプチドに反応し、TCR4はベータコロナウイルス(SARS-CoV-1、SARS-CoV-2、MERS、HKU1、OC43)由来のペプチドだけに反応しました。このように、1細胞レベルでTCRの選択的多様性が存在することを証明しました(図5)。
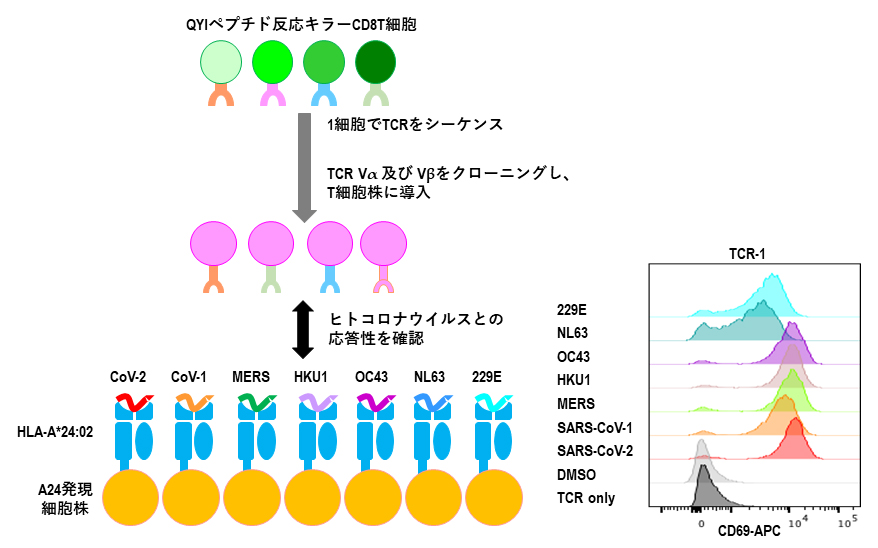
図5 QYIペプチド反応性キラーT細胞受容体レベルでの交差反応性
QYIペプチド反応性キラーT細胞を1細胞ソーティングし、T細胞受容体(TCR)遺伝子をクローニングし、別のT細胞株に導入して、SARS-Cov-2および他のヒトコロナウイルスの該当エピトーブに交差反応性の程度を比較検証した。四つのTCRについて調べたところ、図に示すように季節性コロナウイルスに対する記憶免疫キラーT細胞は多様性をもって季節性コロナウイルスだけでなく、他のコロナウイルス(MERS、SARS-Cov-1)およびSARS-Cov-2に十分反応できることが分かった。
最後に、TCRレベルでの交差反応性とHLA-A*24:02-ペプチド複合体の立体構造との関係を調べるため、HLA-A*24:02と3種類のペプチド(SARS-CoV-2、229E、HKU1由来)の結晶構造を解析しました(図6)。その結果、三つの結晶構造はおおよそ類似しており、9個のアミノ酸のうち、2番目(P2)と9番目(P9)はHLAに結合するアンカーで、P1/P4/P5はTCRα鎖[11]に、P7/P8がTCRβ鎖[11]に結合する部位であることが示されました。
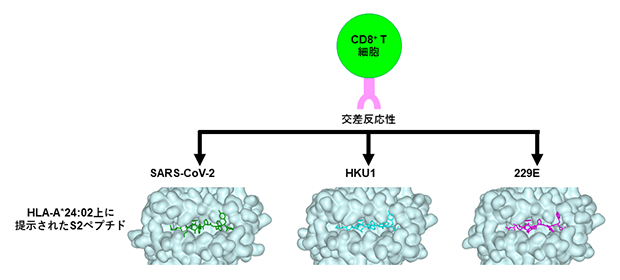
図6 HLA-A*24:02とSARS-Cov-2、HKU1、229E由来ペプチドの複合体の立体構造
立体構造はペプチドのHLA-A*24-02(水色)への結合部位を示したものであり、アルファコロナウイルス(229E)、ベータコロナウイルス(SARS-Cov-2、HKU1)ともに類似していることが分かる。この類似性により、キラーT細胞はほぼ同等レベルで反応しているといえる。
今後の期待
日本人のCOVID-19感染者数や死亡者数の割合は、欧米と比べて低いことが知られていますが、その根拠は明確ではありません。この理由を探るため、本研究では日本人に多いタイプのキラーT細胞が認識する抗原部位を探索し、実際に多くの人が反応する部位を同定することに成功しました。また、SARS-CoV-2に対する記憶免疫キラーT細胞の反応が、日本人では季節コロナウイルスとの交差反応性が高いことが分かりました。一方で、一部のがん患者(造血器腫瘍患者)では交差反応しにくいことも判明したことから、感染予防のためにはさらなる解析が必要です。
今後、ワクチン接種者や既感染者について詳しく調べることで、本研究で得られた結果がブレークスルー感染や重症化の予防の指標になると考えられます。また、今回同定したホットスポットは、記憶免疫キラーT細胞をSARS-Cov-2に向かうようにさせるキラーT細胞型ワクチンになり得るため、例えばワクチン抵抗性者の治療法の開発に貢献することが期待できます。
補足説明
- 1.季節性コロナウイルス
ヒトに感冒を引き起こすヒューマンコロナウイルス(HCoV)で、1960年以降4種類(OC43、229E、NL63、HKU1)が知られており、既に人類と共存している。 - 2.記憶免疫キラーT細胞
T細胞は、獲得免疫システムの中核を成す細胞で、血液中や組織の中など体中に存在する。細胞表面に存在する分子によって大きくCD4陽性T細胞とCD8陽性T細胞の2種類に分類される。CD4陽性T細胞は、抗原を認識すると他の免疫細胞を活性化するなどの機能を持ち、CD4陽性ヘルパーT細胞とも呼ばれる。一方、CD8陽性T細胞は、他の細胞を直接殺傷する機能を持つため、CD8陽性キラーT細胞とも呼ばれる。抗原に感作されたT細胞は増殖し活性化した後、一部は記憶免疫化し、次に抗原にさらされた場合に素早く反応する機能を獲得する。 - 3.スパイクタンパク質
ウイルスの表面にあるタンパク質で、感染する際に細胞表面にある受容体に結合する。 - 4.交差反応
ある抗原に特異的な抗体やT細胞などが、類似した別の抗原にも反応すること。 - 5.ヒト白血球型抗原(HLA)
クラス1とクラス2に大別されるタンパク質であり、クラス1はヒトの全身のほぼ全ての細胞に発現している。外来物(ウイルス)やがんなどの異質な物質をエピトープとして提示し、細胞性免疫を誘導する役割を担う。HLAはHuman Leukocyte Antigenの略。 - 6.エピトープ
T細胞、B細胞などが抗原と結合する際には、抗原全体を認識するのではなく、抗原の比較的小さな部位を認識して結合する。この部位をエピトープ(抗原決定基)と呼び、6~10個のアミノ酸や5~8個の単糖の配列から成る。 - 7.インシリコスクリーニング
細胞生物学的、生化学的な手法を主とする創薬候補物質の探索に対して、コンピュータ(シリコンチップ)の中で行うスクリーニングのこと。 - 8.サイトカイン
細胞同士の情報伝達に関わるさまざまな生理活性を持つ可溶性タンパク質の総称。 - 9.インターフェロンガンマ(IFN-γ)
抗原刺激や微生物感染に反応してT細胞(ヘルパーT細胞:Th1細胞)などから分泌される。抗腫瘍作用、抗ウイルス能増強、マクロファージやNK細胞の活性化などさまざまな機能がある。 - 10.50%効果濃度(EC50)
分子や細胞、個体に作用させた薬剤の量と反応の関係を表す指標。ある薬剤について、最大効果の半分(50%)の反応(薬効)を引き起こす用量を50%効果濃度と呼ぶ。 - 11.T細胞受容体(TCR)、TCRα鎖、TCRβ鎖
T細胞の細胞表面にある受容体で、抗原を認識して細胞内に活性化刺激を伝える。胸腺でT細胞が成熟するときに受容体遺伝子が再構成され、一つ一つのT細胞に異なる受容体が発現する。キラーT細胞、ヘルパーT細胞のTCRはα鎖とβ鎖の二量体から構成される。
共同研究グループ
理化学研究所
生命医科学研究センター 免疫細胞治療研究チーム
上級研究員 清水 佳奈子(しみず かなこ)
研究員 伊豫田 智典(いよだ とものり)
チームリーダー 藤井 眞一郎(ふじい しんいちろう)
(科技ハブ産連本部 創薬・医療技術基盤プログラム 副プログラムディレクター)
生命機能科学研究センター タンパク質機能・構造研究チーム
技師 村山 美幸(むらやま みゆき)
チームリーダー 白水 美香子(しろうず みかこ)
国立病院機構 熊本医療センター
臨床検査部長 原田 奈緒子(はらだ なおこ)
副院長 日高 道弘(ひだか みちひろ)
原論文情報
- Kanako Shimizu, Tomonori Iyoda, An Sanpei, Hiroshi Nakazato, Masahiro Okada, Shogo Ueda, Miyuki Kato-Murayama, Kazutaka Murayama, Mikako Shirouzu, Naoko Harada, Michihiro Hidaka, and Shin-ichiro Fujii, "Identification of TCR repertoires in functionally competent cytotoxic T cells cross-reactive to SARS-CoV-2", Communications Biology, 10.1038/s42003-021-02885-6
発表者
理化学研究所
生命医科学研究センター 免疫細胞治療研究チーム
上級研究員 清水 佳奈子(しみず かなこ)
チームリーダー 藤井 眞一郎(ふじい しんいちろう)
(科技ハブ産連本部 創薬・医療技術基盤プログラム 副プログラムディレクター)
報道担当
理化学研究所 広報室 報道担当
お問い合わせフォーム
